急性低压低氧对大鼠血脑屏障相关连接蛋白和通透性的影响※
马倩倩,张 昱,申香群,朱沁芳,杜忠蕾,Muhammad Shoaib Tahir,周义玲,袁周阳,刘 杰,汪晓洲,张 伟*
(1.青海大学医学院,青海 西宁 810001;2.青海省高原医学应用基础重点实验室,青海 西宁 810001;3.青海大学附属医院,青海 西宁 810001;4.四川大学华西医院,四川 成都 610041)
低压低氧对人体各系统有显著的损害性影响,尤以中枢神经系统为重。研究表明,Claudin-5、Occludin和ZO-1是目前公认的紧密连接相关蛋白,这些蛋白的改变直接影响血脑屏障的结构和功能。Tetsuhiro等人[1]在小鼠脑创伤的模型中发现,脑组织中的HIF-1α表达上调可引起AQP4的表达上调致BBB通透性的增加。本研究通过研究急性低压低氧对大鼠脑组织的HIF-1α、AQP4和紧密连接蛋白Claudin-5、Occludin、ZO-1的表达和形态学变化,探讨急性低压低氧对大鼠血脑屏障相关连接蛋白和通透性的影响。
1.材料与方法
1.1 实验动物
8周龄健康雄性SD大鼠48只,体重200±20 g,由西安交通大学医学部实验动物中心提供,许可证号:SCXK(陕)2018-001。动物的使用和处理经青海大学医学院实验动物伦理委员会批准。大鼠饲养在青海大学医学院动物房,饲养环境:海拔2 260 m(574mmHg,PO2120.1mmHg),清洁级,温度为(20±2)℃,相对湿度为(40±5)%;昼/夜交替(12:12);自由摄取标准维持颗粒饲料(北京科澳协力饲料有限公司)和水。适应性喂养一周后,随机分为正常对照组和7000m低压低氧24、48、72h组,对照组大鼠不做任何处理,其余3组大鼠放入低压舱(模拟海拔7000m,305mmHg,PO263.7mmHg)。
1.2 实验试剂与仪器
Evens Blue(Sigma,货号:E2129),甲酰胺(Sigma,货号:V900064),H.E.染色试剂盒(Solarbio,货号:G1120),PrimeScriptTMRT reagent Kit with gDNA Eraser(Takara,货号:RR047A),TB GreenTMPremix EX TaqTMⅡ(Takara,货号:RR820A),Anti-beta Actin antibody(Abcam,货号:ab115777),Anti-Aquaporin 4 antibody(Abcam,货号:ab46182),Anti-Occludin antibody(Abcam,货号:ab167161),ZO-1 Polyclonal Antibody(Invitrogen,货号:61-7300),BCA蛋白测试盒(Thermo Fisher Scientific,货号:A53225),12-230 kDa Wes Separation Module(PorteinSimple,货号:SM-W004)。实验动物低压模拟舱(西安富康空气净化设备工程有限公司,型号:HCPⅢ D800),酶联免疫检测仪(帝肯上海贸易有限公司,型号:infinite M200 PRO)、石蜡切片机(德国莱卡仪器有限公司,型号:LEICA RM2235)、实时荧光定量PCR仪(Bio-rad,型号:CFX96)、全自动蛋白质表达定量分析系统(PorteinSimple,型号:WesTM)。
1.3 PCR 引物序列
在NCBI数据库中查询大鼠(Rattus norvegicus)mRNA相应的基因号[AQP4(NM_001142366.2);Claudin-5(NM_001106266.1);Occludin(NM_031329.2);ZO-1(NM_031701.2);HIF-1α(NM_024359.1);actin(NM_031144.2)],委托TAKARA公司合成,引物序列如表 1所示。

表1 PCR 引物序列
1.4 实验方法
1.4.1 血脑屏障通透性测定
每组取大鼠6只,在解剖前24h于腹腔注射2% EB溶液(2mL/kg体重)。24h后麻醉,迅速取出全脑用滤纸吸净血液,然后从中间切成两半。称取100 mg右侧半脑,加入3 mL甲酰胺,剪碎、孵育(60℃,24h)、离心取上清液。用酶标仪测定620 nm波长处已知不同浓度EB上清液的OD值,根据标准曲线计算各组大鼠脑组织中的EB含量。
1.4.2 相关基因mRNA表达量检测
取大鼠脑组织100 mg ,按Trizol试剂说明提取组织总RNA。使用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒合成cDNA。严格按照TB GreenTMPremix EX TaqTMⅡ试剂盒说明书进行逆转录反应,采用CFX96实时荧光定量PCR仪进行两步法扩增。实验所得数据采用2-ΔΔCt法进行相对定量分析,以管家基因actin的Ct值标准化目的基因Ct值,检测HIF-1α、AQP4和紧密连接Claudin-5、Occludin、ZO-1 mRNA的表达量。
1.4.3 AQP4、Occludin、ZO-1蛋白表达水平检测
在冰上称取脑组织约50 mg,加适当比例RIPA蛋白裂解液用全自动研磨仪匀浆,静置(4℃,30min)裂解、离心(4℃,12000r/min,20min),取上清液测定蛋白浓度。根据Wes Separation Modul说明书要求制备蛋白样品并加样,实验结果以目的条带灰度值/β-actin灰度值表示。
1.4.4 病理学观察
每组取大鼠2只,麻醉,迅速解剖,完整取出大脑,立即用0.9%生理盐水清洗、10%中性甲醛溶液固定,固定2天后,切取脑片做样品,并继续固定,用常规方法制片于光学显微镜下观察、拍照。
1.5 统计学方法
2.结果
2.1 脑含水量测定结果
与对照组相比,低压低氧72h组脑含水量增加,无统计学意义(P>0.05)。各处理组间大鼠脑组织含水量无显著性差异(P>0.05),具体数据见表2。

表2 脑含水量测定结果
2.2 血脑屏障通透性测定结果
与对照组相比,低压低氧24h组和72h组EB含量呈升高趋势,低压低氧48h组EB含量降低,具体数据见表3。其中,低压低氧24h组EB含量显著增加(P<0.05),而低压低氧72h组EB含量增加无统计学意义(P>0.05),但低压低氧48h组EB含量显著下降(P<0.05)。

表3 血脑屏障通透性测定结果
2.3 相关基因mRNA的表达量检测结果
大鼠脑组织相关基因mRNA表达量检测结果如表4所示。AQP4 mRNA表达量在各组间大鼠无显著性差异。与对照组、低压低氧24h组、72h组相比,低压低氧48h组Claudin-5 mRNA表达量明显增多,具有统计学意义(P<0.05)。低压低氧48h组和72h组,与对照组、低压低氧24h组相比,Occludin mRNA和ZO-1 mRNA的表达量明显增多(P<0.05)。与对照组、低压低氧24h组、48h组比较,低压低氧72h组HIF-1α mRNA的表达量明显增多,具有统计学意义(P<0.05)。

表4 相关基因mRNA的表达量检测结果
2.4 AQP4、Occludin、ZO-1蛋白的表达水平检测结果
与对照组相比,低压低氧24h组和48h组AQP4蛋白表达水平无明显差异,统计学无意义(P>0.05);低压低氧72h组大鼠脑组织AQP4蛋白表达明显上升,差异具有显著性(P<0.05),具体情形见图1。相比于对照组、低压低氧24h组和48h组,低压低氧72h组Occludin蛋白表达水平明显上升,具有统计学意义(P<0.05),具体情形见图2。与对照组相比,低压低氧48h组ZO-1蛋白表达水平明显上升,差异具有显著性(P<0.05),具体情形见图3。
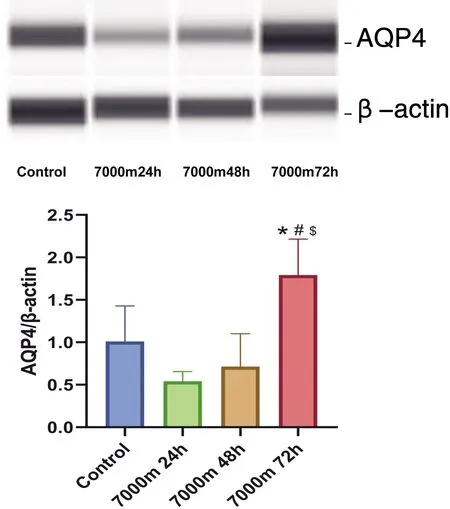
*:与对照组比较,P<0.05;#:与7000m24h组比较,P<0.05;$:与7000m48h组比较,P<0.05

*:与对照组比较,P<0.05;#:与7000m24h组比较,P<0.05;$:与7000m48h组比较,P<0.05
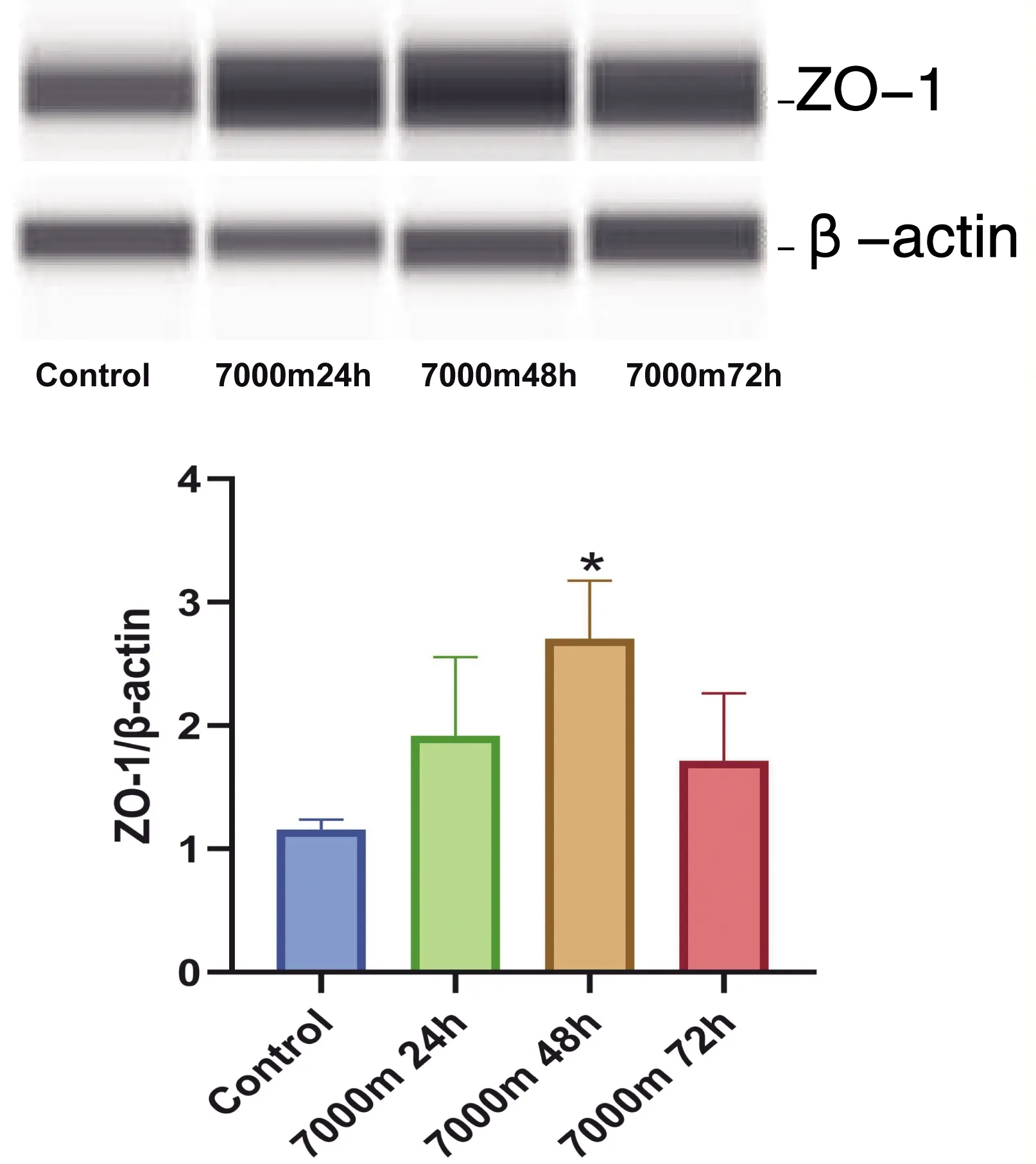
*:与对照组比较,P<0.05
2.5 大鼠脑组织病理学观察结果
对照组大鼠脑组织结构完整,神经元形态正常,血管外周间隙小。经过不同缺氧条件的处理后,低压低氧各组神经元核深染,细胞周间隙和血管周间隙开始增大。与对照组相比,低压低氧24h组形态变化不明显;低压低氧48h组偶见细胞空泡化;低压低氧72h组大鼠脑组织细胞空泡化增多、水肿明显,胶质细胞增生显著,具体情形见图4。
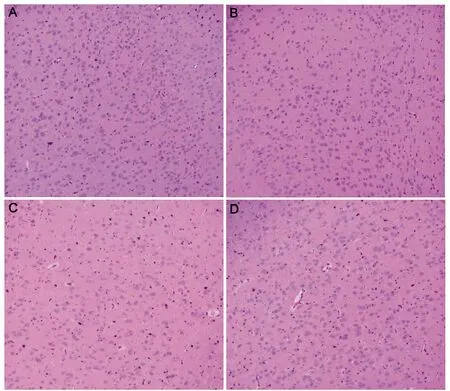
A:正常对照组,B:7000m24h组,C:7000m48h组,D:7000m72h组
3.讨论
本研究结果显示,急性低压低氧可使脑组织HIF-1α表达呈时间依赖性升高,通过影响AQP4、Occludin、ZO-1蛋白表达水平,增加低压低氧下血脑屏障的通透性。
本研究通过对西宁地区(海拔2260m)饲养大鼠和经模拟低压舱(海拔7000m)处理的大鼠进行研究,探讨急性低压低氧对大鼠血脑屏障通透性和紧密连接蛋白表达的影响。研究结果显示,对照组大鼠较为活跃,而各低压低氧处理组大鼠出现活动度降低、进食饮水偏少、背毛竖立、体重下降等现象,尤其以低压低氧48h组最为严重,这种改变与发生高原反应人群的临床表现(如情绪焦躁、厌食、运动失调)相吻合[2]。研究发现[3],低氧会引起HIF介导的多个基因的转录翻译改变,引起机体能量代谢失调、体液平衡紊乱和氧化应激发生……
开展血脑屏障通透性的相关研究,可以为多种中枢神经系统疾病的发生及发展机制和提高临床治疗效果提供理论依据[4]。湿干重法是基于完全脱水前后的脑组织重量测定的,将脱水前的重量表示为“湿重”,脱水后的重量表示为“干重”。实验结果显示,各组间大鼠脑含水量无显著性差异,表明急性低压低氧暴露未引起脑组织含水量明显变化。由于颅腔本身容积有限且颅骨弹性很小,其颅内容积代偿仅为整个颅腔容积的10%。据相关文献报道,湿干重法是一种较为粗略的评估方式,存在一定的实验误差[5]。在正常生理条件下,血脑屏障(blood brain barrier,BBB)结构的完整性保证了蛋白质及其他的大分子物质不能透过BBB,当脑组织受到损伤时,由于白蛋白是血液中分子量最小的蛋白,因此可最先通过BBB,注射EB后,EB可与白蛋白结合进入脑组织,作为检测BBB是否被破坏的示踪剂[6]。血脑屏障通透性测定结果显示,与对照组相比,低压低氧24h组EB含量显著增多,表明7000m24h组大鼠脑组织已经受损,BBB遭到破坏,导致通透性增强,蛋白质及其他大分子物质便可通过BBB。这一实验结果与Schoch等人的研究结果相吻合,他们发现低氧小鼠BBB通透性增加导致荧光素染料渗漏增多[7]。EB在脑组织中的含量增加,表明BBB细胞旁通路开放,该“裂隙”通常被紧密连接蛋白调控。
脑微血管内皮细胞之间的紧密连接是血脑屏障的结构基础,是具有调节作用的复杂细胞系统。现有研究表明,Claudin-5、Occludin、ZO-1是目前公认的紧密连接相关蛋白,这些蛋白的改变直接影响血脑屏障的结构和功能。本实验评估了紧密连接蛋白Claudin-5、Occludin、ZO-1 mRNA的表达量以及Occludin、ZO-1蛋白的表达水平。结果显示,低压低氧48h组Claudin-5 mRNA的表达量明显高于对照组、低压低氧24h组和72h组,且具有统计学意义。Claudin-5是血脑屏障上表达最丰富的紧密连接蛋白[8],对小分子物质细胞旁路通透性的调节起着重要作用。研究表明[9],缺氧预处理可在创伤性脑损伤早期上调Claudin-5的表达,从而增强脑血管内皮细胞紧密连接的功能,进而保护血脑屏障的完整性,减轻创伤性脑损伤内片后脑水肿的发生。某些药物可增加claudin-5的表达,通过增加跨内皮阻抗(transepithelial electrical resistance,TEER)减少BBB的通透性[10]。与正常对照组和低压低氧24h组相比,低压低氧48h和72h组大鼠Occludin、ZO-1 mRNA的表达量明显增多,具有统计学意义。Western blot结果显示,相比于对照组、低压低氧24h组和48h组,低压低氧72h组大鼠脑组织Occludin的表达明显上升。与对照组相比,低压低氧48h组大鼠脑组织ZO-1的表达明显上升,且差异具有显著性。BBB的结构稳定与紧密连接蛋白的表达、翻译后修饰、亚细胞定位和蛋白-蛋白的交互作用有关。EK等[11]研究了新生儿缺氧缺血性脑病模型中血脑屏障和局部脑血流的变化,发现缺氧数小时后血脑屏障通透性增加,这种屏障的开放与紧密连接蛋白基因表达上调有关。当ATP缺乏时,紧密连接的胞质附着蛋白7H6能可逆地与紧密连接蛋白分离,而细胞间的ZO仍保持连接致细胞间通透性增高[12]。在缺氧早期,紧密连接蛋白的表达和定位均无变化,随着缺氧时间的延长,它们才开始重新分布。Wachtel等[13]认为BBB紧密连接蛋白对缺氧有一定耐受性,缺氧仅使紧密连接“门”的功能受到影响,但是其“栅栏”功能仍可保留一段时间。
水通道蛋白是一类促进水分子和其他小分子被动转运的跨膜蛋白。AQP4是中枢神经系统中起主导性作用的水通道蛋白。动物学研究提示[14],缺氧后AQP4的表达具有一定的时间依赖性。星形胶质细胞主要通过活性物的分泌、基因的转录和蛋白质的合成协同作用参与BBB的维持与形成。目前认为星形胶质细胞通过其足突上高表达的AQP4调控脑的水平衡[15]。本实验结果显示,与对照组相比,7000m72h组大鼠脑组织AQP4的表达明显上升,且具有统计学意义。HIF-1α在细胞低氧应答反应中起核心作用,当组织器官出现缺血缺氧表现时,细胞内普遍出现HIF-1的聚集,加强糖酵解反应,为细胞提供能量,从而改善细胞的物质代谢水平,缓解高原低氧对人体的影响[16]。正常条件下,HIF-1α很少表达,但在缺氧情况下其表达明显上调。本研究结果显示,与对照组相比,低压低氧组大鼠脑组织HIF-1α mRNA表达量均呈时间依赖性升高(P<0.05)。Tetsuhiro等人[1]在小鼠脑创伤模型中发现,脑组织中HIF-1α表达上调,进而可以使AQP4以及MMP9的表达上调而致BBB通透性增加。研究表明[17],在低氧血症基础上,高碳酸血症可以通过调控HIF-1α-AQP4-MMP9信号通路,最终增加血脑屏障的通透性。
综上所述,急性低压低氧状态下,HIF-1α表达呈时间依赖性升高,通过影响AQP4、Claudin-5、Occludin和ZO-1的表达,提高血脑屏障通透性致血脑屏障破坏。

