罗库溴铵注射液水解降解杂质含量预测研究
付 强,柯 锐,朱柄甲,徐兴志,刘君洋,王志云,陆伟跃
(1. 浙江华海药业股份有限公司,浙江 台州 317000; 2. 复旦大学药学院,上海 201303)
罗库溴铵注射液是荷兰N.V.Organon 公司开发的全身麻醉辅助用药,用于常规诱导麻醉期间的气管插管,以及维持手术中骨骼肌的神经肌肉阻滞,是临床常用的手术辅助用药[1]。本研究中将经典恒温法应用于罗库溴铵注射液稳定性预测中,评估稳定性试验中降解杂质增长情况和有效期,以辅助产品开发和申报。现报道如下。
1 仪器与试药
1.1 仪器
SevenMultiS400 型pH 计(梅特勒-托利多公司);e2695/2489 型高效液相色谱仪/紫外检测器(沃特世公司);XS105DU 型电子分析天平(梅特勒-托利多国际有限公司,精度为十万分之一);Million-Reference 型超纯水机(默克化工技术有限公司);DHG-9076A 型恒温鼓风干燥箱(上海精宏实验设备有限公司);SHH-220SD 型药品稳定性试验箱(重庆永生实验仪器厂)。
1.2 试药
罗库溴铵注射液为实验室自制,批号为20180501,规格分别为每支50 mg ∶5 mL,100 mg ∶10 mL,于2 ~8 ℃条件下保存。
2 方法与结果
2.1 溶液制备
取5 支注射液,置干燥玻璃器皿中,混匀,精密移取2.0 mL,用乙腈稀释10 倍,即得供试品溶液,其中活性成分罗库溴铵的浓度为1.64 mmol/L。
2.2 含量与有关物质分析
2.2.1 色谱条件
色谱柱:Ultimate® SiO2柱(250 mm×4.6 mm,5 μm);缓冲液:50 mmol/L 四甲基氢氧化铵缓冲液,用磷酸调pH 至7.4;流动相:缓冲液-乙腈(10 ∶90,V/ V);流速:1.5mL/min;检测波长:210nm;柱温:35℃;进样量:20μL。
2.2.2 含量和有关物质分析
分别采用质量浓度为1.00,0.02 mg/mL 的罗库溴铵供试品溶液作为对照品溶液,各杂质的相对响应因子以1.00 计算。含量和有关物质分析高效液相色谱法参照2015 年版《中国药典(二部)》[2]。分离度溶液典型图谱见图1。各已知杂质分离度均≥1.5。经方法学考察确认,专属性良好,线性关系好(R2=0.999 9),样品加样回收率介于99.5% ~101.2%(n =6),精密度试验结果的RSD 为0.90%(n =6),均符合要求。
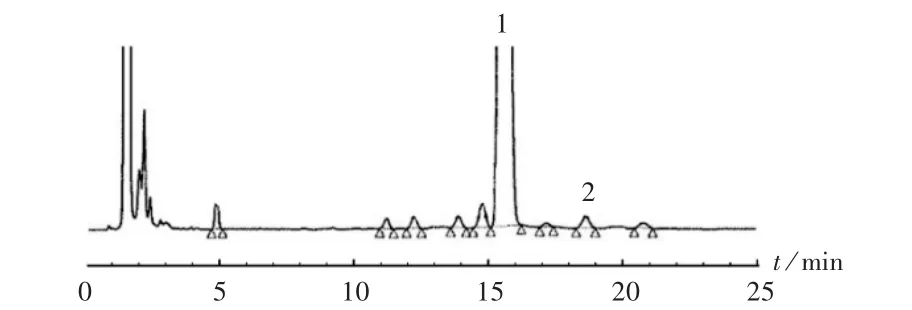
图1 罗库溴铵注射液分离度溶液的高效液相色谱图Fig.1 HPLC chromatograms of the separation solution of Rocuronium Bromide Injection
2.3 加速和影响因素试验评估
根据国内仿制药开发和稳定性研究要求,在本品稳定性研究中,对产品性状、澄清度与颜色、细菌内毒素、可见异物、不溶性微粒、无菌、pH 值、含量、有关物质9个检测项进行控制。所有检测项的限度标准均与2015年版《中国药典(二部)》要求一致。详见表1。上述任何一个检测项超出既定控制标准均会导致产品的稳定性超出有效期。
为评估本品稳定性放置过程中各检测项的超标风险,取样品,置40 ℃稳定性试验箱中,分别于放置0,5,10,15,30 d 后取出,按成品稳定性标准进行检测。结果见表1。随着在40 ℃条件下放置时间的延长,杂质V 含量从0.39%迅速增加至1.33%,增长明显,而其他杂质限度均低于限度标准且无超标趋势。将样品置60 ℃稳定性试验箱中,分别于放置0,5,10 d 后取出,杂质V 含量从0.39%迅速增加至3.00%,放置10 d 后明显超出限度标准(≤2.0%),罗库溴铵含量从100.4% 降至95.7%,发生明显变化,但未超出稳定性限度标准。pH 值等其他检测结果在40 ℃和60 ℃加速试验条件下,均符合成品稳定性标准且无超标趋势。表明杂质V 为主要增长的降解杂质,在所有质量控制项目中超标风险最高,故预测杂质V 的含量可推测产品的稳定性和有效期。
2.4 包装规格与放置方式影响考察
罗库溴铵注射液中的杂质V 是罗库溴铵分子中甾体母核17 位乙酸酯水解为羟基的降解产物,该降解反应为典型的水解降解反应,反应速率与温度的关系符合Arrhenius 方程[4-7]。通过预测该杂质含量可评估产品的杂质增长情况,推测产品的稳定性和有效期。
罗库溴铵注射液为西林瓶包装,开发规格为每支50 mg ∶5 mL 或100 mg ∶10 mL,注射液开发中需对每个规格试验批次进行正置和倒置稳定性研究。为评估包装规格和正/倒置对杂质V 降解速率的影响,取样品置(25±2)℃试验条件,分别于放置0,5,10,15,30 d 后取出,检测有关物质。正/倒置和不同规格罗库溴铵注射液的杂质V 增长速率基本一致,且杂质Ⅴ和未知杂质含量也未见明显差异,表明包装规格和正/倒置对杂质V 增长速率的影响较小。详见图2。
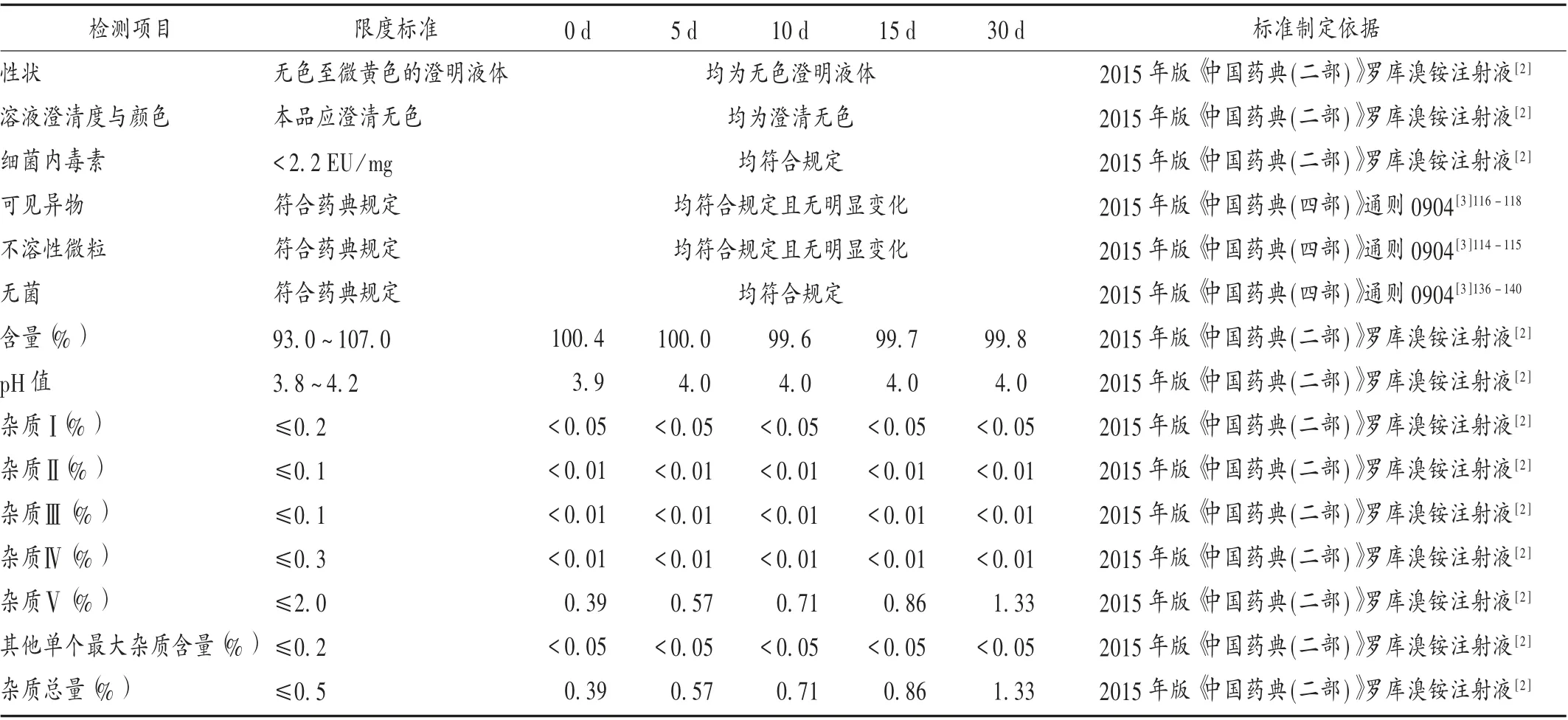
表1 罗库溴铵注射液40 ℃加速试验结果Tab.1 Results of the accelerated test of Rocuronium Bromide Injection at 40 ℃
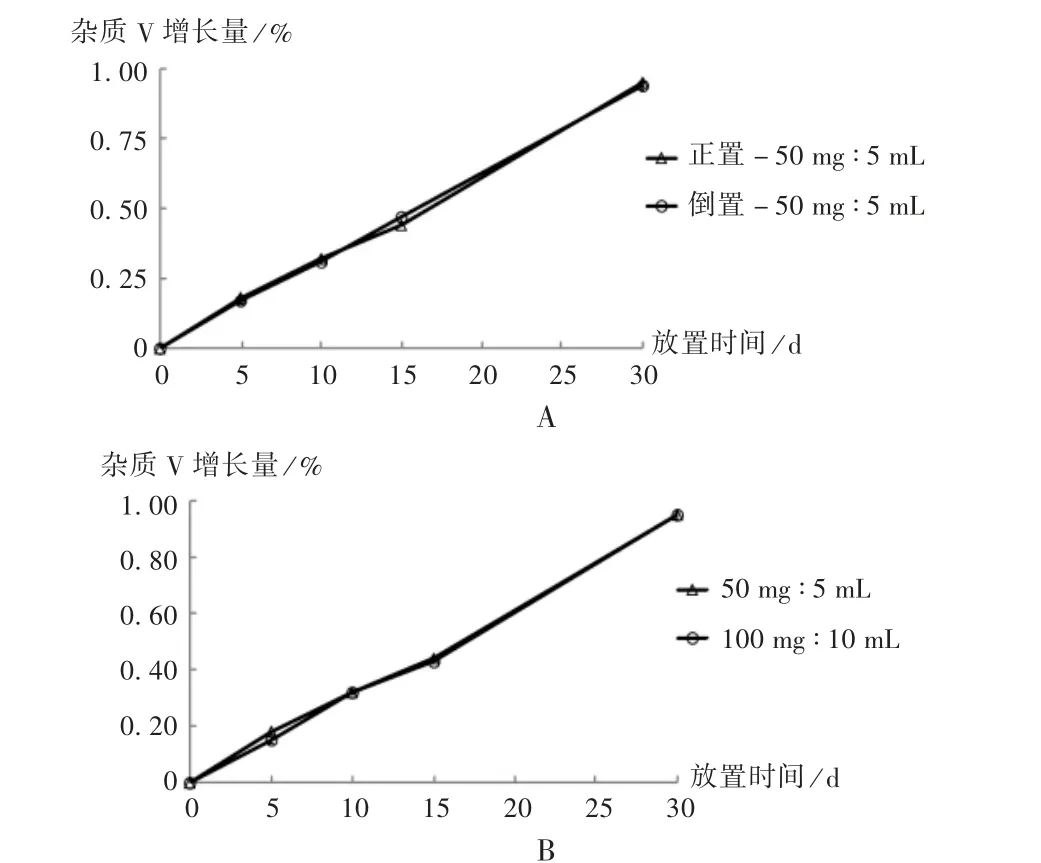
图2 (25±2)℃长期试验条件下样品杂质V 含量Fig.2 The content of impurity V in the sample under the longterm test condition at (25 ±2)℃
2.5 经典恒温试验
参照Arrhenius 方程-lnK =Ea/R×(1/ T)-lnA。式中,K 为反应速率常数[mol/(L·h)];A 为频率因子常数[mol/(L·h)];Ea 为反应活化能(J/mol);R 为摩尔气体常数[8.314 J/(mol·K)];T 为绝对温度(K)。
通过测定不同温度条件下杂质V 的生成速率,求得Arrhenius 方程中的未知数,预测长期稳定条件下的杂质V 含量。取样品若干支,分别在25 ~71 ℃条件下正置放置720 h 后取出,进行含量和有关物质分析。
2.6 反应速率常数K 值及活化能确定
不同温度条件下的放置时间和杂质V 含量检测结果见表2。罗库溴铵注射液为水溶液注射剂,不同温度条件下的加速试验中,活性成分含量在95.8% ~98.8%之间,表明水和罗库溴铵2 种反应物的浓度变化均很小,生成杂质V 的酯水解反应可近似认为是零级反应,反应符合方程C =K t +C0。式中,C 为杂质V 的实时浓度;C0为杂质Ⅴ的初始浓度;K 为杂质Ⅴ生成反应的反应速率常数;t 为反应时间。在不同温度条件下,以杂质V 的浓度C(%)对反应时间t(h)作线性回归曲线,方程的斜率即为杂质V 的生成速率。由表2 可知,所有线性回归方程的回归系数均良好。将表2 中的百分比浓度数值转换为摩尔浓度数值,以反应速率的负对数(-lnK)对反应温度的倒数(1/ T)作线性回归方程,得-lnK =9 765.601 74×(1/ T)-24.511 96,R2=0.999 4,方程的斜率为 E a / R,截距为- ln A。求得 E a 为81 191.2 J/mol,A 为7.25×108mol/(L·h)。
2.7 产品有效期计算
罗库溴铵注射液长期稳定性储存条件为(5±3)℃,根据Arrhenius 方程,5℃和8℃长期稳定性储存条件下,杂质V生成反应速率常数K 分别为4.10×10-7mol/(L·h)和5.96×10-7mol/(L·h)。求得8 ℃最差条件下,杂质V含量达到2015 年版《中国药典(二部)》规定的限度值(≤2.0%)所需时间至少为60 个月,足够支持上市产品药品说明书规定的36 个月有效期。
2.8 预测与实测结果对比
分别选择3 批每支50 mg ∶5 mL 规格正置生产批次和3 批每支100 mg ∶10 mL 规格倒置生产批次,开展长期稳定性研究。以杂质V 预测增长量或3 批注射液杂质V 平均实测增长量对放置时间作图。详见图3。同一规格生产批次不同放置时间杂质V 含量的实测值标准偏差均≤0.02%,表明不同批次间杂质V 含量差异较小。50mg∶5 mL 规格正置生产批次杂质V 含量从0个月的(0.39±0.02)%增加到长期24 个月的(0.86±0.02)%,平均增加(0.47±0.02)%;100 mg ∶10 mL 规格倒置生产批次杂质V 含量从0 个月的(0.41±0.02)%增加到长期24 个月的(0.88±0.02)%,平均增加(0.47±0.02)%。不同批次间杂质V 增长速率基本一致,增长情况的实测值和预测值基本吻合,表明通过稳定性预测研究评估本品杂质V 的增长情况是可行的。
同时,对生产批次所有检测项的实测结果进行分析,除杂质V 外的其他检测项均未发生明显变化,暂无超标风险。包装规格和正、倒置对杂质V 的增长速率无明显影响。表明通过Arrhenius 方程计算杂质V 的增长情况,可以预测罗库溴铵注射液的有效期,是辅助产品开发和申报的有效数据。
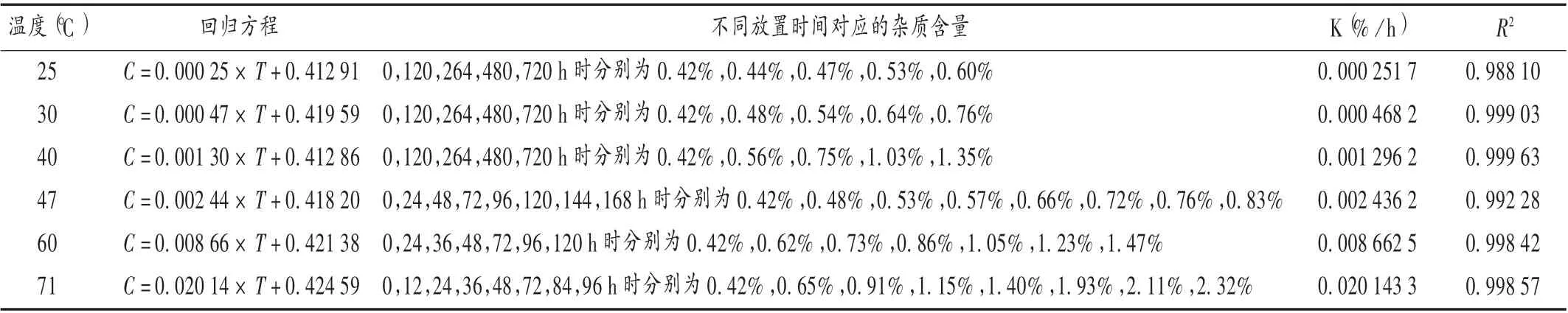
表2 不同温度条件下杂质V 含量对反应时间的线性回归方程及反应速率常数Tab.2 The linear regression equation of impurity V content on reaction time and the reaction-rate constant at different temperatures
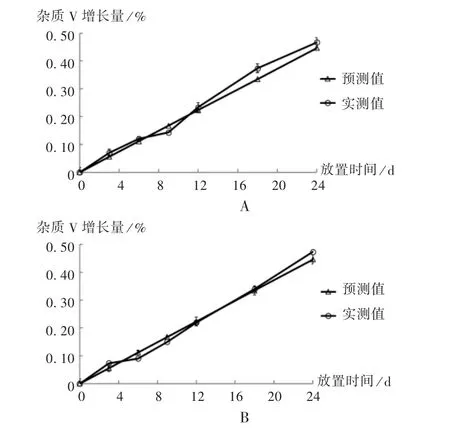
图3 (5 ±3)℃长期试验条件下3 批样品实测平均值及预测值Fig.3 Measured average values and predicted values of three batches of samples under the long-term test condition at (5 ±3)℃
3 讨论
注射液开发通常需要根据原研药药品说明书开展为期数年的长期稳定性研究[8],长期稳定性试验中任一检查项结果超出限度标准均会导致产品开发风险,故评估产品的有效期是注射液开发的重点。为降低产品开发和稳定性研究的风险,通常会开展为期5 ~30 d 的影响因素研究,以评估不同处方工艺产品的稳定性差异。但影响因素条件过于剧烈,与产品有效期关联性较弱,往往需要开展6 ~12 个月的加速试验,才能更好地评估产品长期储存条件下的有效期,耗时较长;另外,加速试验结果超标未必表示长期稳定性试验失败。
目前,文献[9-13]报道了经典恒温法或初均速加速法在药品主成分稳定性预测方面的应用,采用Arrhenius方程测定药品主成分降解反应的活化能,进一步计算长期稳定性条件下的主成分降解情况。经典恒温法可通过1 个月的加速试验来预测主成分数年内的降解情况,时间短,可靠性高,缺点在于仅通过预测主成分的降解来评估药物的有效期,缺乏对药物杂质降解情况等其他质量控制指标的评估。首先,通过加速试验评估罗库溴铵注射液每个稳定性研究检测项的超标风险,认为罗库溴铵注射液水解产生的杂质V 增长明显,超标风险最高,其他控制项目超标风险较低,故对杂质V 含量增长情况的预测可预估产品的有效期。本研究中根据Arrhenius方程设计不同温度条件下的注射液加速试验,计算杂质V 生成反应活化能,预测产品长期稳定性条件下的有效期。
加速试验结果表明,罗库溴铵注射液杂质V 含量是产品稳定性研究中超标风险最高的指标,预测其含量增长情况可评估产品的有效期。经典恒温法主要用于预测药物活性成分的降解速率[8-10]。根据Arrhenius 方程,采用经典恒温法测定罗库溴铵注射液中杂质V 的生成反应活化能,预测长期稳定性条件下该杂质的增长情况。通过Arrhenius 方程预测的结果与生产批次长期24个月稳定性实测结果基本一致,包装规格和正置、倒置对杂质V 的增长速率无明显影响。表明方法准确、可靠,适用于本品水解降解杂质含量和有效期的预测研究。本方法有望应用于其他符合Arrhenius 方程的水解降解杂质的含量预测研究,以辅助产品的开发和申报。

