3岁男孩反复血小板减少伴溶血性贫血
曾敏慧 贺湘玲 田鑫 黄玉辉
(1.湖南省人民医院 / 湖南师范大学附属第一医院儿童医学中心血液肿瘤科,湖南长沙 410005;2.益阳市资阳妇幼保健院儿科,湖南益阳 413001)
1 病例介绍
(1)病史:患儿男,3岁8个月,因反复血小板减少3年余,再发伴发热2 d入院。患儿生后第1天因气促1 d、皮肤黄染4 h于外院新生儿科住院,无发热、血尿、惊厥。查血常规示WBC 18.1×109/L(参考值:5×109/L~12×109/L),Hb 115 g/L(参考值:110~160 g/L),血小板 21×109/L(参考值:100×109/L~400×109/L);肝功能示总胆红素451.3 μmol/L(参考值:3.4~17.0 μmol/L),间接胆红素416.3 μmol/L(参考值:3~17 μmol/L);母婴均为A型Rh阳性血型;考虑诊断为“新生儿高胆红素血症、新生儿肺炎”。予美罗培南抗感染、换血治疗、输A型Rh(D)型单采血小板、丙种球蛋白及白蛋白、蓝光治疗后好转出院。出院时血小板正常,且出院后半年内定期复查血小板均正常。2年半前患儿因“肺炎”于外院住院,伴皮肤出血点,不伴浓茶色尿,血常规示血小板及Hb均低。考虑血液系统恶性疾病或免疫性血小板减少症(immune thrombocytopenia,ITP),骨髓穿刺示骨髓增生明显活跃,粒系增生活跃,形态无异常,红系增生明显活跃,淋巴细胞无明显增减,全片巨核细胞大于200个,血小板成堆分布,不支持恶性血液疾病。治疗上予头孢唑肟抗感染、丙种球蛋白(1 g/kg×1 d)及甲泼尼龙(2 mg/kg×5 d)治疗后好转出院,出院继续口服泼尼松(每天2 mg/kg,1个月内减停)。2年前再次因发热、皮肤出血点于外院住院,入院第2~3天出现浓茶色尿,查血小板 15×109/L,Hb 109 g/L, 总 胆 红 素 56.4 μmol/L, 间 接 胆 红素47.1 μmol/L,尿潜血阳性,予丙种球蛋白(500 mg/kg×2 d)及泼尼松(每天2 mg/kg,口服4~6周减停)治疗,血小板缓慢上升。3个月前患儿因发热、腹泻于当地医院就诊,有浓茶色尿,查血小板 18×109/L,Hb 96 g/L,总胆红素增高,以间接胆红素增高为主。诊断考虑“血小板减少查因:Evans综合征、ITP?”,治疗上予头孢他啶抗感染、丙种球蛋白(500 mg/kg×2 d)及甲泼尼龙[10 mg/kg×4 d,后改为泼尼松(每日2 mg/kg ,1个月内减停)]治疗后,血小板在 50×109/L~90×109/L间持续3个月后恢复正常。2 d前患儿再次出现反复高热,最高体温39.3℃,查血小板60×109/L,无皮肤出血点,无浓茶色尿,无皮肤、巩膜黄染,为求进一步查明病因收入我科。
(2)个人史、既往史、家族史:患儿系第1胎第1产,既往体质弱,有多次住院病史,生长发育正常,无过敏史。父母身体健康。家族中无近亲结婚史,无血尿及血小板减少病史。
(3)入院体检:体温39℃,脉搏124次/min,呼吸30次/min,血压98/52 mm Hg,体重17.7 kg(在-SD至+SD之间),身高106 cm(在-SD至+SD之间)。急性面容,神志清楚,全身皮肤黏膜无黄染、出血点及瘀斑,浅表淋巴结无肿大。心肺体检无异常,肝、脾肋下未扪及,无四肢、手指畸形。
(4)辅助检查:血常规(入院当天):血小板 60×109/L(参考值:101×109/L~320×109/L);血常规(入院第5天):血小板 104×109/L,网织红细胞116×109/L(参考值:24×1012/L~84×1012/L),网织红细胞比值2.85%(参考值:0.5%~1.5%);肝功能:总胆红素46.20 μmol/L(参考值:5.1~20.0 μmol/L),间接胆红素29.58 μmol/L( 参 考 值:5.1~20.0 μmol/L), 乳 酸 脱 氢 酶(lactate dehydrogenase, LDH):570 U/L(参考值:100~240 U/L);免疫全套:IgA 0.41 g/L(参考值:0.58~1 g/L),IgG 6.43 g/L(参考值:6.6~10.39 g/L);尿常规:红细胞总数 62.2个/μL(参考值:0~18个/μL),尿蛋白 1+(参考值:阴性),尿胆原34 μmol/L(参考值:3.2~16.0 μmol/L)。C 反应蛋白14.84 mg/L(参考值:0~10 mg/L);降钙素原0.09 ng/mL(参考值:0~0.05 ng/mL);电解质、血糖、凝血功能、肾功能正常, 直接抗人球蛋白试验(direct antiglobulin test, DAT)、抗核抗体谱、抗中性粒细胞胞浆抗体、抗磷脂抗体谱均阴性。葡萄糖‐6‐磷酸脱氢酶(比值法):1.66(参考值:1.0~1.66);地中海贫血基因:基因型αα/αα,βN/βN;血涂片:成熟红细胞大致正常,血小板散在分布,未见异型淋巴细胞。
2 诊断思维
患儿病例特点:(1)学龄前期男孩,出生时即起病,新生儿时期有黄疸及换血治疗史;(2)主要表现为反复感染伴血小板减少及溶血性贫血;(3)无肝脾、淋巴结肿大;(4)肾功能正常,DAT阴性,总胆红素升高,以间接胆红素升高为主,网织红细胞及LDH增高;(5)骨髓细胞学检查未见异常。
该患儿临床表现主要为反复血小板减少伴不同程度的溶血性贫血,诊断从以下两方面考虑:(1)血小板生成减少:可由于巨核细胞发育不全、受抑或骨髓浸润所致,临床常见于急性白血病、骨髓衰竭综合征、叶酸及维生素B12缺乏、恶性肿瘤骨髓转移及遗传性血小板减少症等,该患儿病程长达3年余,血小板减少可通过抗感染、丙种球蛋白、糖皮质激素治疗后缓慢恢复,但患儿网织红细胞增高,骨髓细胞学检查提示骨髓增生明显活跃,未见原始幼稚细胞,未见“老浆幼核”现象,巨核细胞数目无减少,血片未见异常血小板团块,凝血功能正常,故不支持血小板生成减少相关疾病。(2)血小板破坏增加:分为免疫性血小板减少和非免疫性血小板减少。免疫性血小板减少主要考虑①ITP:该患儿反复血小板减少3年余,既往经抗感染、丙种球蛋白及糖皮质激素治疗后血小板能缓慢恢复,但3个月前上述治疗无效,且病程中伴有不同程度的溶血性贫血,故不支持慢性ITP。②Evans综合征:一种罕见的自身免疫性血液系统疾病,为血细胞特异性自身抗体引起的血小板和红细胞破坏增加[1],临床上可同时或相继发生自身免疫性溶血性贫血和ITP,可伴有免疫性WBC减少,好发于儿童,DAT阳性[2‐3],该患儿有反复血小板减少伴溶血性贫血,但DAT阴性,故不支持Evans综合征。③抗磷脂综合征:是自身免疫介导的反复动静脉血栓形成导致的器官缺血或衰竭的一组临床综合征,可表现为抗磷脂抗体相关肾病、血小板减少、溶血性贫血等[4],该患儿有血小板减少及溶血性贫血表现,但肾功能正常,抗核抗体谱及抗磷脂抗体阴性,故不支持抗磷脂综合征。
非免疫性血小板减少多为血小板消耗增多,可见于巨大血管瘤、脉管畸形、脾功能亢进、青紫型心脏病等,但该患儿缺乏相关病史及临床表现,故不支持。故主要考虑①弥漫性血管内凝血:是许多疾病致病因素导致凝血活化,全身微血管血栓形成、凝血因子大量消耗并继发纤溶亢进,引起以出血及微循环衰竭为特征的临床综合征[5],临床表现主要为出血、休克或微循环衰竭、微血管栓塞及微血管病性溶血,该患儿有血小板减少、皮肤出血及溶血表现,但缺乏起病的始动因素,无明显大出血、休克、微循环衰竭的表现,且凝血功能正常,故不支持该病。②溶血尿毒综合征(hemolytic urothelial syndrome, HUS):是血栓性微血管病(thrombotic microangiopathy, TMA)的常见类型,90%见于儿童,根据发病机制不同,分为典型HUS和非典型HUS。典型HUS为腹泻相关HUS[6];非典型HUS特指补体替代途径调控异常引起的血管内皮功能失调和血管微血栓的形成,二者临床表现均为微血管性溶血性贫血、血小板减少及急性肾损伤[7]。该患儿有反复血小板减少伴溶血性贫血,但无血便,且肾功能正常,不支持HUS。③血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura, TTP):既往的经典五联征有发热、血小板减少、微血管性溶血性贫血、神经系统症状及肾功能不全,该患儿有发热、血小板减少及溶血性贫血病史,且DAT阴性,凝血功能正常,LDH升高,故需考虑该病。若该患儿存在肾功能不全,那么需与非典型HUS鉴别[8‐9]。需检测TTP特异性指标—血管性血友病因子(von Willebrand factor, vWF) 裂 解 酶(von Willebrand factor‐cleaving protease, ADAMTS13)活性及其抑制性抗体来协助诊断[8],必要时完善基因检测以确诊。
3 进一步检查
ADAMTS13对诊断TTP具有很高敏感性和特异性,能够将TTP与其他TMA综合征(典型HUS、非典型HUS)和血液学其他血细胞减少症区分开来[10]。ADAMTS13活性:0.23%(参考值:42.16%~126.37%),ADAMTS13活性抑制性抗体阴性(参考值:阴性)。征得患儿家属同意后,取患儿及其父母外周血各3 mL,提取DNA,进行全外显子组测序,结果提示ADAMTS13基因存在复合杂合变异:c.1045C>T(p.R349C)和c.1928T>G(p.I643S),前者来源于母亲,后者来源于父亲,见图1。根据美国医学遗传学与基因组学学会变异分 类 指 南[11],c.1045C>T(p.R349C)在 OMIM 数据库(https://omim.org)已有该位点关联先天性血栓性血小板减少性紫癜(congenital thrombotic thrombocytopenic purpura, cTTP)的致病性报道,在千人数据库(https://www.ncbi.nlm.nih.gov/variation/tools/1000genomes/)正常对照人群中该变异频率<0.001,符合PM2;已有的功能研究表明该变异为有害作用,符合PS3;多个生物信息学软件预测为有害,符合PP3;患儿表型具有高度基因特异性,符合PP4;故该变异判定为“可能致病”。c.1928T>G(p.I643S)在千人数据库正常对照人群中没有报道,符合PM2;在隐性疾病中反式检测到致病变异,符合PM3;多个生物信息学软件预测为有害,符合PP3;患儿表型具有高度基因特异性,符合PP4;故该变异判定为“可能致病”。
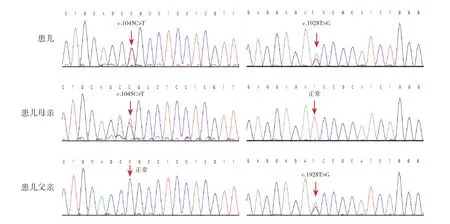
图1 患儿及其父母ADAMTS13基因Sanger测序图 患儿ADAMTS13基因存在c.1045C>T和c.1928T>G复合杂合突变,前者来源于母亲,后者来源于父亲。突变位点如箭头所示。
4 诊断及依据
诊断:cTTP。依据:(1)出生起病,有新生儿黄疸及换血治疗史;(2)反复感染后血小板减少伴溶血性贫血;(3)DAT阴性,凝血功能正常,胆红素及LDH升高;(4)ADAMTS13活性极度缺乏,ADAMTS13活性抑制性抗体阴性,ADAMTS13基因存在复合杂合变异[12]。
5 临床经过
入院后予头孢哌酮舒巴坦抗感染及输注丙种球蛋白后血小板无上升,待ADAMTS13活性检测提示极度缺乏且ADAMTS13抑制性抗体检测阴性时考虑cTTP,予输注新鲜冰冻血浆200 mL后血小板明显上升,2 d后升至正常,后基因检测结果支持cTTP。
患儿出院后2个月有发热等感染症状,查血小板>50×109/L,抗感染治疗5 d后血小板缓慢升至正常,未予输注血浆。出院后4个月再次出现发热,血小板降至29×109/L,间接胆红素增高,予输注新鲜冰冻血浆200 mL,2 d后复查血小板恢复正常,胆红素数天后缓慢降至正常。随访至出院后5个月,患儿生存状态同正常同龄儿。
6 讨论
1924年,Moschcowitz[13]首次在临床上将TTP描述为罕见的致命性TMA。全球TTP发病率约为(1.5~4)/106,以获得性多见,先天性占所有病例不到5%,儿童TTP发病率约为1/106(其中cTTP占所有儿童病例的1/3)[10,14]。其特征是微血管病性溶血性贫血、严重的血小板减少症伴或不伴弥散的微血管性血小板富集血栓形成导致的器官缺血。cTTP是由于ADAMTS13基因突变所致,该基因位于9q34上,编码的蛋白是金属蛋白酶家族的第13个成员,主要在肝星状细胞中表达,特异性切割具有促血栓作用的大分子vWF多聚体[15‐16]。全世界约有150种ADAMTS13基因突变,以常染色体隐性方式遗传,70%为错义突变[17‐18]。
cTTP发病机制为患者在遭受感染、创伤、怀孕等诱因刺激下,内皮细胞产生过多超大型vWF,由于ADAMTS13的缺乏,导致超大型vWF不能被切割成正常生理状态下的vWF多聚体,超大型vWF进入微循环与血小板异常聚集形成微血栓,致微血管狭窄,造成组织或器官缺血[19]。因此对cTTP患者在未发生严重危及生命的大出血时,应避免输注血小板,防止加重组织器官缺血。当红细胞通过微血管时,致红细胞机械性损伤,因此血涂片可见破碎红细胞,但有10%的患者可能出现阴性结果[10,19],需多次涂片验证。对于既往用于诊断TTP的五联征的历史性临床研究已经过时,因为这5种症状仅在不到10%的急性TTP患者中同时出现[9]。因此,目前临床工作中,将ADAMTS13 作为TTP的特异性标记,能够将TTP与其他TMA和其他血细胞减少症区分开来。
cTTP起病通常发生在婴儿期(包括新生儿期)或儿童早期(10岁以前),而很少发生在青春期[9]。获得性TTP在儿童或青少年中报道较少,成人多见,通常起病急剧,病死率高,多需在重症监护室抢救治疗[20]。而cTTP临床表现的严重程度、器官损伤和发作频率不一致,可能与ADAMTS13突变类型及其他遗传或环境因素有关[14]。该例患儿3年间反复多次发作,但均无大出血、严重的溶血性贫血及神经系统异常(如昏迷等),考虑可能与其基因突变类型有关。
目前,对cTTP的治疗仍然主要为补充ADAMTS13,通过应用新鲜冰冻血浆以提高ADAMTS13活性[10,21]。临床中对缓解期的cTTP患者,建议输注血浆或采取临床观察;对合并有脏器缺血损害的严重发作病例或慢性反复发作病例推荐预防治疗:每2~4周输注1次新鲜冰冻血浆以维持血小板在安全水平且临床无发作;对无脏器受累患儿给予按需治疗:当血小板<50×109/L时给予血浆;对于无症状的cTTP,强烈建议孕妇在怀孕期间进行预防性血浆输注[22]。虽然有指南提出每2~4周以血浆10~15 mL/kg输注可有效预防急性发作,但实际工作中,由于患者反复来医院输注血制品给患者家庭带来负担,降低其生活质量,同时有感染传染病风险及相关不良反应,且该患儿3年来急性发作时并无严重的大出血、重度贫血或明显的神经系统症状及肾功能不全等表现,因此我们综合考虑该患儿采取按需输注原则。随着对TTP的研究进展[23],在治疗方面也给cTTP患者带来了新的希望。BAX930是一种由中国仓鼠卵巢基因工程细胞系合成的完全糖基化的重组人ADAMTS13 蛋白[24‐25],2017 年已完成 I期多中心临床研究,结果显示重组ADAMTS13安全有效,患者对药物耐受性良好,免疫原性试验均阴性[26]。2018年1月起开展来自10个国家的多中心Ⅲ期临床试验(NCT03393975),目前正在招募中,预计在2023年完成,以评估BAX930在预防和按需治疗ADAMTS13活性<10%的重度 cTTP 患者中的安全性和有效性。这项Ⅲ 期临床试验的完成对于cTTP的患者来说将会获益[27]。
7 结语
cTTP临床极其罕见,由ADAMTS13基因突变导致ADAMTS13活性降低引起的微血管病性溶血性贫血,严重的血小板减少伴或不伴弥散的微血管性血小板富集血栓形成导致的器官缺血。主要表现为婴幼儿期的黄疸或需换血治疗,通常为感染后发生的血小板减少伴溶血性贫血,可有肾功能损害、神经系统症状及发热;实验室检查为DAT阴性、凝血功能正常,胆红素、网织红细胞及LDH升高,血涂片见破碎红细胞等,对于这些患者建议完善ADAMTS13活性检测,避免漏诊[8]。临床工作中,尤其对于小婴儿存在黄疸且伴有不明原因的血小板减少时,我们需要关注cTTP[8],可完善ADAMTS13活性及抑制性抗体检测,对ADAMTS13活性极度缺乏及抑制性抗体阴性时,可予血浆输注,同时完善基因检测以尽早明确诊断。

