白细胞介素-33对巨噬细胞极化的影响
杨笑瑞,李娅,程晓寒,朱琳,司彤彤,徐峰
(郑州大学第一附属医院 消化内科,河南 郑州 450052)
溃疡性结肠炎(ulcerative colitis,UC)是一种以黏膜和黏膜下炎症为特征的特发性慢性肠病,由于病情恶化和缓解的交替出现,其临床病程不可预测[1-2]。一般认为,遗传、微生物和环境因素相互作用最终导致免疫和非免疫反应,持续激活肠道黏膜,导致炎症发生[3-5]。既往研究一致认为,巨噬细胞极分化在UC的发展中起着重要作用。M1极化表型巨噬细胞为促炎细胞,而M2巨噬细胞为抗炎细胞,巨噬细胞的M2型极化被认为是缓解各种炎症反应的有效方法之一[6]。白细胞介素-33(interleukin-33,IL-33)是近年来新发现的IL-1家族分子,是适应性和先天免疫的关键调节剂,ST2是其特异性的受体,IL-33通过作用于ST2来诱导Th2型免疫反应[7]。有研究表明,IL-33在小鼠肠炎模型中表达水平升高,其在UC中的作用可能与调节巨噬细胞极化相关[8]。本研究进行体外实验,检测IL-33对巨噬细胞表面特异性标志物表达的影响,初步探讨其对巨噬细胞极化的影响,为今后研究IL-33在UC中的作用机制及寻求潜在作用靶点提供理论依据和实验支持。
1 材料与方法
1.1 实验动物、试剂和仪器C57BL/6J雄性SPF级小鼠[北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2019-0009],8~10周龄,质量21~30 g。IL-33、Anti-CD206、Anti-CD86、Anti-F4/80荧光抗体购于上海康朗生物科技有限公司;实时荧光定量聚合酶链式反应(real-time fluorescent quantitative polymerase chain reaction,qRT-PCR)仪购于上海英拜生物科技有限公司。
1.2 实验步骤
1.2.1体外诱导M0型巨噬细胞 将C57BL/6J雄性SPF级小鼠脱颈处死后置于体积分数为75%的乙醇中浸泡消毒。去皮剔肉后暴露股骨及胫骨,切除关节面,暴露骨髓腔,获取小鼠骨髓来源单核细胞。后以巨噬细胞分化培养基[DMEM+体积分数为10%的胎牛血清(fetal bovine serum,FBS)+ 50 μg·L-1巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)+体积分数为1%的双抗贮存液(青霉素+链霉素)]培养7 d。光镜下观察细胞形态的变化,以F4/80抗体鉴定巨噬细胞诱导成功的比率。
1.2.2分组培养 将上述诱导成功的M0型巨噬细胞根据孔序列随机分为IL-33组和对照组。对照组置于普通培养基[DMEM、体积分数为10%的FBS、体积分数为1%的双抗贮存液(青霉素+链霉素)]中,IL-33组置于含IL-33培养基[DMEM、体积分数为10%的FBS、10 μg·L-1的IL-33、体积分数为1%的双抗贮存液(青霉素+链霉素)]中,孵育24 h。
1.2.3检测两组巨噬细胞M1/M2型表型及相关基因分子的表达 每组均以相同来源的未标记单抗作为阴性对照,通过流式细胞术检测CD86(M1型巨噬细胞表型)、CD206(M2型巨噬细胞表型)的阳性比率;通过qRT-PCR法检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和精氨酸酶-1(arginase-1,Arg-1)表达(TNF-α、Arg-1分别为M1、M2型特征性分子标志物)。Arg-1上游引物序列为5’-TGCTCACACTGACATCAACACTCC-3’,下游引物序列为5’-TCTACGTCTCGC AAGCCAATGTAC-3’;TNF- α的上游引物序列为5’-TGCTCACACTGACATCAACACTCC-3’,下游引物序列为5’-TCTACGTCTCGCAAGCCAATGTAC-3’。引物序列从Primerbank查找得到。

2 结果
2.1 M0型巨噬细胞分化成功经GM-CSF刺激后,细胞形成巨噬细胞集落。第4天时,细胞不规则,有集落生成,但不多。至第6天时,已有明显的巨噬细胞集落形成,且细胞呈圆形或椭圆形,基本无伪足。与M0型巨噬细胞形态比较接近。为进一步确认,进行F4/80(M0型表型)流式鉴定。流式检测结果表明,F4/80阳性细胞率为95.3%,说明巨噬细胞M0型分化成功,见图1。
2.2 IL-33在体外可调节巨噬细胞的极化流式细胞术检测到IL-33组巨噬细胞的CD206的阳性率高于对照组,且CD86的阳性率低于对照组,差异有统计学意义(P<0.05),见图2。qRT-PCR检测各组巨噬细胞TNF-α及Arg-1的mRNA表达量,见图3。IL-33体外刺激24 h后,TNF-α的表达较对照组减少,而Arg-1的表达较对照组增加,差异有统计学意义(P<0.05)。
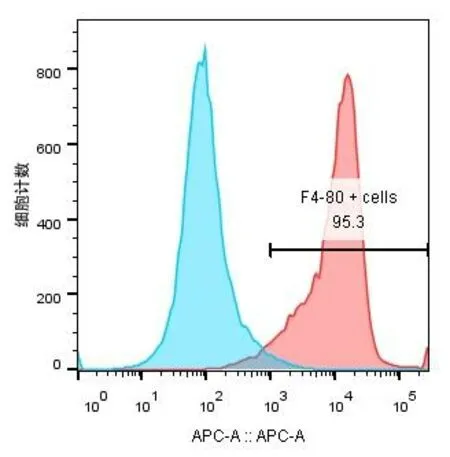
图1 M0型的流式鉴定
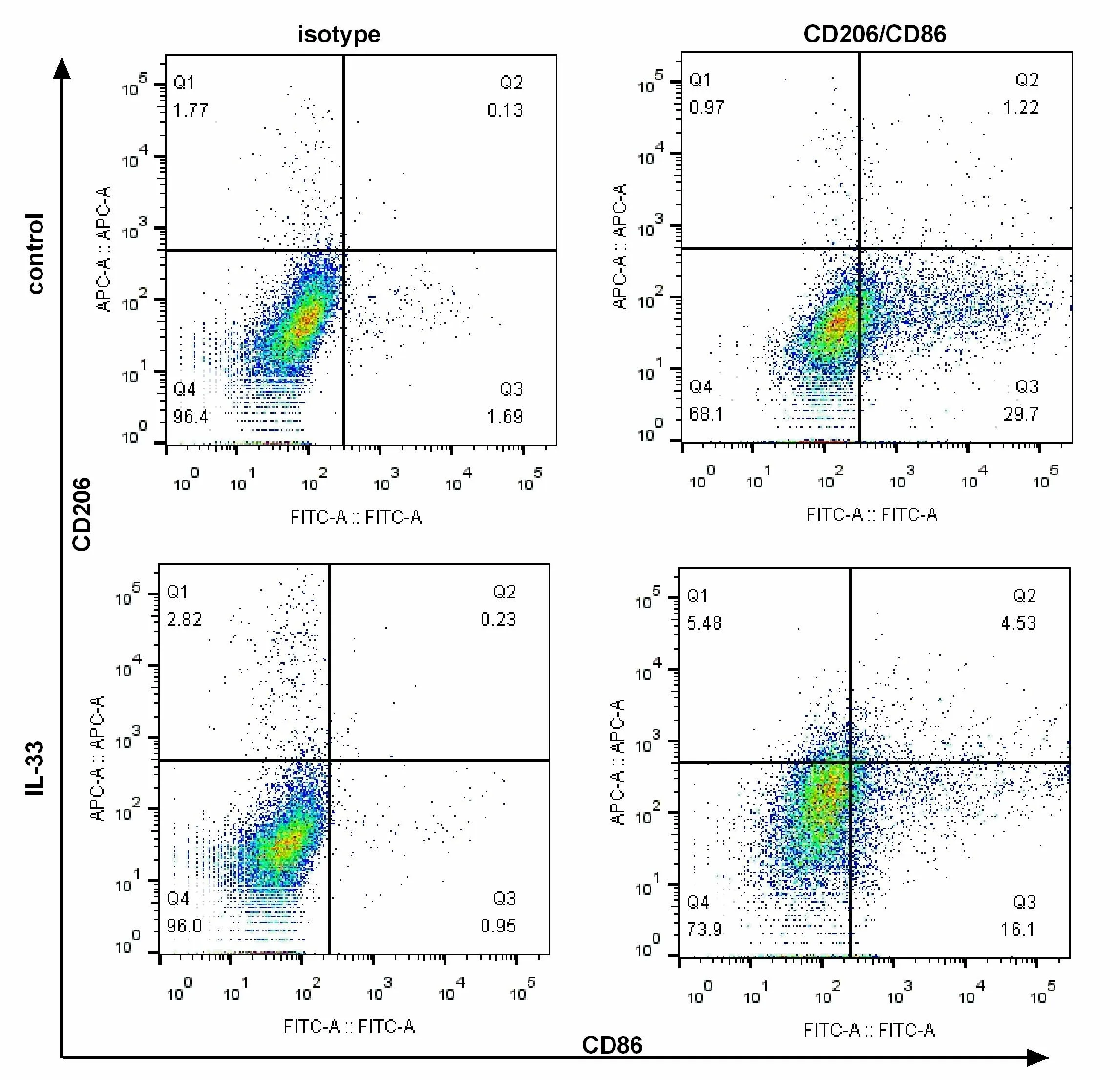
图2 M1/M2表型的流式分析
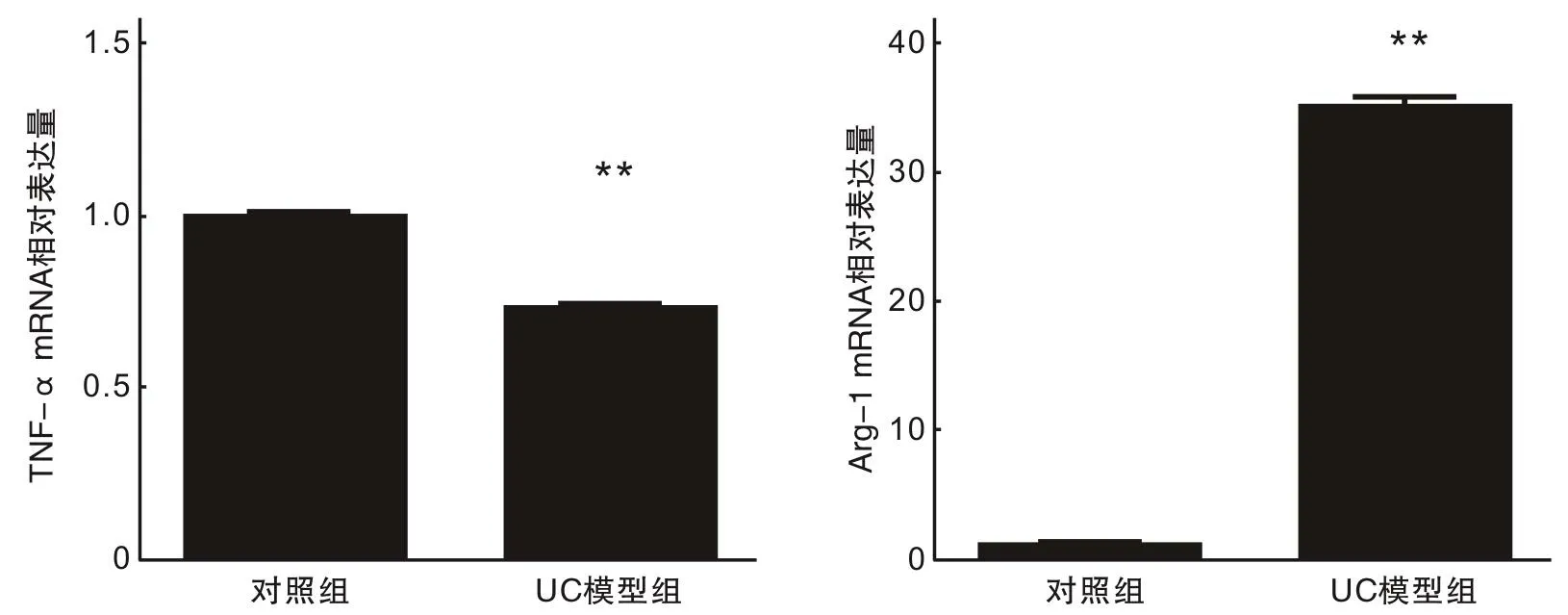
与对照组相比,**P<0.05。
3 讨论
细胞因子是由免疫细胞和某些非免疫细胞在刺激下产生的具有生物活性的一类多肽或糖蛋白,是炎症效应细胞之间信息传递的中介,通过结合相应受体来调控免疫应答。目前的研究显示细胞因子在UC的发病中起着双重作用,包括促炎与抗炎作用[9]。其中发挥抗炎作用的细胞因子主要包括IL-4、IL-10、IL-13等,发挥促炎作用的细胞因子主要有IL-1、IL-6、IL-12、干扰素等,其中IL-1在多种细胞中均有表达,也是研究最多的一种细胞因子。巨噬细胞是协调宿主先天和适应性免疫反应的关键的固有免疫细胞,作为免疫系统的控制开关,在细胞因子的调节下,通过不同的激活水平和极化状态来维持免疫稳态[10]。巨噬细胞具有很强的异质性和可塑性,在不同的微环境中可以极化为两种不同的细胞亚群,包括经典活化型(M1型)和替代活化型(M2型)。其中M1型极化主要由脂多糖或干扰素-γ诱导,其高表达IL-12,低表达IL-10和IL-4,在Th1型免疫应答中发挥重要作用,巨噬细胞的M1型过度极化会导致免疫损伤;M2型极化主要由IL-4或TGF-β等细胞因子诱导,M2型巨噬细胞高表达IL-10,低表达IL-12,主要参与Th2型免疫反应,同时可抑制Th1型免疫反应,在免疫应答中具有抑制炎症反应的功能[11]。由此可见,巨噬细胞在细胞因子的调节下进行M1/M2型极化,其极化的不同会导致细胞因子的失调,反之又加剧了巨噬细胞的极化失衡,循环往复,这被认为是UC发病的分子学基础之一[12]。
IL-33是2003年在高内皮细胞小静脉中发现的新型IL-1家族细胞因子,通过与其受体ST2结合发挥生物学效应,在调节性免疫反应中发挥作用[13]。IL-33被认为是一种同时具有促炎和抗炎双重功能的细胞因子[14]。已有研究证实IL-33在UC患者及UC小鼠模型中存在异常表达[15],但关于IL-33在UC中的作用究竟是致病性还是保护性仍未得到充分阐明,其在UC中的具体作用机制仍在探索之中。因此,本研究通过体外细胞实验检测IL-33对巨噬细胞相关分子标志物表达的影响,初步探讨其在UC炎症反应中的免疫调控作用。实验结果表明IL-33可增加CD206+细胞比率及Arg-1的表达,并降低CD86+细胞比率及TNF-α的表达,提示IL-33在体外不仅能够诱导M2型巨噬细胞极化,还能抑制M1型巨噬细胞活化,这一结果与Zhu等[16]的研究结果相吻合。M2型巨噬细胞主要参与Th2型免疫反应,同时可以抑制Th1型免疫反应,在免疫反应中可起到抑制炎症反应的作用。由此可见,IL-33可通过诱导巨噬细胞向抗炎的M2型方向极化来下调促炎因子,抑制炎症反应,产生细胞外基质,促进上皮细胞损伤修复和黏膜愈合。推测IL-33可能通过促进巨噬细胞的M2极化来改善肠道炎症,以此缓解UC。其有望成为新的治疗靶点,针对巨噬细胞极化对UC进行疾病干预,但仍需进一步研究证实。
综上所述,本研究发现IL-33在体外可促进巨噬细胞的M2型极化,推测可能与其缓解UC有一定的相关性,有望成为一种新的UC预后生物标志物及治疗靶点。有必要进行更深入的研究,探讨其在UC的不同发病阶段和不同免疫状态下的作用以及M2型巨噬细胞在UC中的具体调控机制,为UC的治疗提供新的方向。
- 河南医学研究的其它文章
- 建立可调控撕裂长度的Stanford A型主动脉夹层家猪模型

