传统影像特征与多序列影像组学模型对上皮性卵巢癌分型的价值
钱洛丹, 吴慧, 牛广明, 任嘉梁, 崔艳芬, 蔚纳
卵巢癌是妇科恶性肿瘤中最致命的一种,其中大多数起源于上皮[1]。据统计,美国每年新发卵巢癌病例约22240 例,约有14000人死于此病,5年生存率低于30%[2],中国每年新发病例约52100例,且逐年增加,死亡病例约22500例[3]。上皮性卵巢癌(epithelialovariancancer,EOC)的组织学分型是评估生存期的重要预后因素[4]。传统上,EOC被分为高、中、低分化,但最近更倾向于将EOC分为Ⅰ型和Ⅱ型,其显示出不同的分子遗传特征、形态特征、临床生物学行为和生存期[5,6]。Ⅰ型肿瘤具有惰性病程,长期局限于卵巢,早期行病侧卵巢切除是有效的。而大多数晚期I型EOC对标准的细胞毒性化学疗法不敏感,因此BRAF抑制剂和其他MAPK激酶抑制剂等靶向治疗方案被倡导[7]。Ⅰ型EOC的总体预后良好。Ⅱ型EOC具有高度侵袭性,其中75%以上的患者发现时已属晚期,在大多数情况下需要更积极的外科手术。传统的铂类化学疗法是有效的,但总体预后较差[5]。此外,有研究表明基于术中卵巢肿瘤冰冻切片的组织学诊断并非十分可靠,需要更多的定量诊断信息[8]。因此术前预测EOC组织学分型有助于患者的疾病管理和预后评估。
扩散加权成像(diffusion weighted imaging,DWI)和表观扩散系数(apparent diffusion coefficient,ADC)是评估EOC组织学分型有价值的指标[9,10]。影像组学是一个新兴领域,可以通过自动数据表征算法将医学图像转换为高维可挖掘的特征空间[11-13],在区分肿瘤组织学分型中显示出较高的价值[14-16]。本研究旨在比较传统模型与多序列影像组学模型在鉴别诊断Ⅰ型与Ⅱ型 EOC中的效能,并验证传统模型与影像组学模型联合是否在预测EOC组织学分型上更有价值。
材料与方法
1.研究对象
回顾性搜集本院2015年1月-2019年6月行盆腔MRI检查的患者。病例纳入标准:①MRI检查后3个月内接受手术治疗,术后病理证实为EOC且具有明确的国际妇产科联盟(international federation of gynecology and obstetrics,FIGO)诊断分期;②在MRI检查前未进行过放化疗或其他治疗;③肿瘤固体成分的最大直径>1.5 cm,可准确测量ADC值及勾画全肿瘤感兴趣区容积(VOI)。病例排除标准:①转诊到其他医院无准确病理结果;②病变固体成分太小;③图像质量不佳或无增强扫描图像;④双侧卵巢病变为种植性转移。最终61例患者纳入本研究(图1),年龄29~81岁,中位年龄51.8 岁。
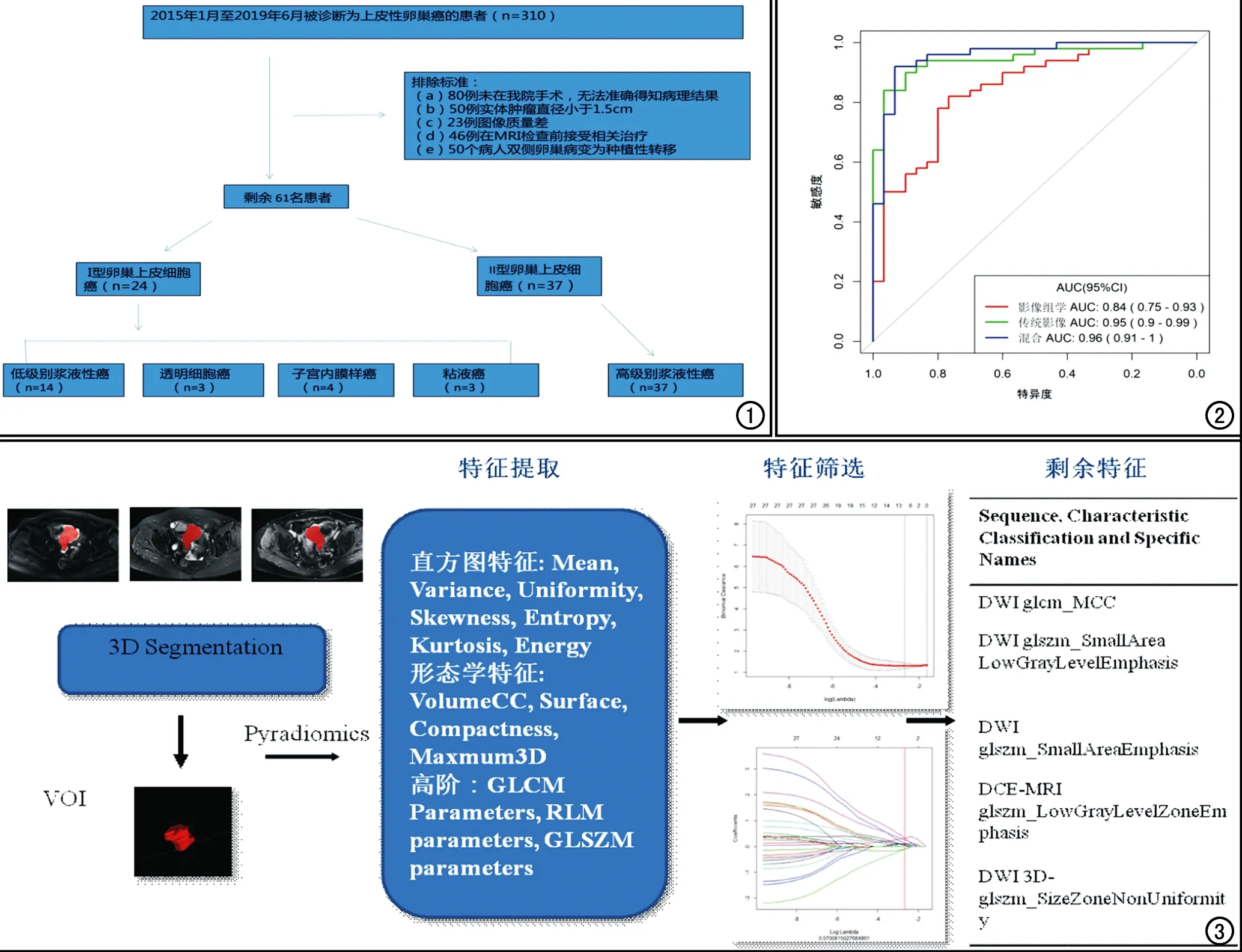
图1 患者纳入途径。 图2 影像组学模型、传统模型和混合模型的ROC曲线。 图3 影像组学的工作流程。
2.检查方法
所有MRI检查均在GE 3.0T 750 Discovery扫描仪上完成,采用8通道腹部线圈。患者检查前禁食4~6 h,并进行肠道准备(服用乳果糖和硫酸镁)。主要扫描序列包括轴面FS-T2WI、DWI和动态对比增强磁共振成像(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)。FS-T2WI自旋回波序列扫描参数:TR 4000 ms,TE 100 ms,视野280 mm×280 mm,矩阵320×192,层厚5.0 mm,间隔1.0 mm;DWI检查采用单次回波平面成像序列,扫描参数:TR 3700 ms,TE 80 ms,视野280 mm×280 mm,矩阵128×128,层厚5.0 mm,间隔1.0 mm ,b值取1000 s/mm2;DWI扫描完成后进入GE Function AW 4.6工作站,自动生成ADC参数图。DCE-MRI采用3D容积LAVA序列,经高压注射器注射对比剂钆喷酸葡甲胺(Gd-DTPA),剂量0.2 mL/kg,流率2.0 mL/s,在推注前10 s开始以10 s间隔顺序获得图像,总共320 s。
3.病理及MRI图像分析
由两位专业病理医师(妇科肿瘤诊断经验分别为10年和20年)共同阅片。根据Kurman和Shih的EOC二元模型[5],将患者分为Ⅰ型和Ⅱ型。Ⅰ型包括低级别浆液性癌、子宫内膜样癌、透明细胞癌、粘液癌和恶性Brenner肿瘤,Ⅱ型包括高级别浆液性癌、未分化癌和癌肉瘤。组织学亚型根据世界卫生组织(WHO)指南确定[17]。
由2位分别具有3年和10年妇科MRI诊断经验的放射科医师在GE PACS工作站上共同阅片,并记录以下病变特征:①最大直径;②侧向性:单侧或双侧卵巢病变;③实性成分的T2WI信号强度,分为低、中和高(与子宫肌层的信号强度进行比较);④性状:包括囊性、囊实性和实性(相当于实性成分小于1/3、1/3~2/3和超过2/3);⑤是否存在腹膜转移; ⑥腹水。形态学特征的选取与评价根据Thomassin-Naggara等[18]制定的标准。所有结果均由两位放射科医生共同决定,若为双侧病变则分别描述单侧病灶的T2WI信号强度和囊实性特征。由以上2位放射医师在DWI图像(b=1000 s/mm2)的每层高信号区手动勾画单层ROI融合成VOI,参考T2WI及对比增强T1图像,避开坏死、出血及囊变区域,获取ADC值。
5.建立传统模型、影像组学模型和混合模型
采用单因素分析以比较Ⅰ型与Ⅱ型EOC的常规MRI形态学特征和ADC值差异,再进行多因素 Logistic回归分析选择具有统计学差异的变量构建传统模型。
根据Thomassin-Naggara等[18]的研究结论,本研究中影像组学模型包括FS-T2WI、DWI和 DCE-MRI(动脉晚期)图像。3D slicer(4.10.2 版) 用于医学图像配准和重采样。根据Cohen等[19]的研究方法,在配准之前对可能影响强度不均匀性的因素进行了校正,即Z-socre标准化。由两位放射科医师采用ITK-SNAP (3.8.0 版)在DWI高信号区域沿病灶边缘连续层面勾画肿瘤ROI,参考T2WI、T1WI增强图像以避开坏死、囊变、出血区域,最终得到全肿瘤感兴趣容积VOI。基于上述强度的非刚性配准,可将描绘DWI图像的VOI转换到相应的T2WI、T1WI增强图像上,所得VOI参考重要解剖标志(如股骨头、膀胱、子宫等)进行视觉评估。两个月后,两位放射科医生随机选择 30例患者,以重新画取VOI进行一致性检验。采用PyRadiomics 软件[20]进行影像组学特征提取,包括直方图特征、形态特征以及纹理特征等三大类,纹理特征包括灰度共生矩阵(GLCM)、灰度区域矩阵(GLSZM)、灰度游程矩阵(GLRLM)和灰度依赖矩阵(GLDM),分别从每个序列中提取1070个影像组学特征。为了减少模型的过拟合或选择偏倚,采用方差分析(ANOVA)、Kruskal-Wallis检验、单变量logistic回归分析和最小绝对收缩选择算法(least absolute shrinkage and selection operator,LASSO)选择与组织学分型高度相关的特征以建立影像组学模型。
最后,结合传统特征与影像组学特征构建混合模型。同时,本研究进行了分层分析,以比较影像组学模型与传统模型在区分早期与晚期EOC中的作用。
6.统计学分析
采用R软件(3.6.0 版)进行统计学分析。采用组内相关系数(intraclass correlation efficient,ICC)评估两位放射科医生所提取的影像组学特征和ADC值的一致性。分别采用独立样本t检验(ADC值)、Chi-Squared或Fisher精确检验(MRI形态学特征)评估Ⅰ型与Ⅱ型EOC的差异。为了确保所建立模型不受数据偏差或样本量不足的影响,所有模型均通过十倍交叉验证,并重复建模20次。使用Delong检验比较不同模型之间的曲线下面积(area under curve,AUC)值差异。根据最大尤登指数的临界值计算准确度、敏感度、特异度、阳性预测值和阴性预测值。采用校准曲线评估每个模型的预测性能。通过评估阈值概率下的净收益,进行了决策曲线分析(decision curve analysis,DCA)以评估每种模型的临床实用性。以P<0.05为差异有统计学意义。
结 果
1.病理结果
组织病理学证实61例患者中有24例(平均年龄46.5岁,范围29~61岁)为Ⅰ型EOC,包括14例低级别浆液性癌,3例透明细胞癌,4 例子宫内膜样癌和3例粘液性癌,其中6例患者为双侧卵巢病变。其余37例患者(平均年龄57.02 岁,范围44~81岁)为Ⅱ型EOC,均为高级别浆液性癌,其中13例患者为双侧卵巢病变。61例患者共计80个病灶。
2.传统模型评估
常规MRI形态学特征:Ⅱ型EOC的直径小于Ⅰ型EOC(P=0.002)。两种类型肿瘤在T2WI上均倾向于高信号,但Ⅱ型EOC显示为高信号的比例更高(分别为78%和50%,P=0.011)。Ⅱ型EOC最常见的性状为实性病变,而Ⅰ型更常见的是囊性和囊实性病变,两组差异有统计学意义(P<0.001)。腹膜转移(P=0.009)和腹水(P<0.001)在Ⅱ型EOC中更为常见。两组的肿瘤侧向性差异无统计学意义(P=0.386),但Ⅱ型EOC更倾向于双侧卵巢发病(表1)。多因素logistic回归分析结果显示,肿瘤性状(OR:4.46,95%CI:1.854~6.403,P<0.001)和腹水(OR:5.062,95%CI:1.177~25.557,P<0.005)是Ⅱ型EOC的独立预测因子(表2)。
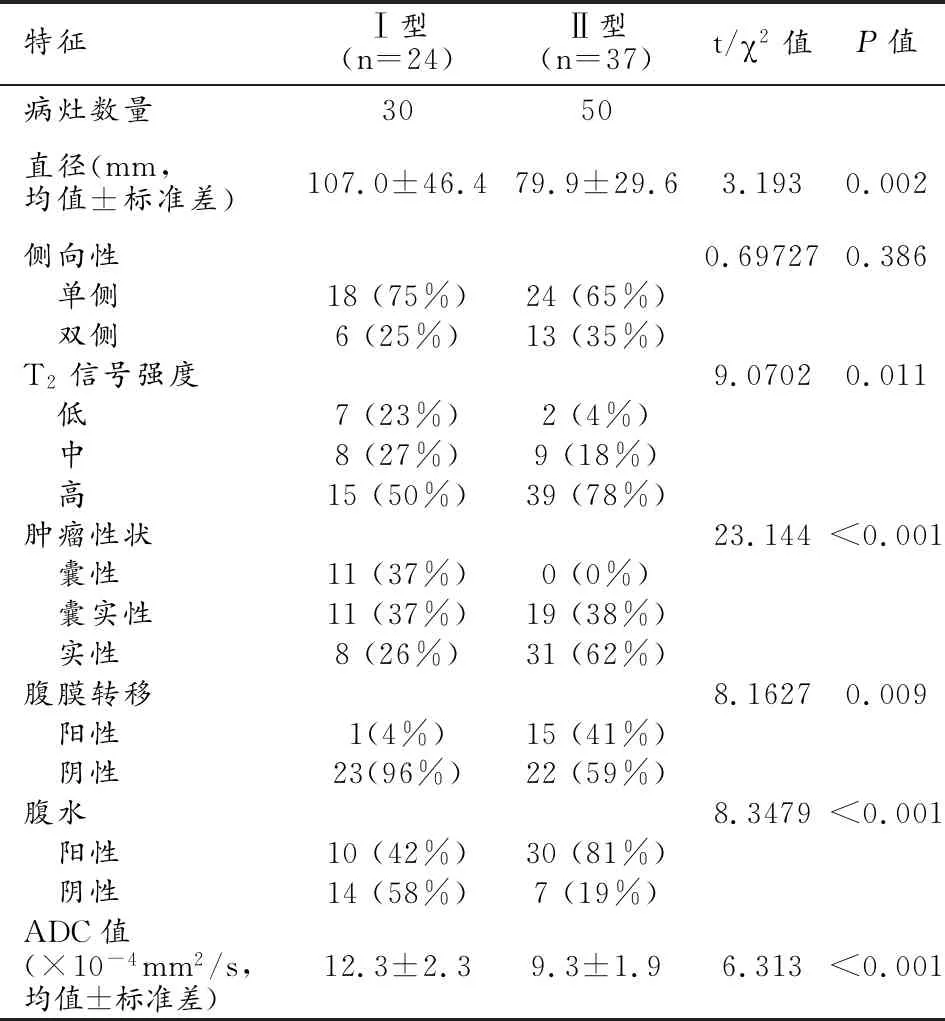
表1 EOC患者传统影像特征的单因素分析结果 (n,%)
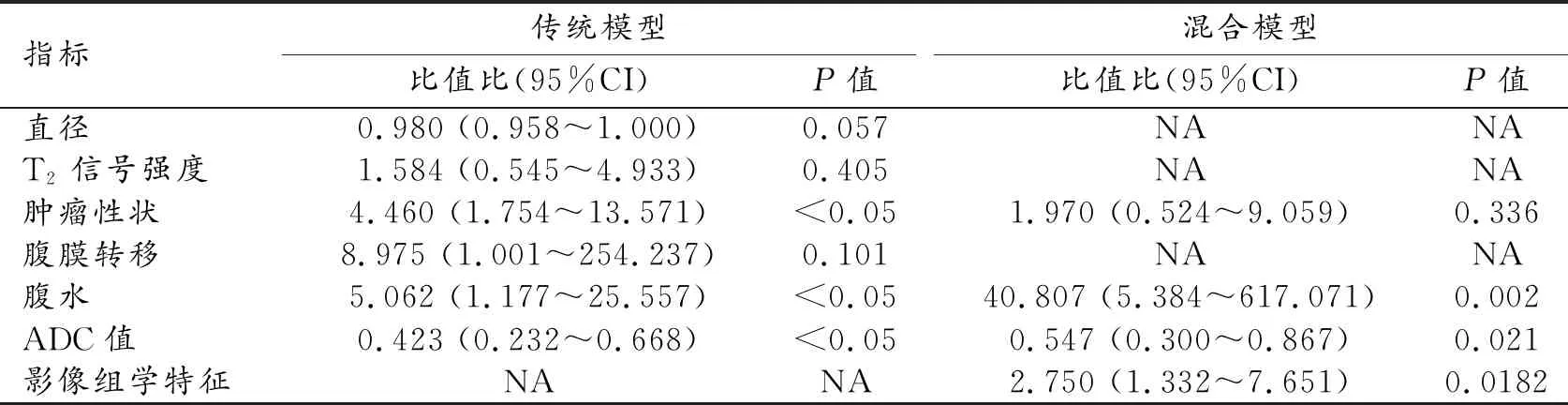
表2 EOC患者的多因素Logistic回归分析结果
ADC值:两位放射科医师两次测量的ADC值接近,一致性较好(ICC=0.91)。Ⅱ型EOC的ADC值[(9.3±1.87)×10-4mm2/s]显著低于Ⅰ型EOC[(12.34±2.29)×10-4mm2/s],差异有统计学意义(P<0.001,表 1),表明Ⅱ型EOC水分子扩散限制更为严重。
多因素Logistic回归分析选择具有统计学差异的变量建立传统模型(表2),肿瘤性状、腹水和ADC值包含在该模型中。此模型的AUC为 0.95(95%CI:0.90~0.99),诊断阈值0.54,敏感度0.84,特异度0.97,阳性预测值0.98,阴性预测值0.78(表 3、图2)。
表3 影像组学模型、传统模型和混合模型预测I型与II型EOC的效能
3.影像组学模型评估
首先保留 ICC>0.75的特征,最终通过特征选择及LASSO回归算法进一步去除冗余特征后保留5个特征,包括4个DWI特征和1个T1WI增强特征(流程图见图3)。影像组学模型的AUC为0.84(95%CI:075~0.93),诊断阈值0.37,敏感度0.82,特异度0.77,阳性预测值0.85,阴性预测值0.72(表3、图2)。
4.混合模型评估
混合模型中包括肿瘤性状、腹水、ADC值和影像组学特征。混合模型的AUC为0.96(95%CI:0.91~1.00),诊断阈值-0.73,敏感度0.92,特异度0.93,阳性预测值0.96,阴性预测值0.88(表3、图2)。
5.不同模型之间的比较
传统模型(AUC=0.95,95%CI:0.90~0.99)显示出比影像组学模型(AUC=0.84,95%CI:0.75~0.93)更高的分类准确性。混合模型(AUC=0.96,CI:0.91~1.00)的诊断性能与传统模型基本相同。
校准曲线表明传统模型与混合模型对预测EOC组织学分型的能力基本一致,均优于影像组学模型(图4a)。在DCA的所有阈值概率内,传统模型和混合模型具有基本相同的临床实用性(图4b)。交叉验证证实了传统模型的可靠性和稳定性(图5)。为了提供可视化的测量结果,绘制了传统模型的列线图,并给出了每种独立预测因子所占权重(图6)。分层分析结果表明,在疾病早期,影像组学模型的诊断效率高于传统模型,在疾病晚期,传统模型的诊断效率高于影像组学模型(图7)。
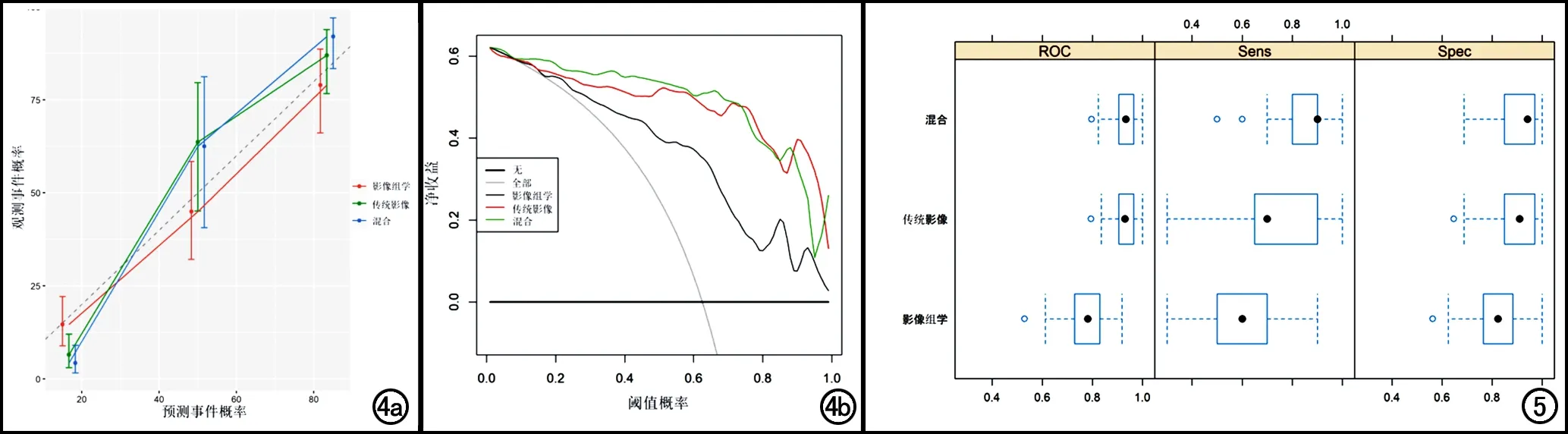
图4 a) 传统模型、影像组学模型和混合模型的校准曲线,描述了Ⅱ型 EOC患者的预测概率与观测到概率的一致性,45°虚线表示理想的预测性能,实线表示各模型的预测性能,结果说明三种模型均在可信范围内; b) 传统模型、影像组学模型和混合模型的决策曲线,表示不同风险下的净收益。当风险阈值为1%~99%时,混合模型与传统模型在预测EOC患者组织学分型上达到了基本一致的临床实用性。 图5 影像组学模型、传统模型和混合模型的交叉验证图,表示每种模型的AUC、敏感度和特异度的分布情况。

图6 a) 预测II型EOC的传统影像特征列线图:在肿瘤性状、腹水、ADC值横轴上分别进行定位,分别绘制每条直线到相应的分数值,对3个预测变量的分数值进行总和,并将分数值定位在总分数值轴上,然后画一条直线到预测的风险系数轴,该风险系数反映了患者为II型EOC的风险性。肿瘤性状:0表示囊性,1表示囊实性,2表示实性。腹水:0表示阴性,1表示阳性; b) 分别显示肿瘤性状、腹水、ADC值所占权重。图7 分层分析结果表明,在疾病早期,影像组学模型的诊断效率高于传统模型;在疾病晚期,传统模型的诊断效率较高。
讨 论
本研究结果表明,传统模型、影像组学模型和混合模型均可在术前预测EOC的组织学分型。传统模型显示出最高的预测性能,而混合模型并未没有明显优于传统模型。因此,笔者认为传统模型可以成为临床决策中区分Ⅰ型和Ⅱ型EOC的有效工具。
Thomassin-Naggara等[18]早在2013年就建立了卵巢肿块评分系统,以识别良性与恶性肿瘤,然而随着个性化医疗的发展,有必要进一步鉴别恶性肿瘤的组织学分型。Ⅰ型EOC通常由规则而稳定的前体病变(如交界性肿瘤和子宫内膜异位症)发展而来,并且在基因上是相对稳定的。Ⅱ型EOC主要来源于附件上皮细胞,在遗传上极其不稳定,且常伴有P53突变[5,7]。EOC患者的生存差异与Ⅰ型和Ⅱ型生物学行为密切相关。因此,准确预测EOC的组织学分型可帮助患者进行术前风险分层,对需要进行更广泛手术的患者选择最佳决策方案,同时避免对低风险患者进行过度治疗。
随着各种诊断方案的不断优化,临床上逐渐结合多种方法来诊断卵巢肿瘤[21-23],但对组织学分型的研究很少。在本研究中,通过多元logistic回归分析建立的传统模型显示肿瘤性状、腹水和ADC值是Ⅱ型EOC的独立预测因子。Ⅱ型EOC 较Ⅰ型EOC的实性成分更小,且腹水更常见,ADC值明显低于Ⅰ型EOC。这些结果与以往研究结果一致[9,10,24]。基于上述独立变量建立的传统模型的诊断效能高达0.95,表明其可以有效区分Ⅰ型与Ⅱ型EOC。
与之前使用少量图像特征的研究不同[25-27],本研究从每个病变的每个MRI序列中提取了1070个特征。最近的研究表明,多序列MRI影像组学的定量特征可以作为影像学的生物标志物,以诊断、辨别组织学分型和预测妇科肿瘤的治疗反应[28-31]。本研究选择了3个MRI序列以建立影像组学模型,该模型在预测 EOC的组织学分型方面显示出较好的预测效能。另外,经过特征筛选后模型中包括4个DWI特征,表明DWI图像在影像组学方面的重要性,合理的解释可能是DWI图像可以更好地监测肿瘤微环境[32],因此可以观察到更多的信号差异。分层分析结果显示,影像组学模型在肿瘤早期阶段的预测性能非常好,这意味着该模型可以更好地区分EOC的早期阶段。
本研究还比较了传统模型、影像组学模型和混合模型,发现传统模型在预测EOC的组织学分型方面表现良好,混合模型的诊断效能并未明显优于传统模型,但其诊断准确度及敏感度却有所提高。传统模型的列线图不仅可以可视化和个性化预测Ⅱ型EOC患者,而且在DCA的整个阈值概率范围内实现了更高的诊断效率和更多的净收益。交叉验证结果表明,我们开发的传统模型是可靠且可重复的,可作为指导临床实践的有用工具。
本研究存在以下局限性:①本研究为回顾性研究,样本量较小,因此,将来需要使用标准化成像技术并对大量样本进行前瞻性研究;②尽管本研究使用交叉验证来验证每个模型的可靠性,但它还应包括其他外部验证以测试研究的可重复性和泛化性;③本研究纳入患者大多属于晚期,在日后研究中会纳入更多早期病例进一步验证影像组学模型的潜力。
综上所述,通过比较传统模型、影像组学模型和混合模型,结果显示传统模型具有良好的诊断性能,而混合模型的诊断效果并未明显提高。因此,笔者认为传统模型是一种无创且可靠的工具,可在术前更好地区分Ⅰ型与Ⅱ型EOC患者。

