改性蒙脱石对断奶仔猪生长性能、血清免疫和抗氧化功能及猪肠上皮细胞的影响
詹小立 应加富 邓 波 吴 杰 李静静 刘宇宸 余东游 李卫芬* 徐子伟*
(1.浙江大学动物科学学院,杭州 2310021;2.浙江丰虹生物科技有限公司,湖州 2313300;3.浙江省农业科学院畜牧兽医研究所,杭州 2310021)
断奶可以引起仔猪氧化应激及肠道损伤[1],并影响其免疫功能,最终导致其腹泻以及生长受阻[2-3]。在过去的几十年中,抗生素、氧化锌和硫酸铜已被广泛应用于养猪业,以提高免疫力,减少仔猪腹泻[4]。然而,这些添加剂的滥用也导致了抗生素耐药性以及重金属残留等问题,使用安全的饲料添加剂是大势所趋[5]。
蒙脱石是一种含水铝硅酸盐的层状矿物(为膨润土的主成分),其单位晶胞由2层硅氧四面体片和1层铝氧八面体片组成,属于典型2∶1“三明治”结构,晶体结构内存在大量1 nm左右的微孔或通道,大大增加了其比表面积。在晶体构造层间含有水及可交换的阳离子——钠离子(Na+)、钾离子(K+)、钙离子(Ca2+)和氢离子(H+)等[6]。蒙脱石可减少霉菌毒素污染,具有防治肠道疾病及提高动物生产性能等功效[7-9]。通过阳离子交换法可使铜离子(Cu2+)替代蒙脱石中原有的阳离子,从而改变蒙脱石的结构[改性蒙脱石(modified montmorillonite,MMT)],使其具有更大的层间距和比表面积,形成新的二维微孔蒙脱石材料。本试验旨在研究饲粮添加MMT对断奶仔猪生长性能、血清免疫和抗氧化功能的影响,同时通过体外细胞试验研究其对猪肠上皮细胞抗炎及凋亡的影响,为MMT在仔猪养殖中的应用提供依据。
1 材料与方法
1.1 试验材料
MMT由浙江某生物科技有限公司提供,制备方法如下:将膨润土分散于水中制备浓度5%~10%的膨润土浆液,搅拌浸泡3~5 h,加入钠化改性剂,50~70 ℃恒温搅拌反应5~8 h,提纯、脱水、洗涤、烘干,得到高纯蒙脱石。取上述高纯蒙脱石样品,加入质量比20倍的双蒸水,搅拌成悬浮液,按摩尔比1.5倍离子交换容量的量加入Cu2+(CuSO4·5H2O,分析纯),搅拌24 h,过滤后用双蒸水洗涤3次,真空干燥,研磨至过600目筛,得到载铜蒙脱石样品,MMT的铜离子交换容量>1 100 mmol/kg。
1.2 仔猪养殖试验
选取48头体重为(7.42±0.85) kg的24日龄断奶仔猪随机分成2个组,每组4个重复,每个重复6头猪(公母各占1/2)。对照组饲喂基础饲粮,基础饲粮为参照NRC(2012)断奶仔猪营养需要配制的粉状配合饲料,其组成及营养水平见表1;MMT组饲喂基础饲粮+1.6‰ MMT。试验期28 d,试验期间猪自由采食和饮水,常规驱虫和免疫。

表1 基础饲粮组成及营养水平(风干基础)

续表1项目 Items第1~14天 Days 1 to 14第15~28天 Days 15 to 28消化能 DE/(MJ/kg)13.8513.68赖氨酸 Lys1.271.18蛋氨酸+半胱氨酸 Met+Cys0.740.72苏氨酸 Thr0.900.82钙 Ca0.800.70总磷 TP0.650.60
1.3 生长性能指标测定
分别于试验第1天、第14天和第28天对仔猪空腹称重,并记录各栏采食量。计算各阶段仔猪平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。每天早晚2次记录仔猪腹泻次数,计算每栏腹泻率:
每栏腹泻率=每栏全期腹泻次数/
(每栏观察总头次数×试验天数)。
1.4 血清样品的制备及生化指标的测定
试验结束时,每栏选取2头仔猪(公母各1头)前腔静脉采血,静置8 h待血清析出,3 000 r/min离心10 min,将上清分装于离心管中,置于-20 ℃冰箱中保存待测。
血清免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白M(immunoglobulin M,IgM)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、丙二醛(malonaldehyde,MDA)和脂多糖(lipopolysaccharide,LPS)含量以及二胺氧化酶(diamine oxidase,DAO)、髓过氧化物酶(myeloperoxidase,MPO)、过氧化氢酶(catalase,CAT)活性和总抗氧化能力(total antioxidant capacity,T-AOC)等指标的测定均采用南京建成生物工程研究所的试剂盒测定,测定方法按照说明书进行。
1.5 体外细胞试验
体外细胞试验主要用到的试剂:DMEM/F12高糖培养基、青霉素/链霉素双抗(100×)购自上海源培生物科技有限公司,0.25%胰酶[含0.02%乙二胺四乙酸(EDTA)]购自索莱宝公司,胎牛血清(FBS)购自Gibico公司,LPS购自美国Sigma-Aldrich公司。
细胞培养方法如下:将冻存的IPEC-J2细胞从液氮中取出,在37 ℃水浴锅内快速解冻,并将配制好含有10%FBS的DMEM/F12完全培养基(含1%青霉素/链霉素双抗)从4 ℃冰箱取出预热。将融化后的细胞加到含有一定量预热的培养基离心管内,1 000 r/min离心5 min后将沉淀接种于10 cm的培养皿内,放置在37 ℃、CO2浓度为5%、相对湿度为100%的恒温培养箱。待细胞长满70%~80%时,去掉上清,磷酸盐缓冲液(PBS)清洗2遍,加入1 mL的胰酶消化2 min后,加入2 mL完全培养基终止消化,吹打细胞收集悬液于10 mL离心管内,1 000 r/min离心5 min,去上清,加入DMEM/F12完全培养基,再根据试验计划将细胞接种或是铺板。
MMT对IPEC-J2活性的影响:IPEC-J2细胞消化后按一定数目接种到96孔板中,当细胞汇合度达到70%~80%时加入梯度浓度(1×10-5~1 mg/mL)的MMT,每个浓度做6个重复,作用12 h后加入含有10%八肽胆囊收缩素(CCK-8)的溶液(碧云天)100 μL,继续放入恒温培养箱孵育2.5 h,在酶标仪(Biotek)450 nm波长处检测各孔的吸光度,计算各浓度活性差异。MMT对IPEC-J2细胞毒性的影响:先消化细胞计数,按一定浓度的细胞量铺入12孔板中,待细胞贴壁达到一定汇合度后加入不同浓度的MMT继续作用24 h后取上清测定乳酸盐脱氢酶(LDH)的活性(LDH检测试剂盒,碧云天)。划痕试验类似,先铺成12孔板后进行物理划痕,按照0.01 mg/mL MMT处理细胞,量取0 h宽度,继续培养24 h后对细胞再量取划痕宽度,计算相对愈合程度。
1.6 MMT对IPEC-J2细胞基因表达量的影响
先将消化后的细胞按照一定的量铺入6孔板,待细胞长满后分别加入PBS、LPS、MMT和MMT预处理12 h后再加入LPS作用12 h,收集细胞,提取总RNA,利用荧光定量PCR仪器(Bio-Rad)测定炎症因子基因、凋亡基因和紧密连接蛋白基因的表达水平。引物序列见表2。

表2 引物序列

续表2基因 Genes登录号 Accession No.引物序列 Primer sequences (5'—3')封闭蛋白-1 Claudin-1NM_001244539.1F:AGGACTACGTATGAGGGGGR:GACTGGTCTCGGATGCAAG胱天蛋白酶-3 Caspase-3NM_214131.1F:GAATGGGGGGAGAGACACCTR:CCGCCACTCGGAAAAAGA胱天蛋白酶-8 Caspase-8XM_021074713.1F:CAGCCTCAGGAATCAGGACGTGR:TGTAGTTGTAACCGTGGCAGCB细胞淋巴瘤2相关X蛋白 BAXXM_013998624.2F:GAATGGGGGGAGAGACACCTR:CCGCCACTCGGAAAAAGAB细胞淋巴瘤2 BCL2XM_021099593.1F:TGATTTCTCCTGGCTGTCTCR:GCCCGTCCACTTCACTTAT
1.7 数据处理与统计方法
试验数据采用SPSS 13.0软件进行统计分析,P<0.05为差异显著,P<0.01为差异极显著,0.05≤P<0.10为有变化趋势。腹泻率进行卡方检验,血清生化指标及体外试验采用独立样本t检验进行统计分析,试验结果以“平均值±标准差”表示。
2 结果与分析
2.1 MMT对断奶仔猪生长性能及腹泻率的影响
由表3可知,与对照组相比,MMT组断奶仔猪第14天体重有增加趋势(0.05≤P<0.10),第28天体重显著增加(P<0.05),平均体重达到(13.59±1.30) kg;MMT组断奶仔猪全期(第1~28天)ADG也显著增加(P<0.05),第1~14天和第1~28天ADFI略有升高(P>0.05),第15~28天ADFI显著增加(P<0.05);同时,MMT组断奶仔猪第1~14天F/G显著降低(P<0.05)。试验期间各组仔猪腹泻率均不较高,与对照组相比,MMT组断奶仔猪腹泻率显著降低(P<0.05)。

续表3项目 Items对照组 Control groupMMT组 MMT group第15~28天 Days 15 to 282.05±0.462.05±0.15第1~28天 Days 1 to 281.92±0.111.89±0.08腹泻率 Diarrhea rate/%第1~14天 Days 1 to 145.32±0.52a3.30±0.52b第15~28天 Days 15 to 2814.90±0.73a5.90±0.67b第1~28天 Days 1 to 2810.11±0.17a4.60±0.14b
2.2 MMT对断奶仔猪血清抗氧化功能的影响
由图1可知,与对照组相比,MMT组断奶仔猪血清MDA含量显著降低(P<0.05),血清CAT活性有升高趋势(0.05≤P<0.10),这说明饲粮添加MMT可有效提高断奶仔猪血清抗氧化功能,降低氧化应激。

*表示P<0.05,**表示P<0.01,***表示P<0.001。下图同。
2.3 MMT对断奶仔猪血清免疫功能的影响
由图2可知,与对照组相比,MMT组断奶仔猪血清DAO活性及IL-1β、IL-6和TNF-α含量显著降低(P<0.05),血清MPO活性和LPS含量有降低的趋势(0.05≤P<0.10),血清IgG、IgA和IgM含量无显著差异(P>0.05),这说明饲粮添加MMT可显著降低断奶仔猪血清的炎症反应。
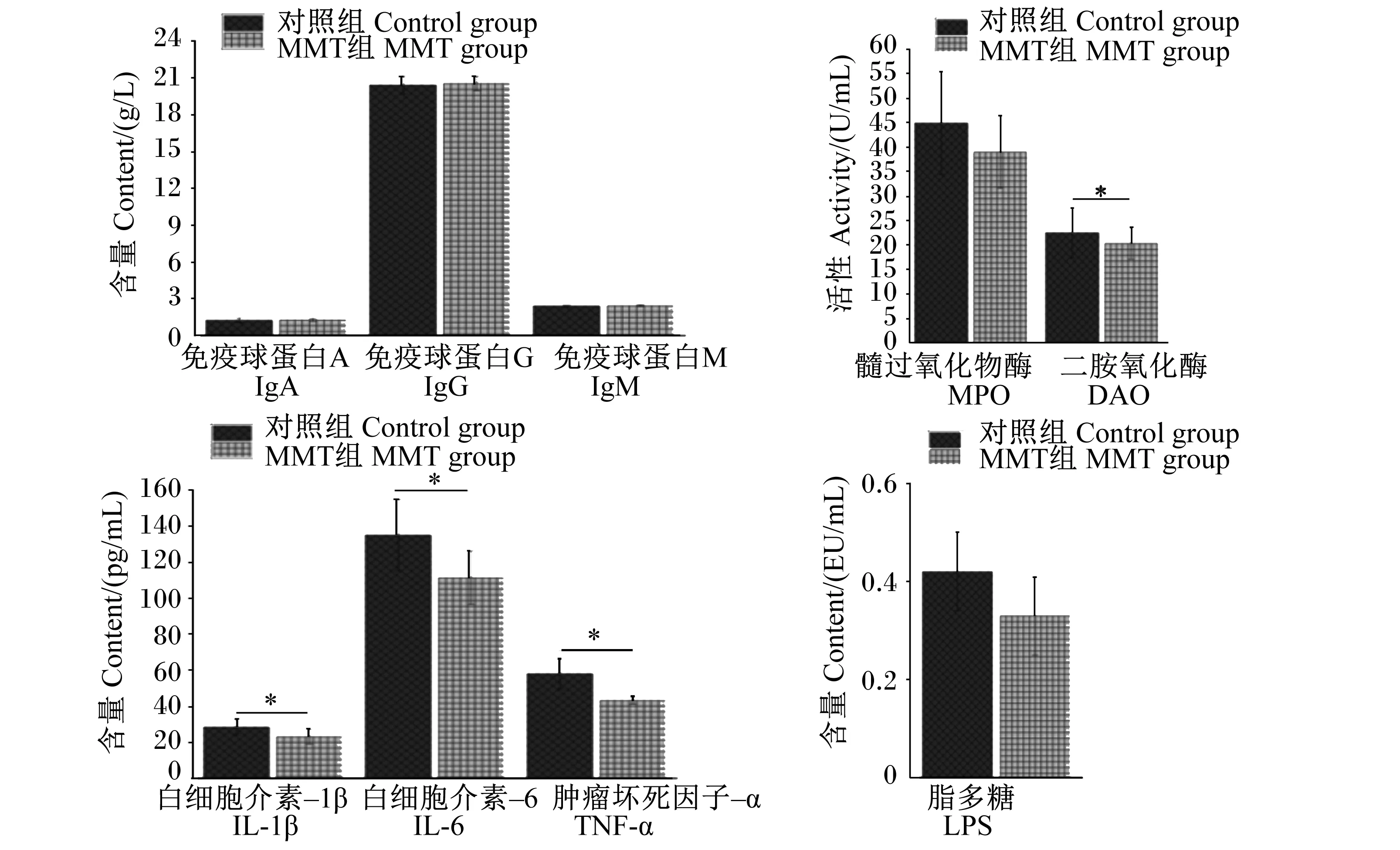
图2 MMT对断奶仔猪血清免疫功能的影响
2.4 MMT对断奶仔猪肠上皮细胞活性、紧密连接和炎症损伤的影响
由图3可知,CCK-8法和LDH活性检测结果发现,0.01 mg/mL MMT对IPEC-J2细胞LDH活性无显著影响(P>0.05),但0.1 mg/mL MMT可极显著提高IPEC-J2细胞LDH活性(P<0.01),说明0.01 mg/mL MMT对细胞无毒性,后续试验按此浓度进行。

图3 MMT对断奶仔猪肠上皮细胞活性的影响
由图4可知,炎症相关基因测定结果表明,与对照相比,MMT处理可显著提高断奶仔猪肠上皮细胞白细胞介素-8(interleukin-8,IL-8)表达水平(P<0.05),但对IL-6、白细胞介素-1α(interleukin-1α,IL-1α)和TNF-α表达水平无显著影响(P>0.05);LPS处理使得断奶仔猪肠上皮细胞IL-8、IL-1α和TNF-α表达水平极显著升高(P<0.01),MMT预处理(MMT+LPS)可使抗炎因子——转化生长因子-β(transforming growth factor-β,TGF-β)(P<0.01)和过氧化物酶体增殖物活化受体γ(peroxisome proliferators activate receptor γ,PPARγ)及促炎因子——IL-1α、IL-8和TNF-α的表达水平显著升高(P<0.05),而IL-6表达水平极显著降低(P<0.01),这说明MMT可同时调节细胞促炎和抗炎反应,缓解LPS引起的炎症反应。

图4 MMT对断奶仔猪肠上皮细胞细胞因子基因表达的影响
利用划痕试验建立IPEC-J2损伤模型,结果表明低浓度MMT(5 μg/mL)可显著促进细胞损伤修复(P<0.05),而10 μg/mL MMT对细胞损伤修复无显著影响(图5)。此外,与对照相比,LPS处理可极显著提高凋亡基因——B细胞淋巴瘤2相关X蛋白(B-cell lymphoma-2 associated X protein,BAX)的表达水平(P<0.01),MMT处理可极显著降低凋亡基因——胱天蛋白酶-3(caspase-3)、胱天蛋白酶-8(caspase-8)和抗凋亡基因——B细胞淋巴瘤2(B-cell lymphoma-2,BCL2)的表达水平(P<0.01),而MMT预处理后再用LPS处理可极显著提高caspase-3和BCL2的表达水平(P<0.01)。另外,与对照相比,LPS处理可极显著显著降低紧密连接基因——封闭蛋白-1(claudin-1)、闭合蛋白(occludin)和紧密连接蛋白-1(zonula occludens-1,ZO-1)的表达水平(P<0.01),造成了肠道损伤,而MMT可极显著降低claudin-1和occludin的表达水平(P<0.01),MMT预处理极显著提高claudin-1、occludin和ZO-1的表达水平(P<0.01)。因此,MMT预处理可显著提高细胞抗凋亡功能,有效预防肠上皮细胞的损伤。

图5 MMT对断奶仔猪肠上皮细胞损伤修复、细胞凋亡和抗炎因子表达的影响
3 讨 论
仔猪断奶应激表现为生长阻滞和腹泻等现象,众多研究和生产经验都证实饲粮中添加高剂量的锌能有效控制仔猪腹泻,但高剂量的锌会破坏各种微量元素的平衡,影响仔猪对铜和铁的吸收,导致铁和铜继发性缺乏,出现贫血[10];此外,饲粮中的大部分锌将随粪便排泄到环境中,造成环境污染。
蒙脱石作为非营养性添加剂已应用到动物养殖中以改善其生产性能[10]。蒙脱石具有吸附阳离子的特性,对消化道内的霉菌毒素、病毒、致病菌及其产生的毒素有固定和吸附的作用,并能够保护和修复肠道黏膜。此外,蒙脱石不会进入机体的血液循环,在肠道内连同所固定的因子随消化道蠕动排出体外,不改变粪便的颜色及肠道正常的蠕动功能[11]。蒙脱石中还含有丰富的铜、锌、钴和硒等微量元素,可弥补微量元素的不足,对畜禽的生长有促进作用[11]。Venglovski等[12]和Prasai等[13]研究报道,含有蒙脱石(1.0%~2.0%)的饲粮可以促进鸡和猪的ADG和饲料转化率。郭彤等[14]研究报道,断奶仔猪饲粮中添加纳米载铜蒙脱石能显著提高断奶仔猪的ADG和饲料转化率,显著降低仔猪腹泻率及小肠和结肠内容物中大肠杆菌和沙门氏菌的数量,并且高剂量(2 000 mg/kg)的纳米载铜蒙脱石对生长性能无显著影响。武力等[15]研究报道,添加纳米蒙脱石对断奶仔猪生长性能无显著影响,但对ADFI有提高趋势。陈大水等[10]研究报道,在饲粮中添加不同水平的纳米蒙脱石,随着添加水平的提高,仔猪ADFI和ADG均呈递增的趋势。Tang等[16]在仔猪饲粮中补充硅铝酸盐黏土矿,发现能显著改善仔猪的生长性能,提高营养物质消化率,从而显著提高仔猪的ADG。本试验结果表明,饲粮添加MMT可显著改善断奶仔猪生长性能,与大多数研究报道一致。
在引起仔猪腹泻的诸多因素中,原发性因素并不是大肠杆菌等致病菌,而是由于断奶应激(尤其是采食了大量的植物性蛋白质饲料)破坏了肠道菌群平衡和黏膜结构,造成肠道损伤(小肠绒毛变短)和胃肠道酶活性降低,消化吸收功能下降,食糜以腹泻形式排出[17]。李辉等[18]研究报道,纳米蒙脱石对消化道黏膜有覆盖能力,并通过与黏液糖蛋白相互结合,修复和提高胃肠黏膜对致病因子的防御功能,对禽畜类腹泻、痢疾等疾病预防和治疗有独特的效果[19]。谢长青等[20]采用纳米蒙脱石替代抗生素对仔猪腹泻进行治疗,取得了良好的效果,同时,其他研究报道也证实纳米蒙脱石对控制仔猪腹泻具有良好的作用[21-22]。
蒙脱石因具有不饱和负电荷和阳离子交换能力,可以捕获、吸附和固定毒素,降低肠道对毒素的吸收及其毒害作用[23]。断奶会引发仔猪CD4+、CD8+等T细胞亚群的释放及肠道炎性因子基因的表达,炎症的发生会进一步损害肠道上皮细胞,破坏肠道黏膜屏障功能[24]。Shi等[25]通过在肉仔鸡饲粮中添加3.0 g/kg的纳基改性蒙脱石,显著缓解了黄曲霉毒素对肉仔鸡生长性能、免疫机能和血清生化指标的影响,缓解了饲粮中霉变花生粕对肉仔鸡造成的生长抑制和免疫器官肿大。在霉变的饲粮中添加2.0 g/kg的蒙脱石,显著提高了肉鸭ADG、ADFI及血浆蛋白含量,显著抑制免疫器官指数的升高[26]。本研究结果,断奶仔猪饲粮中添加MMT可显著降低血清炎性因子——TNF-α、IL-6和IL-1β的含量,这与陈鹏等[27]在保育仔猪上的研究结果一致;另外,马元山等[28]在育肥猪饲粮中添加蒙脱石可提高机体的抗氧化能力,本试验结果发现MMT组断奶仔猪血清MDA含量显著降低,血清T-AOC有上升趋势,说明MMT具有缓解氧化应激的效果。
体外猪肠上皮细胞试验发现,MMT可显著降低炎症因子IL-6的表达水平,而且MMT预处理后可有效缓解LPS引起的炎症,显著提高抗炎因子TGF-β和PPARγ的表达水平,提示MMT有缓解炎症引起损伤的效果,这与体内血清检测结果相一致。MMT具有促进划痕愈合速度,同时显著提高紧密连接基因的表达和细胞抗凋亡功能,提示MMT可促进肠上皮细胞的损伤修复,这与Jiao等[29]和徐军等[30]研究蒙脱石的损伤修复机制一致,蒙脱石能够减轻LPS带来的肠道损伤。此外,本试验结果表明,MMT处理可以显著降低肠上皮细胞凋亡基因caspase-3、caspase-8和BCL2的表达水平,提示MMT可能具有抗凋亡的效果;本试验还表明,0.01 mg/mL MTT对细胞是安全的,因其直接接触细胞,所以作用浓度低于饲粮中的添加量(饲粮中的添加量相当于1.6 mg/g)。
4 结 论
① 饲粮添加1.6‰的改性蒙脱石可通过提高断奶仔猪血清抗氧化功能和肠道黏膜屏障功能,降低体内炎症反应,从而促进生长、降低腹泻。
② 体外细胞试验验证MTT(0.01 mg/mL)能提高猪肠上皮细胞抗炎、抗凋亡和损伤修复功能。

