奶牛临床型乳房炎Corynebacteriumphoceense的分离鉴定及药敏试验
姜东凤,唐启伟,肖艳飞,任晓丽,皇甫和平*,石冬梅*
(1.河南牧业经济学院,河南 郑州450011;2.郑州新里程企业管理咨询有限公司,河南 郑州450011)
依据乳房组织和乳汁的病理变化可对奶牛临床型乳房炎做出诊断,但因引起该病的病原种类非常多,故通过检测、明确该病的病原种类,了解其药物敏感性,对该病的治疗具有重要意义。
检测牛乳房炎病原菌的经典方法有细菌分离鉴定,核酸检测等。PCR技术因其具有快速、灵敏等特点,在病原微生物的早期诊断中被广泛运用[1-2]。同时,随着全基因组测序项目的大量开展,几乎所有常见病原微生物的序列信息都已被公布,所以利用PCR扩增、序列比对来确定分离菌株种类已经成为鉴定病原微生物的一个准确方法[3]。而在同一反应体系里添加多种目的基因引物,达到同时扩增出多个基因片段的多重定量PCR,也成为筛选引起某一疾病的主要病原微生物的主要手段[4]。本研究采用细菌分离培养、染色镜检、PCR扩增测序、测序比对、药敏试验,又采用16联牛乳房炎病原菌核酸PCR-荧光探针法对太原市某奶牛场奶牛临床型乳房炎进行了研究,筛选该场乳房炎的主要致病菌,并为治疗提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 样品采集 乳样采自太原市某患有乳房炎的奶牛场,根据乳房组织和乳汁的病理变化共采集4头来自不同乳房的9份乳样,采集乳样时先消毒乳头,弃去前段乳汁,无菌取样10 mL,做好标记,4 ℃存放备用。
1.1.2 分子生物学软件及数据库 Primer 5.0用于引物设计、Seqman用于DNA序列和测序峰图分析、 NCBI (https://www.ncbi.nlm.nih.gov)用于基因信息查询和比对。
1.1.3 试剂 营养肉汤购自广东环凯微生物科技有限公司;鲜血琼脂平板购自宝生物工程(大连)有限公司、引物由上海生工公司合成、DNA抽提试剂盒购自上海生工生物工程股份有限公司,测序由武汉擎科生物技术有限公司完成、16联牛乳房炎病原菌核酸检测试剂盒购自深圳意瑞生物技术股份有限公司。
1.2 试验方法
1.2.1 病原菌的分离培养 病原菌分离时,先用灭菌枪头吸取少量奶样,均匀涂布于血琼脂平板,置于37 ℃恒温箱培养,18~24 h后,观察菌落形态,选择单菌落,并进行革兰氏染色鉴定及后续试验。
1.2.2 病原菌的革兰氏染色及显微镜检查 用接种环挑取少量培养菌落涂于载玻片上自然干燥固定,进行革兰氏染色,具体步骤为:在干燥固定的抹片上滴加草酸铵结晶紫溶液染色2 min,然后用水冲洗干净;滴加革兰氏碘液进行媒染2 min,用水冲洗干净;滴加 95%乙醇进行脱色约20 s,水洗干净;滴加稀释的碳酸复红复染约20 s,水洗干净; 染色完毕自然干燥,显微镜下观察。
1.2.3 PCR扩增 挑选可疑单菌落放入液体培养基中,37 ℃、180 r/min培养12 h, 菌液用于PCR扩增及测序。DNA提取参照Ezup柱式细菌基因组DNA抽提试剂盒说明书进行,提取好的DNA -20 ℃存放备用。
参考文献[5]设计细菌16S rRNA引物:16S-F:5'-CCGAATTCGTCG ACAACAGAGTITGATCATGGCTCAG-3';16S-R:5'-CCCGGGATCCAAGCTTACGGTT ACCTTGGTACGACTT-3'。预期扩增基因片段长度1 500 bp。PCR反应体系25 μL:10×buffer 2.5 μL,dNTP 2 μL,ExTaq 0.125 μL,10 μmol/L上、下游引物各1 μL,ddH2O 17.375 μL,DNA模板 1 μL。PCR反应程序: 95 ℃ 3 min;95 ℃ 30 s, 62 ℃ 30 s, 72 ℃ 2 min,40个循环;72 ℃ 5 min, 12 ℃ 2 min。
1.2.4 测序比对 采用双向测通,拼接序列,然后用NCBI 16s Ribosomal RNA sequences(Bacteria and Archaea)进行比对。
1.2.5 药物敏感性检测 (纸片扩散法) 先将分离纯化的细菌接种于营养肉汤中,37 ℃培养箱中过夜;接着用生理盐水将菌液稀释至与标准比浊管一致;接种于琼脂平板上,并在每个平板上放置5个药敏纸片; 37 ℃培养箱中培养18 h,然后测定细菌抑菌环的直径。根据美国临床实验室标准化协会(CLSI)推荐的标准,判定病原菌对药物的敏感性[6]。
1.2.6 16联牛乳房炎病原菌qPCR检测 参照试剂盒说明,对牛乳房炎常见的16种接触传染型病原菌进行监测和鉴定。从试剂盒中取出所有的Q-PCRMasterMix试剂、酶制剂、dH2O等,置于冰上融化;试剂在使用前先混合均匀,2 000 r/min离心20 s备用;分别吸取Q-PCRMasterMix 1~4至1.5 mL灭菌离心管,体积为21.5 μL/管,每管加入1 μL EnzymeMix,混匀后短暂离心;向装有PCR反应液1~4的PCR管中分别加入2.5 μL 的9个待检样本的DNA,震荡离心。根据说明书要求,4种PCR反应液在PCR过程中设置的报告荧光为FAM、HEX、ROX、Cy5,淬灭基团为None。PCR反应体系设置为:50 ℃去污染 3 min; 95 ℃预变性3 min;95 ℃变性15 s,60℃退火40 s,40个循环。试验结束后保存检测数据文件,调整阴性对照的扩增曲线平直或低于阈值线,读出结果。
2 结 果
2.1 革兰氏染色镜检结果
通过对9份奶牛乳房炎乳样进行革兰氏染色镜检,除了1个样品没有菌落以外,8个乳样均可观察到相应菌落,且革兰氏阳性菌占87.5%,革兰氏阴性菌占12.5%。详见表1。
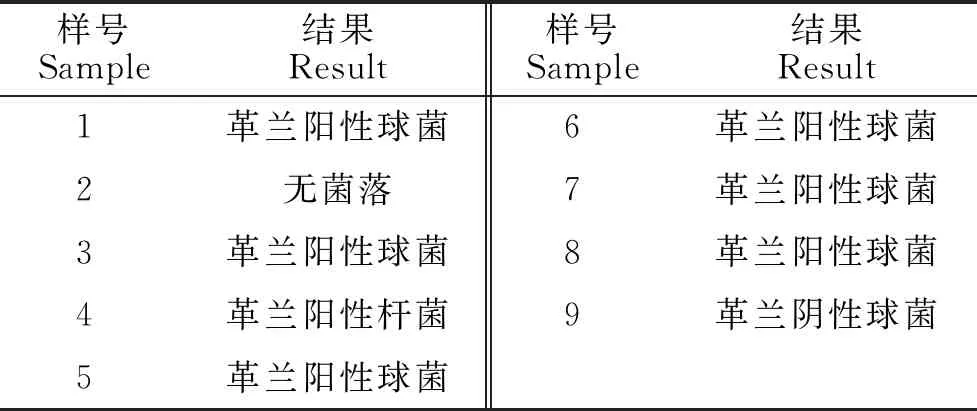
表1 革兰氏染色结果
2.2 16S rRNA基因扩增及测序结果
如表2所示,除了一个菌液因为PCR回收纯度不够,无法检测外,对其他菌液16S rRNA基因PCR产物进行测序并比对,结果显示,样品1、2、4、7、8分离出的革兰氏阳性菌为棒状杆菌,与NCBI公布的序列号MH119724.1的Corynebacteriumphoceense的序列相似度达到99%以上,而从样品5、6、9中分离出的病原菌序列分别与已公布的气球菌属(MG593598.1)、链球菌属(LR641947.1)和嗜冷杆菌属(EU845428.1)序列相似度达到99.93%,99.72%和98.89%。
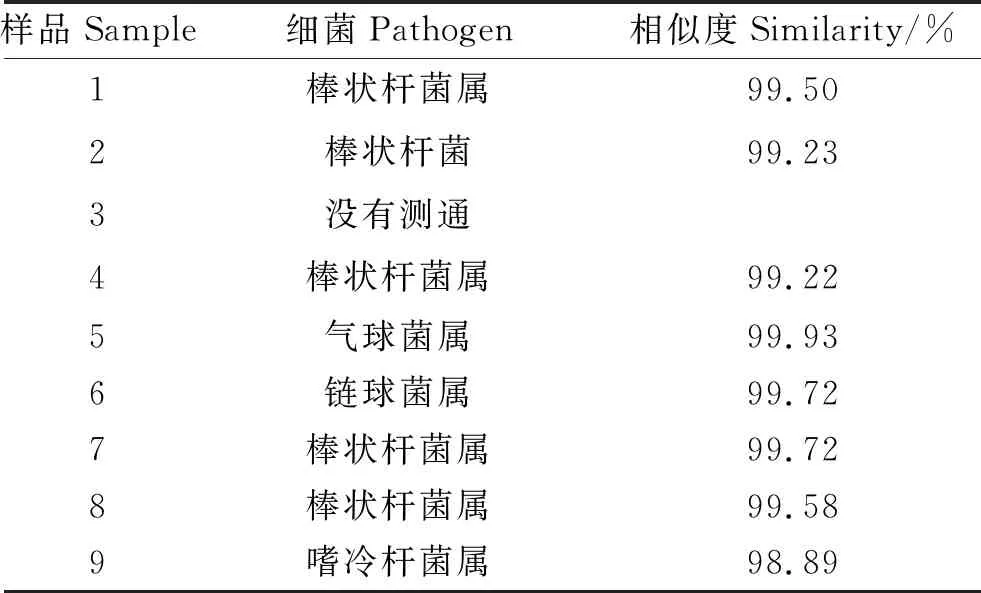
表2 PCR产物测序结果
2.3 药敏试验结果
从表3可知,对分离纯化的细菌进行药敏试验,8个乳样中的纯化菌种均对环丙沙星、庆大霉素、阿莫西林/克拉维酸、利福平、多西环素和头孢噻呋等6种抗生素高度敏感,9号乳样革兰氏阴性菌嗜冷杆菌属对氨曲南、磺胺异恶唑敏感。
2.4 TaqMan探针实时荧光PCR检测结果
表4所示,对16种牛乳房炎常见的接触传染型病原菌的监测和鉴定发现:9个乳样中有8个乳样检测到了的细菌,其中6个样品中检测到弱阳性菌属,5个为克雷伯氏菌属,1个为金黄色葡萄球菌。另外有6个样品中检测到疑似葡萄球菌, 3个样品中检测到疑似β-内酰胺酶抗性基因,同时,还各检测到1例疑似原壁菌属、无乳链球菌、粘质沙雷菌、大肠杆菌和肠球菌属。

表3 药敏试验结果
3 讨 论
3.1 Corynebacterium phoceense可能是引起奶牛乳房炎的主要病原菌之一
棒状杆菌种类较多,可在机体皮肤、上呼吸道和泌尿生殖道粘膜等处定居,大多为非致病菌或条件性致病菌。Cresci等[7]2016年首次从肾移植的病人药液中分离出Corynebacteriumphoceense,并证实了该菌属于棒状杆菌属,比粘金色棒状杆菌小,比乳酸杆菌、溃疡棒状杆菌、乳腺炎棒状杆菌等大,该菌对万古霉素、利福平、强力霉素等几乎所有的抗生素敏感,但对呋喃妥因和硝唑有一定的耐药性。
在该菌的功能研究中,泰国学者Intanoo等[8]首次在奶牛的瘤胃液中分离出了该菌,并发现其可以降解奶牛饲料中的黄曲霉毒素。而本试验首次在该奶牛场临床型乳房炎中分离出该菌,占鉴定比例的62.5%,也证实了该菌对利福平、环丙沙星、庆大霉素等6种抗生素高度敏感。该菌的成功分离,且在乳房炎奶牛乳样细菌中占一定的比例,证明了该菌可能是引起该奶牛场乳房炎的主要病原菌之一。
3.2 奶牛乳房炎临床治疗需要合理用药
本研究通过TaqMan探针实时荧光PCR 对牛乳房炎常见的接触传染型病原菌包括金黄色葡萄球菌、无乳链球菌、牛支原体、牛棒状杆菌、支原体属等和环境型病原菌包括葡萄球菌属、大肠杆菌、克雷伯氏菌属、原壁菌属、停乳链球菌、乳房链球菌、化脓隐秘杆菌、粘质沙雷氏菌、酵母菌、肠球菌属(包括粪肠球菌和屎肠球菌)等15种病原菌以及葡萄球菌属β-内酰胺酶抗性基因进行了监测和鉴定。结果显示,检测到了8种病原微生物和β-内酰胺酶抗性基因,
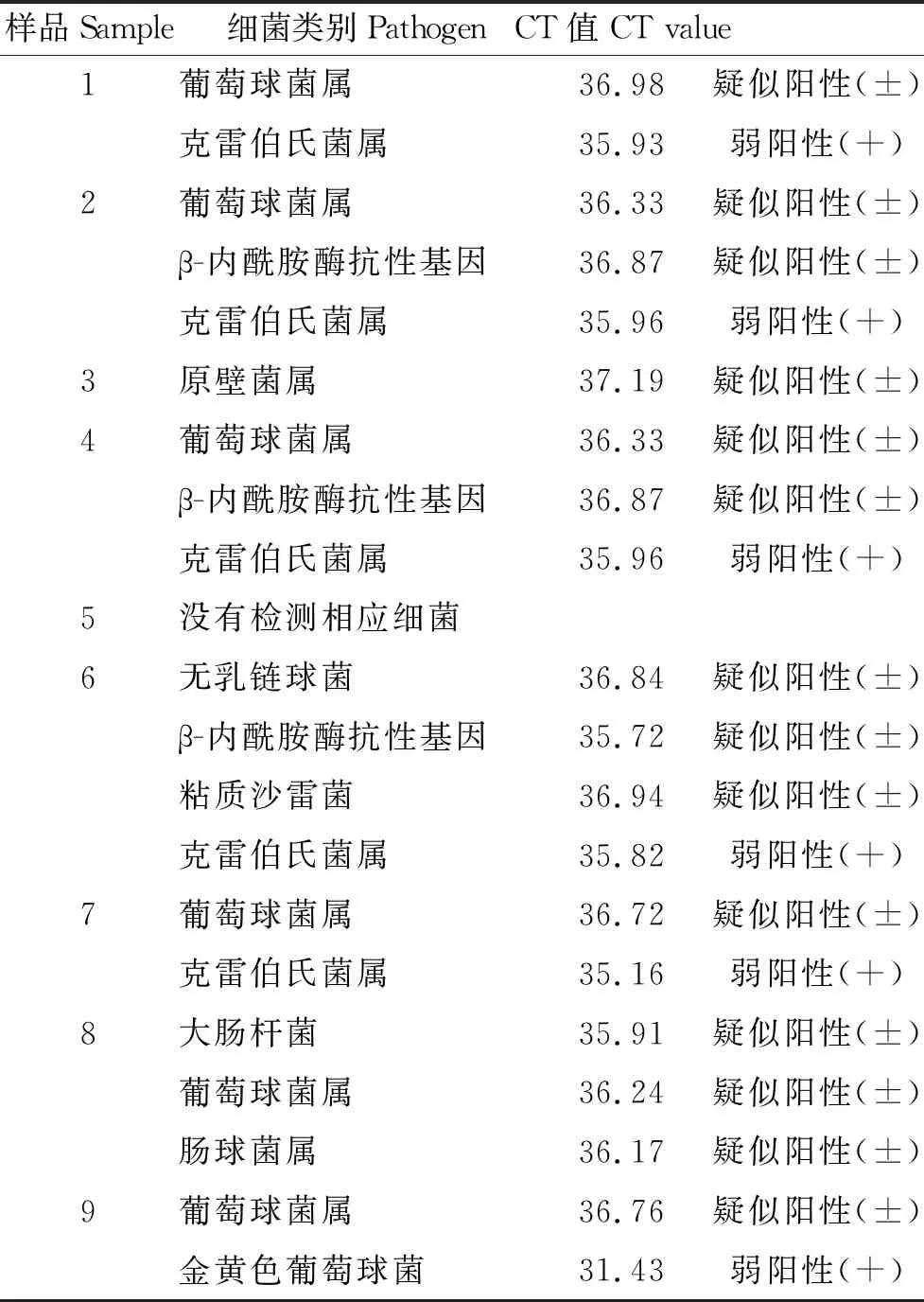
表4 牛乳房炎病原菌TaqMan探针实时荧光PCR检测结果
说明引起该奶牛场临床型乳房炎的病原菌种类繁多。有6个样品检测到弱阳性菌,其中5个样品中检测到克雷伯氏菌属,1例样品中检测到金黄色葡萄球菌。
克雷伯氏菌为是引起乳房炎最常见的环境性致病菌,同时也是人类肺炎、支气管炎和败血症等疾病的主要病原菌。杜琳等[9]研究表明克雷伯氏菌引起乳房炎的情况呈严重趋势,且有不同程度的耐药性。金黄色葡萄球菌为奶牛乳房炎主要的传染性致病菌,一般定殖在皮肤伤口和痂皮处,可以通过角蝇、挤奶过程传播给其他健康牛只,通常引起奶牛的最急性乳房炎或隐性乳房炎[10],且因其极易产生耐药性,所以这种菌一旦感染牛只,就不可能清除[11]。
4 小 结
通过本次试验,证实了分离培养的方法不能全面地反映引起乳房炎的细菌状况, 必须借助分子生物学方法进行分析。通过TaqMan探针实时荧光PCR发现造成奶牛乳房炎发病的病原微生物较多,一般为混合感染,所以在临床上治疗上,除了选用我们筛选过的敏感药物以外,还要选用一些弱阳性的病原菌的敏感药物进行混合使用,并定期更换药物。同时根据检测到的病原菌具有接触传染型病原菌和环境型病原菌的特点,奶牛场应从加强挤奶前后乳头的消毒,减少交叉感染和做好粪便处理、卫生消毒,保持环境清洁、干燥,减少病菌的存在两个方面来控制乳房炎的发生。

