廉价废弃物厌氧发酵制备生物己酸技术进展
张存胜, 杨 莉, 刘 岩, 霍书豪
(江苏大学 食品与生物工程学院, 江苏 镇江 212013)
1 前 言
作为中链羧酸,己酸可用于食品添加剂、医药、香料等工业生产[1]。在能源领域,己酸可作为前体原料用于己醇等生产[2]。目前世界每年己酸总需求达到几十万吨,但大多源自小型企业,生产规模较小,鲜有己酸年产量在100 t 以上的工厂。工业己酸生产主要由化学法合成,但该法能耗高、污染严重,不利于环境和经济可持续发展。通过提取法可从棕榈和椰子等作物中获得己酸,但己酸浓度低、成本高,未被广泛使用[3]。开发绿色、低成本的己酸制备方法已受到国内外重视[4]。
近几年,公认的绿色己酸生产工艺是生物法合成己酸,即在微生物作用下将短链酸醇通过碳链增长合成生物己酸[5]。有研究表明,“低己酸浓度”和“高原料成本”是限制生物己酸应用的“瓶颈”[3,6]。为实现突破,国内外研究人员做了大量研究和努力[7]。本文基于近年来的最新研究结果,对微生物发酵技术制备己酸的研究进行了综合论述,介绍了几种代表性的己酸菌并深入剖析它们的代谢合成机理,对影响己酸发酵的关键环境因子进行了重点分析与讨论,如混合菌群、电子供体、电子受体、pH 等,并以此提出了提高己酸产量的策略。从廉价生产的角度,对可用于己酸生物转化的废弃物进行了分类讨论,并对废弃物用于己酸发酵的应用前景进行综合分析。最后,对生物己酸未来的研究方向进行了展望,以期为后续研究提供指导。
2 己酸发酵微生物及代谢原理
目前报道的产己酸菌有多种,包括Clostridium kluyveri、Ruminococcaceae bacterium CPB6 和Megasphaera elsdenii 等,其中,C. kluyveri 是目前研究最多的菌株,它主要以乙醇(电子供体)和乙酸(电子受体)为底物,在己酸生成的同时伴有副产物丁酸和氢气产出[8]。己酸菌的代谢途径如图1 所示,电子供体与电子受体经过氧化后经过2 个反向β 氧化循环实现碳链增长,最终生成己酸[7],由于此过程将短链酸醇转化为中链羧酸,因此被称为链增长过程。
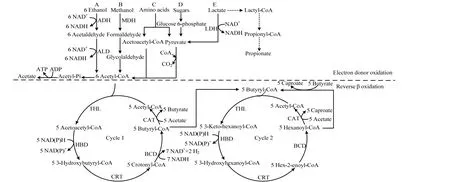
图1 己酸菌合成生物己酸代谢路径Fig.1 Metabolic pathway of biocaproate biosynthesis with caproate-producing bacteria
近年来,对己酸发酵的研究多集中在己酸产量提高,表1 列举了几种己酸菌利用不同底物进行己酸发酵的报道。2012 年,Weimer 等[8]利用C. kluyveri 在乙酸和乙醇质量浓度分别为7.2 和32 g·L-1条件下获得质量浓度为12.8 g·L-1的己酸,一度被认为是C. kluyveri 发酵的最高己酸质量浓度。直至2020 年,San-Valero 等[9-10]对C. kluyveri 己酸发酵展开进一步研究,在以乙酸和丁酸作为共同电子受体、恒定pH值(6.8)的条件下,获得了质量浓度为21.4 g·L-1的己酸,是目前C. kluyveri 菌的最高己酸产量。除C. kluyveri外,采用其他有机质(如乳酸、葡萄糖、甘油、甲醇等)进行己酸发酵的菌株也渐次报道[17-18],例如,Tao等[12]从产乳酸废水中分离出一株能够利用乳酸的己酸菌Ruminococcaceae Sp. CPB6,己酸质量浓度可达16.6 g·L-1。以葡萄糖、蔗糖、甘油、甲醇等为底物的己酸产量相对较低,尚需进一步深入研究。

表1 典型的产己酸菌株Table 1 Typical caproate-producing bacteria
随着生物技术发展,近年来有研究采用在基因工程与代谢工程手段改造菌株,试图提高己酸发酵性能。Cheon 等[19]将编码乙酰辅酶A 乙酰转移酶(acetoacetyl-CoA thiolase,THL)等5 种酶的基因片段整合到Kluyveromyces marxianus 染色体中异源重构己酸代谢途径,在微氧环境下利用半乳糖(20 g·L-1)经过12 h 发酵后获得了0.154 g·L-1己酸。Kim 等[20]在大肠杆菌中添加表达编码β-酮硫解酶(β-ketothiolase,BKTB)和乙酰辅酶A 转移酶(acetyl-CoA transferase,ACT)的基因以构建生产己酸的功能菌并下调THL 的表达水平,发酵36 h 获得了0.528 g·L-1己酸,在缩短发酵时间的同时实现了有氧环境下己酸的合成。杨娇[21]发现C. kluyveri 的关键酶THL 编码基因过表达后,对菌体的生长和己酸浓度无影响,原因可能是THL在C. kluyveri 菌体内本身具有较高的转录水平,导致基因过表达后对己酸代谢无明显影响。
3 提高己酸发酵性能的策略
3.1 混菌发酵
混菌体系包括开放式混菌体系和人工构建混菌体系,开放式混菌体系通常采用厌氧活性污泥为菌种,其中,己酸菌为优势菌,各种微生物在体系中共同作用实现己酸转化[22-23]。因此,与单一菌株体系相比,混菌体系无需灭菌,降低了能耗与经济成本、对复杂原料操作性强。然而,混菌体系内的己酸合成往往存在底物竞争,包括甲烷化、乙醇氧化为乙酸、羧酸氧化和丙烯酸途径等[24-25],导致底物或中间产物损失,进而降低己酸产率。目前抑制甲烷化的策略有:投加产甲烷菌抑制剂(如2-BES 和CHCl3等)、调控体系pH 至弱酸性等[26]。另外,提高氢分压可限制乙醇向羧酸氧化[24],降低乳酸浓度可减少乳酸向丙烯酸途径转化,但丙烯酸途径抑制措施尚未见报道。
与污泥体系不同,人工构建的混菌体系能够对细菌种类精准控制,实现底物的定向转化。Richter 等[27]将C. ljungdahlii 和C. kluyveri 混合培养,利用C. ljungdahlii 首先将合成气转化为乙酸和乙醇,然后利用C. kluyveri 进行己酸生物合成,己酸生成速率达8.1 g·L-1·d-1。另有研究将C. kluyveri 与甲烷菌Methanogen 166 混合发酵[28],发现甲烷菌能将C. kluyveri 发酵产生的H2转化为甲烷,消除了高氢分压引起的反馈抑制。上述研究表明,人工混菌培养能够克服单一菌种的缺陷,是提高己酸发酵性能的可行策略。
3.2 合理调配电子供体与电子受体比率与浓度
合理的电子供体与电子受体配比有利于提高己酸转化率,由图1 显示,乙酰辅酶 A 是己酸合成的重要前体物质,它是由电子供体的氧化产生,且电子供体氧化过程会产生烟酰胺脉噁呤二核苷酸(NADH),为下游代谢提供能量,这表明电子供体是引导己酸合成的重要动力和物质来源[29]。C. kluyveri 利用乙醇合成己酸的反应式(1)~(4) (见表2)[9]。若要获得较高己酸产量,需提供较高的乙醇质量浓度,然而当质量浓度超过32 g·L-1时,乙醇将会对C. kluyveri 细胞产生抑制,导致己酸浓度降低[8]。乳酸作为电子供体向己酸转化的反应如式(5)~(7) (见表2)[7],以乳酸为底物进行己酸发酵可获得较高的己酸产量,例如,Zhu等[30]以乳酸为底物进行己酸发酵获得的己酸产量达23.41 g·L-1。但有研究发现,乳酸质量浓度超过14.6 g·L-1时,部分乳酸将通过丙烯酸竞争途径生成丙酸,限制己酸的进一步合成[17]。葡萄糖也可作为电子供体实现己酸转化,如图1 所示,葡萄糖为电子供体时产生的能量不足以供应反向β 氧化的持续进行,导致大量副产物(如丁酸)产生[31]。为了克服单一糖类电子供应不足的问题,有研究将葡萄糖与果糖、蔗糖混合发酵,即以混合糖为共同电子供体,结果表明己酸产量可由4.1 提高到13 g·L-1[31-32],这表明共同电子供体能够为己酸合成提供更多的能量,提高己酸转化率。
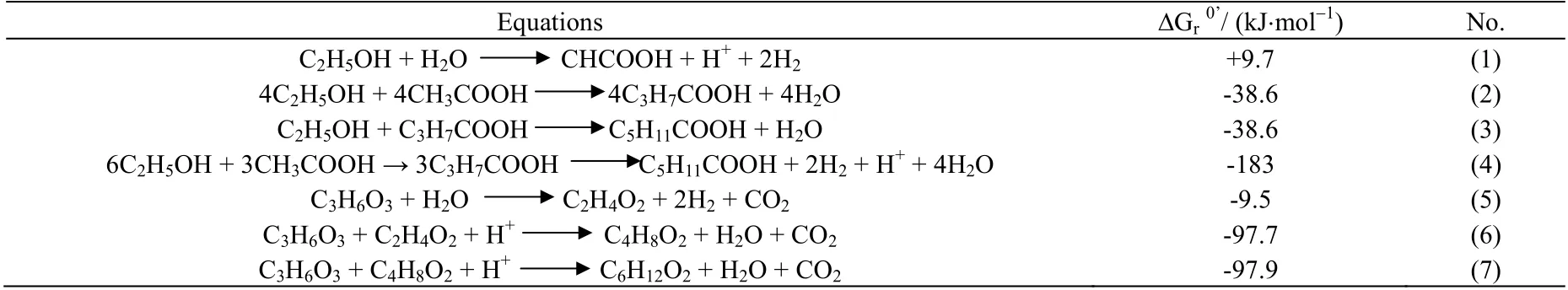
表2 以乙醇和乳酸为电子供体进行生物己酸合成的反应式Table 2 Reaction equations of biocaproate production using ethanol and lactic acid as electron donors
除电子供体外,电子受体是己酸合成的重要物质,控制电子供体与电子受体的比率对己酸产量提高具有重要作用。有研究表明,当乙醇与乙酸摩尔比为3:7 时,由于电子供体不足导致己酸质量浓度低于1.0 g·L-1,当乙醇与乙酸摩尔比为7:3 时,己酸质量浓度达到3.11 g·L-1,更高的比值将导致己酸菌生长代谢受抑制[11]。值得注意的是,理论上乙醇与乙酸摩尔比为2:1,如表2 反应式(4)所示,此时乙醇和乙酸可被完全利用[33]。但实际发酵过程中乙醇与乙酸摩尔比往往需大于2:1,这是由于乙醇除向乙酰辅酶A转化外,部分还需氧化为乙酸为代谢提供动力,如图1 所示[30]。
3.3 解除发酵抑制因素
发酵体系内未解离己酸对己酸菌的毒性较大,这是由于它可以自由出入细胞膜,影响胞内pH 稳定和酶活,进而抑制己酸的合成[34]。研究表明,未解离己酸的抑制质量浓度为0.2 g·L-1[6],当未解离己酸质量浓度为0.87 g·L-1时,己酸菌活性将完全被抑制[35]。体系内解离与未解离的己酸质量浓度关系如式(8)所示,中性条件比酸性更有利于降低未解离的己酸质量浓度,以0.2 g·L-1未解离己酸和pH 为7.0 的计算,己酸最高产量为27.8 g·L-1。这说明,除调节pH值外,有必要对己酸进行在线分离以获得更高己酸产量[14,36],如液液萃取、膜渗析等[37]。

式中:pKa为某一确定pH 值下的己酸解离平衡常数;cA-和cHA分别为解离和未解离己酸的浓度,mol·m-3。
除未解离己酸外,体系内高浓度乙醇和乙酸对己酸菌也有毒性作用,乙醇的抑制作用在3.2 节已论述。研究表明,当乙酸质量浓度超过20 g·L-1时即产生较高的细胞渗透性,抑制细胞的活性[38]。然而,低浓度乙酸乙醇又将限制己酸产量提高。因此,为避免底物抑制,可考虑采用连续发酵方式提高己酸产量[2,39]。此外,以酸醇废水为底物进行发酵时,废水中的氨氮等对己酸发酵会产生抑制作用。研究发现,当氨氮质量浓度达到2.0 g·L-1时,游离的C. kluyveri 细胞活性受到完全抑制。为了提高C. kluyveri 对氨氮的耐受性,采用秸秆对C. kluyveri 细胞进行固定,结果表明,固定化形成的C. kluyveri 生物被膜细胞对氨氮的耐受性明显提高,氨氮质量浓度达到5.0 g·L-1时固定化细胞仍可进行生长代谢[33]。
3.4 pH 调控
pH 是影响微生物发酵的重要参数,它可影响胞内外质子平衡,也影响底物和代谢物的解离状态。由式(8)可知,pH 与未解离己酸呈反比,较低的pH 易导致体系未解离己酸浓度升高,产生抑制作用。当pH接近中性时,未解离己酸质量浓度较低,有利于己酸产量的增加[1,40]。研究表明,以乙酸和乙醇为底物时,控制发酵过程中pH 为7.5,C. kluyveri 的己酸质量浓度可达19.4 g·L-1,当pH 控制在6.4 时,己酸质量浓度降至13.3 g·L-1[10]。Yu 等[41]以果蔬废弃物为原料,在开放式混菌发酵过程中控制pH 为7.5 时己酸产量为14.9 g·L-1,当pH 为5.5 时其产量仅为2.3 g·L-1,这表明中性pH 对己酸发酵极为重要。然而在中性环境下,混菌体系中的产甲烷菌活性较高,甲烷菌对底物消耗量的增大将引起己酸产量的降低。因此,需采用手段抑制甲烷菌的活性,具体方法在3.1 节已论述。
3.5 其他措施
己酸发酵还受氢分压、温度、反应器结构和厌氧水平等影响。氢气是己酸合成的副产物,较高的氢分压能在一定程度上阻止乙醇氧化为乙酸,降低电子供体的损耗,但氢分压过高时反向β 氧化过程的能量(ATP)将供应不足,限制己酸的合成[2]。Grootscholten 等[24]研究表明,适宜的氢分压范围为3~10 kPa。微生物生长代谢需要在适宜温度下才能高效进行[42]。多数己酸菌为嗜温菌(30~40 ℃),例如,C. kluyveri在温度为19~45 ℃均可生长代谢,在34 ℃左右可实现快速增殖[43]。Agler 等[26]研究表明,发酵温度由55降至30 ℃后己酸合成速率明显提高。另外,反应器结构对己酸生成速率有较大影响,有学者分别对不同反应器(包括上流式厌氧滤池、连续搅拌釜式反应器、厌氧序列式反应器和膨胀颗粒污泥床)研究发现,不同反应器获得的己酸合成速率差异较大,在0.9~57.4 g·L-1·d-1[4,26]。此外,产己酸菌如Clostridium spp.等均为严格厌氧细菌[20],厌氧水平对己酸发酵影响较大,一般要求氧化还原电位在-200~ -250 mV。有氧气存在时,胞外氧渗入细胞质后易将NAD(P)H 氧化,不利于己酸代谢途径中依赖NAD(P)H 的丁酰辅酶A 脱氢酶等维持高活性[44]。为去除发酵体系的氧气,一般是利用惰性气体(如氮气)将体系氧气置换,并添加一定量的还原剂,如二硫苏糖醇、Na2S 等化学试剂[45]。
4 廉价己酸发酵原料应用前景分析
使用乙酸、乙醇等纯化学品进行生物己酸发酵获得的己酸成本较高。因此,近几年的己酸发酵研究多集中在利用废弃物上,以寻求更为低廉的生物己酸生产成本。广义上来讲,含有丰富电子供体或电子受体的废弃物均可以被己酸菌利用,然而从经济角度,低浓度的电子供体或电子受体利用价值不明显。通过大量文献查询发现,生物己酸廉价原料开发主要集中在酿酒副产物、食品废弃物和工业废弃合成气等,另有以酸性乳清[46-47]、纤维素[48]和废弃甘油[49]等为原料进行己酸发酵的报道,但研究较少。因此,重点分析了酿酒副产物、食品废弃物和工业废弃合成气己酸发酵的应用前景。
4.1 酿酒副产物
酿酒工业每年会产生大量的副产物,据报道每生产1 t 白酒就能产生6~10 t 酒糟和15~25 t 高浓度有机废水[50]。副产物中往往含有高浓度的乙醇和复杂的有机质等,见表3。有机质通过水解酸化生成乙酸,可供己酸菌作为电子受体使用。由于酿酒废水中的可溶性物质较高且物质密度相对较低,因此其用于己酸发酵时宜采用半连续或连续发酵。Ge 等[35]以稀释的啤酒废水为原料,采用半连续式发酵并串联硅橡胶膜液-液萃取装置进行己酸在线萃取,在连续运行的55 d 后获得的平均己酸生产速率为3.4 g·L-1·d-1。Wu等[51]使用厌氧颗粒污泥膨胀床反应器实现了白酒废水的己酸连续发酵,发现乙醇和乳酸可同时被作为电子供体被利用,并获得了10.3 g·L-1·d-1的高己酸合成速率。此外,酒糟是酿酒工业的另一重要副产物,其主要包含粮食残渣和乙醇。与酿酒废水不同,酒糟中的纤维素类含量较高,转化为短链脂肪酸需要更长的时间,发酵效率较低。Scarborough 等[52]采用开放式培养体系,以酒糟作为原料、经过252 d 的稳定运行,实现木质素和糖类等向短链酸醇转化,并结合残存的乙醇实现了己酸的转化。这表明,以酿酒副产物为原料能够实现生物己酸转化,但其工业应用的可行性有待进一步论证。

表3 廉价原料用于生物己酸发酵Table 3 Biocaproate production from the low-cost substrates
4.2 食品废弃物
我国每年有9 000 余万吨餐厨垃圾被排放,餐厨垃圾富含高浓度淀粉、蛋白质等营养物质,极易被微生物利用[56]。从化学成分上来看,食品废弃物的能量密度高,水解酸化产生的高浓度短链酸有利于己酸的合成。如表3 所示,食品废弃物己酸发酵获得的己酸质量浓度可达14.9 g·L-1[41],这表明食品废弃物是一种较为理想的廉价原料。食品废弃物向己酸的转化,多数采用2 步发酵,即第1 步通过水解酸化将淀粉等碳水化合物降解为乙酸、丁酸或乳酸等,第2 步己酸菌利用外源乙醇和酸化液进行己酸转化。采用两相厌氧发酵将酸化和产己酸过程分离,可有效避免未解离己酸和乙醇的毒性,同时可对两阶段工艺分别调控。乙醇作为电子供体必不可少,采用纯乙醇势必提高己酸成本,以食品废弃物为原料、通过乙醇发酵获取廉价乙醇用于己酸发酵更为可行[3]。
4.3 工业废弃合成气
工业废弃合成气的主要成分是CO、CO2和H2[57],将合成气直接排放会对生态环境造成严重影响。通过微生物的Wood-Ljungdahl 途径将合成气转化为乙醇和乙酸[58],可进一步通过链增长转化为生物己酸。与另外2 种废弃物不同:1)气体用于发酵存在更多的接触障碍,即合成气首先溶解于发酵液才能被微生物利用,溶解速率快慢将影响发酵效率;2)气体中的物质密度较低,获得的己酸浓度往往较低,如表3所示,合成气获得的己酸浓度明显较酿酒副产物和食品废弃物低。然而,合成气己酸发酵的优势在于获得的己酸纯度较高,同时合成气中的抑制物含量较低,不易产生抑制作用。若要获得高己酸产量,高底物浓度必不可少,可采用提纯、浓缩技术将合成气转化的乙酸乙醇进行浓缩,为己酸发酵提供更高的底物浓度,但工艺的经济性有待评估。
4.4 廉价原料的优势与挑战
市场调查显示,工业级乙醇价格在0.40~0.47 万元·t-1、乙酸0.45~0.5 万元·t-1,而正己酸价格在2.0~2.6万元·t-1,这表明己酸发酵能够实现化学品的高值转化。与纯的乙酸、乙醇化学品相比,采用廉价废弃物进行己酸发酵能够大幅降低原料成本,如表3 所示,3 类废弃物的原料成本十分低廉,甚至可以享受废弃物排放产生的费用补贴,利用废弃物进行生物己酸转化的经济优势不言而喻。因此,废弃物用于己酸发酵的前景十分广阔。
从技术角度看,利用废弃物进行己酸生物合成仍存在诸多挑战,最为突出的问题是己酸产量过低,例如,合成气获得的己酸质量浓度仅为1.0 g·L-1[6,55],低己酸浓度将增加下游分离提纯的工艺难度和经济成本。此外,餐厨垃圾的物料成分复杂,往往会对己酸发酵有一定影响,如高浓度盐分和油脂等会抑制微生物生长,进而抑制己酸合成。针对上述问题,后续研究应重点集中在己酸产量提高、菌种耐受性、抑制物解除和新工艺开发等。同时需要对发酵的经济性进行分析和评估,通过优化发酵过程提高生物己酸的经济性。
5 展 望
厌氧发酵技术合成生物己酸具有广阔的发展前景,但因己酸产量低尚无在工业应用。未来在以下方面可能取得进展:(1)通过基因工程或酶工程改造己酸菌,提高代谢途径通量和细胞膜通透性,并以此提高己酸产量和发酵效率。(2)通过胁迫驯化等手段或菌种筛选获得高耐受性菌株,用于复杂原料的生物转化。(3)开发己酸在线分离工艺与设备,将己酸进行高效分离以解除己酸对微生物的抑制作用,如功能膜材料制备与分离装置、高效萃取剂开发等。

