人来源α-1,3/1,6 甘露糖转移酶Alg2 的异源表达及活性测定
胥欣欣, 王春迪, 陈 帅, 高晓冬
(江南大学 生物工程学院,江苏 无锡214122)
在真核生物中,N-糖基化是一个高度保守的蛋白质修饰过程[1-3]。 该过程发生在内质网上,起始于多萜醇寡糖前体 (Dolichol Linked Oligosaccharide,DLO)的生物合成,其中14 个单糖依次转移到多萜醇焦磷酸 (PP-Dol) 基团上形成核心寡糖前体Glc3Man9GlcNAc2-PP-Dol[2,4-7]。 一系列ER 膜上的糖基转移酶(GTases)统称为Alg(Asparagine-linked glycosylation)蛋白,有序催化DLO 的合成[1,8-9]。 DLO合成的前7 个反应发生在ER 的胞质侧, 生成Man5GlcNAc2-PP-Dol 中间体, 随后会翻转至ER腔内进一步被延伸[10]。 最终,寡糖基转移酶(OST)会将DLO 寡糖前体转移到新生多肽Asn-X-Ser/Thr序列的天冬酰胺(Asn)残基上(X 指除脯氨酸外的氨基酸)[11]。
在N-糖基化途径中,ALG2 基因编码的甘露糖基转移酶具有双功能,催化第二和第三个甘露糖的添加,即以GDP-mannose 为供体,向ManGlcNAc2-PP-Dol 添加α-1,3 和α-1,6 连键的甘露糖, 形成分支结构的Man3GlcNAc2-PP-Dol[12-15]。有文献报道Alg1、Alg2 和Alg11 会形成异聚复合体共同参与胞质侧甘露糖的添加[16-17]。 最初,在酿酒酵母Saccharomyces cerevisiae 中, 研究人员通过筛选获得一种温度敏感性突变体alg2-1,它在限制性温度下会积累脂连的Man2GlcNAc2[18],表明alg2-1 的糖基转移酶存在缺陷, 无法催化α-1,6 甘露糖的添加,继而通过回补实验克隆得到ALG2 基因[19]。 关于人类ALG2-CDG 疾病相关突变体的报道也表明,ALG2 基因是添加α-1,3 连接的甘露糖所必需的[20]。利用表达ScAlg2 的大肠杆菌膜组分,Alg2 的双功能性得到了初步鉴定,后续研究中也进一步利用酵母微粒体膜部分制备的ScAlg2 和纯化的TrxAScAlg2 证明了其可以转移α-1,3/1,6 连键的甘露糖,会以不同的催化速率同时合成α-1,3 或α-1,6连键Man2GlcNAc2PP-Dol 两种中间体[12-13,21]。 最近研究人员成功地将从人类胚胎肾(HEK)293 细胞中纯化的hAlg2 应用于化学酶法生产Man5GlcNAc2-PP-Dol 类似物[22]。
然而, 用动物细胞表达蛋白质成本相对较高。目前, 在大肠杆菌中表达hAlg2 的相关研究鲜有报道。 在真核细胞中,Alg2 的天然底物是Man1GlcNAc2-PP-Dol。 多萜醇(Dolichol)的碳链较长,使得该天然底物的合成和纯化难度较高。 有研究表明,GlcNAc2-PP-Phytanyl (PPGn2) 可被用作Alg1 天然底物的替代物[23]。因此,使用碳链短且结构相似的植烷醇(Phytanol)替代天然底物中的多萜醇是目前的极佳选择。 作者所在课题组曾在大肠杆菌中表达了酵母来源的重组蛋白Alg1ΔTM,详细阐明了其酶学性质, 并成功合成了Man1GlcNAc2-PPPhy(PPGn2M1)[24]作为hAlg2 的底物用以研究其体外活性。
作者利用酿酒酵母生长表型回补系统,对hALG2 基因的体内功能和蛋白质表达进行了分析。此外,利用原核表达系统操作简单,成本低廉的特点, 在大肠杆菌中诱导表达了TrxA-hAlg2 重组蛋白, 并进行了分离纯化。 结合基于LC-MS 的Alg-MTase 体外活性测定法[21,24-26],对纯化的TrxA-hAlg2进行了体外的活性测定。
1 材料与方法
1.1 材料
1.1.1 菌种、质粒和培养基 酿酒酵母w303a 模式菌株:作者所在实验室保藏;大肠杆菌克隆宿主细胞XL10-Gold:作者所在实验室保藏;用于原核表达的大肠杆菌感受态Rosetta (DE3) 和用于原核表达的载体pET28a 和pET32a: 购于默克密理博公司;质粒YEp351GAPII 和pRS315:作者在实验室保藏。
LB 培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10;TBK 培养基(g/L):酵母提取物24,胰蛋白胨12,三水合磷酸氢二钾16.4,磷酸二氢钾2.31;加入体积分数0.4%的甘油。 根据实验需求,可在相应的培养基中加入终质量浓度100 μg/mL 氨苄霉素或34 μg/mL 氯霉素。
YPAD/YPAG 培养基(g/L):酵母提取物10,蛋白胨20, 腺嘌呤0.03;SD/SG 缺陷型培养基(g/L):YNB 6.7,氨基酸缺陷粉末2。YPAD 或SD 中额外加入终质量浓度2 g/dL 的葡萄糖;YPAG 或SG 中额外加入终质量浓度2 g/dL 的半乳糖。
1.1.2 主要试剂和仪器 PrimeSTAR GXL DNA 聚合酶、Mighty Mix DNA 连接酶、 一系列限制性内切酶:购于宝生物工程(大连)公司;GoldView I 型核酸染色剂:购于索莱宝公司;异丙基-β-D-硫代半乳糖苷(IPTG),PCR 产物纯化、DNA 胶回收和DNA 小量抽提试剂盒:购于生工生物工程(上海)公司;BCA蛋白浓度试剂盒、SDS-PAGE 蛋白凝胶制备试剂盒: 购于碧云天生物公司;Protease inhibitor cocktail、Anti-FLAG Mouse mAb: 购于西格玛公司;Anti-Dpm1 Mouse mAb: 购于艾博抗公司;Anti-His Mouse mAb、Goat Anti-Mouse IgG HRP、Blue Plus II Protein Marker、1 kb Plus DNA Ladder: 购于全式金生物公司;PCR 仪、凝胶成像仪、半干电转仪:购于伯乐公司;1 mL HisTrap HP 亲和层析柱、ImageQuantTMLAS 4000 mini 显 像 仪: 购 于GE healthcare 公司;NanoDrop2000、 三重四极杆液质连用仪: 购于赛默飞公司; 液相色谱柱粒径1.7 μm,2.1 mm×100 mm:购于沃特世公司。
1.1.3 实验溶液 Lysis buffer (酵母细胞裂解液):0.2 mol/L 山梨醇,1 mmol/L EDTA,50 mmol/L Tris-HCl (pH 7.5);5×Sample buffer (蛋白质上样缓冲液):10 g/dL SDS,0.5 g/dL 溴酚蓝,250 mmol/L Tris-HCl(pH 8.0),体积分数50%甘油,5 g/dL β-巯基乙醇;Running buffer(蛋白质RFM 电泳缓冲液):25 mmol/L Tris-HCl (pH 8.3),192 mmol/L 甘氨酸,0.1 g/dL SDS;Transfer buffer(转膜缓冲液):25 mmol/L Tris-HCl (pH 8.3),192 mmol/L 甘氨酸, 体积分数20%甲醇;TBST (洗膜缓冲液):137 mmol/L NaCl,20 mmol/L Tris-HCl (pH 7.6), 体 积 分 数0.05%Tween-20;Buffer A (E. coli 裂 解 液):150 mmol/L NaCl,25 mmol/L Tris-HCl(pH 8.0);Buffer B(平衡缓冲液):150 mmol/L NaCl,25 mmol/L Tris-HCl(pH 8.0),体积分数0.3% Triton X-100;在Buffer B 的基础上,按咪唑浓度20、60、500 mmol/L 配制梯度洗脱缓冲液;Buffer C (除盐液):50 mmol/L NaCl,25 mmol/L Tris-HCl (pH 8.0), 体积分数5%甘油;Buffer D (活性反应液):38 mmol/L Tris-HCl(pH 7.2),1.8 mmol/L DTT,0.28 mmol/L EDTA,0.26 g/dL NP40。
1.2 方法
1.2.1 质粒的构建 质粒YEp351GAPII-FLAGhALG2 的构建如下:以人cDNA 为模板,X22:CGGG AGCTCATGGACTACAAAGACGATGACGACAAGCT CGAGGCGGAGGAGCAGGGCCGGG 和X23:GCTCT AGATTATACCAGCAGTTTGGTAAC 为上下游引物(划线部分依次为Sac I 和Xba I 酶切位点),扩增目的基因FLAG-hALG2。 经Sac I 和Xba I 双酶切后,将片段连入相同酶切的YEp351GAPII。
质粒pRS315-ALG2pr-FLAG-hALG2-ALG2ter的构建如下:以YEp351GAPII-FLAG-hALG2 为模板,X48:TGCTCTAGAATGGACTACAAAGACGATGA 和X19:AAAAAAGCTTTTATACCAGCAGTTTGGTAAC为上下游引物,扩增基因FLAG-hALG2。经Xba I 和Hin d III 双酶切后, 片段连入相同酶切的pRS315-ALG2pr-ALG2ter。
质粒pET32a-hALG2的构建如下:以YEp351GAPIIFLAG-hALG2 为 模 板,X17:CGCGGATCCGCGGAG GAGCAGGGCCGGGA 和X19:AAAAAAGCTTTTAT ACCAGCAGTTTGGTAAC 为上下游引物, 扩增基因hALG2。 经Bam H I 和Hin d III 双酶切后,片段连入相同酶切的pET32a。
1.2.2 w303a-GAL1pr-ALG2 菌株的构建 以pFA6a-His3MX6-PGAL1 为模板,X33:TAGATACA GTAGTAAAGACAGATAAAAAAGAGTCGATTAGAC AAGCAAAAGAATTCGAGCTCGTTTAAAC 和X34:CCTAGGTCTGGATGAATAAAAGCAATCGTTCTTTT ATCCTTTTCAATCATTTTGAGATCCGGGTTTT 为上下游引物, 扩增含有酿酒酵母ALG2 启动子区域同源臂和半乳糖启动子的基因片段。 经乙醇沉淀法提取后, 线性转化至野生型酵母w303a 中, 涂布至SD-HIS 缺陷型固体培养基上。 阳性转化子由菌落PCR 和基因组PCR 验证后获得, 上游引物F:CCATAGGATGATAATGCG,下游引物R:TTATATTT CTTCATAAGG。
1.2.3 酵母点板实验 取对数生长期的酵母细胞,OD600在1~3 之间均可。根据分光光度计测量的菌体OD 值, 计算并调节每个样品的起始OD 数相同,用去离子水按10 倍稀释,共4 个梯度,每个梯度分别取5 μL, 依次点于YPAD 或YPAG 固体培养基,30 ℃静置培养36 h。
1.2.4 酵母蛋白质的提取 取对数生长期的酵母细胞,OD600在1~3 之间均可, 收集6~7 个OD 单位的细胞,用1 mL 去离子水洗涤一次。 加入200 μL Lysis buffer 重悬,同时加入适量0.3~0.4 mm 规格玻璃珠1×Protease inhibitor cocktail;振荡1 min,冰上1 min,重复10 次,以下步骤在4 ℃下进行。 1 000 g离心5 min,去除未破碎细胞和细胞碎片。 取上清液200 μL,3 000 g 离心5 min, 进一步去除细胞碎片和细胞核组分,取上清液180 μL 为全细胞蛋白质;13 000 g 离心30 min, 取沉淀为内质网膜组分,用180 μL Lysis buffer 重 悬。 蛋 白 质 浓 度 用NanoDrop2000 测定。
1.2.5 重组蛋白的诱导表达和纯化 将含有原核表达载体pET32a-hALG2 的大肠杆菌Rosetta(DE3)单克隆转化子,接种于5 mL 含氨苄霉素和氯霉素的LB 液体培养基中,37 ℃摇床过夜。 次日,转接2 mL 过夜培养的菌液至200 mL 含卡那霉素和氯霉素的TBK 液体培养基中,37 ℃摇床培养3 h 左右。 测得菌体A600nm达到0.6~0.8 后,16 ℃摇床继续培养1 h。最后加入终浓度0.1 mmol/L IPTG,继续诱导培养20 h。
离心收集所有菌体,20 mL BufferA 重悬后冰上超声破碎;4 000 g 离心20 min, 去除细胞碎片;取上清液20 000 g 离心90 min,取沉淀重悬于10 mL Buffer B,静置30 min;12 000 g 离心30 min,得上清液为膜蛋白,以上过程在4 ℃下完成。
用10 mL Buffer B 过His Trap HP(1mL)亲和层析柱,平衡;取上清液膜蛋白过柱,上样;10 mL Buffer B 去除未结合的蛋白质; 分别用10 mL 含20、60 mmol/L 咪唑和含500 mmol/L 咪唑+体积分数5%的甘油的BufferA 依次洗脱并收集至离心管,利用SDS-PAGE 检测纯化蛋白质。 最后,将含纯化的蛋白质洗脱液加至Amicon Ultra 10 K NMWL 浓缩管, 离心浓缩, 并以BufferC 除盐。 蛋白质浓度由BCA 试剂盒检测。
1.2.6 蛋白质免疫印迹 取适量蛋白质样品,加入对应5×Sample buffer 后混匀,95 ℃处理5 min。根据不同样品的蛋白质浓度,计算并保持所有蛋白质上样量的一致。 装配电泳装置, 加注适量1×running buffer 后上样和蛋白质Marker, 在180 V 恒压条件下运行80 min。 电泳完成后采用半干法转膜,条件设置为25 V、0.1 A、30 min。 转膜完成后,将PVDF膜浸于含5 g/dL 脱脂奶粉的TBST 中封闭, 室温放置1~2 h。 一抗/二抗均稀释于含5 g/dL 脱脂奶粉的封闭液中,一抗稀释比例1∶3 000,二抗稀释比例1∶5 000。 封闭完成后取出PVDF 膜,按顺序加入相应一抗、二抗,抗体孵育时间为室温1~2 h 或4 ℃过夜。 抗体孵育完成后, 用TBST 洗涤PVDF 膜10 min,重复3 次。 取适量ECL 显示剂A 液和B 液,以体积比1∶1 混匀。将显色液均匀散布在PVDF 膜上,静置1 min, 用Image Quant LAS 4000 mini 进行自动曝光拍摄。
1.2.7 体外活性反应体系 PPGn2M1 的合成详见文献[24]。 加入终浓度50 μmol/L PPGn2、2 mmol/L GDP-Man、10 mmol/L MgCl2至Buffer D 中, 终体系为100 μL,加入2 μg 纯化的Alg1NΔTM,30 ℃静置孵育1 h, 得TrxA-hAlg2 的底物PPGn2M1。 对于TrxA-hAlg2 的反应,取上述反应液50 μL,直接加入2.5 μg 纯化的TrxA-hAlg2,30 ℃静置孵育1 h。
1.2.8 LC-MS 检测糖链 向反应体系加入等体积20 mmol/L 盐酸,100 ℃终止反应, 同时酸解释放脂肪链上的糖链后,利用Supelclean ENVI-Carb Slurry对糖链进行固相萃取; 纯化所得糖链经冷冻干燥后,用去离子水重悬;通过超效液相色谱仪Dionex Ultimate 3000 UPLC 自动进样到氨基色谱柱UPLC BEH Amide Column(粒径1.7 μm,2.1 mm×100 mm)中,乙腈线性梯度洗脱(溶液A:乙腈;溶液B:去离子水)。洗脱条件:0~2 min 体积分数20%B;2~15 min,体积分数20%~50% B;15~18 min, 体积分数50%B;流量:0.2 mL/min。 分离所得底物和产物,再经由ESI-MS 仪器TSQ Quantum Ultra 在正离子模式下同步检测相对分子质量。
2 结果与讨论
2.1 人源Alg2 蛋白的疏水性预测
酿酒酵母Alg2(ScAlg2)的N 端含两个跨膜结构域,C 端两个疏水序列以非跨膜方式和内质网结合[13]。 利用在线软件TMpred(https://embnet.vital-it.ch/software/TMPRED_form.html) 对hAlg2 进行跨膜预测,结果见图1。 hAlg2 仅在N 端具有一个疏水性区域,位于氨基酸85-104 位,是潜在的惟一内质网膜结合域。
hAlg2 这种膜结合形式与ScAlg2 呈现出明显的差异, 这也就引出了hAlg2 在酿酒酵母中或在大肠杆菌中表达并纯化后,是否和ScAlg2 之间存在差异的疑问。
2.2 w303a-GAL1pr-ALG2 菌株的鉴定
在酿酒酵母中,ALG2 是必需基因,直接敲除会导致细胞死亡。 因此,难以实现通过基因敲除获得完全无ALG2 基因背景的菌株。 通过基因改造母株w303a 获得的菌株w303a-GAL1pr-ALG2, 见图2(a)。其基因组上ALG2 自身启动子(ALG2pr)由半乳糖启动子(GAL1pr)取代。该菌株在半乳糖培养基中,ALG2 基因会被表达,细胞能够正常生长;在葡萄糖培养基中,ALG2 基因会被抑制表达, 细胞会死亡。通过观察XGY29 在葡萄糖培养基上的生长表型,可以判断在菌株中外源表达的基因是否具有体内活性。
以图2(a)中所示F、R 为上下游引物,取菌落PCR 验证正确的1 号、2 号单菌落基因组后进一步PCR 验证,均得位于1 500~2 000 bp 之间的单一条带,和理论大小1 753 bp 相符;而野生型(WT)中由于不含引物F 序列,无法扩增出目的带(图2(b))。将w303a-GAL1pr-ALG2 (1 号) 和w303a 点板于YPAD 固体培养基上,前者表现出明显的生长缺陷,即其无法在含有葡萄糖的条件下生长(图2(c))。这些结果说明w303a-GAL1pr-ALG2 菌株构建成功。
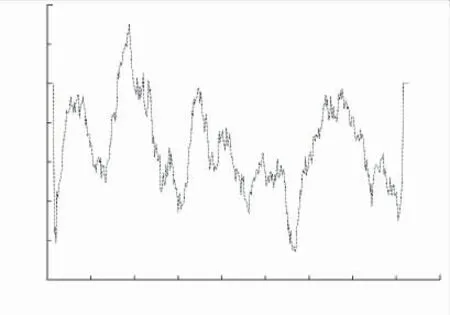
图1 hAlg2 蛋白的TMpred 跨膜预测Fig. 1 Transmembrane prediction of hAlg2 protein using TMpred
2.3 h ALG2 在w303a-GAL1pr-ALG2 菌株中的表型回补和蛋白质表达
将融合FLAG 标签的h ALG2 基因分别构建入含 TDH3 强 启 动 子 的 多 拷 贝 (2μ) 质 粒YEp351GAPII(图3(a)、(b))和含酵母ALG2 启动子(ALG2pr)的单拷贝质粒pRS315(图3(c)、(d))中, 构建成功的两种质粒经双酶切后电泳验证,均显示有两个条带,即载体条带和目的基因条带(理论大小为1 281 bp)。
随后,将YEp351GAPII(作为空载对照)和上述两个质粒分别在w303a-GAL1pr-ALG2 菌株中表达。 如图4(a)所示,在YPAG 培养基上,w303a-GAL1pr-ALG2 在分别转入3 种质粒后均能正常生长, 说明这些质粒不影响Sc ALG2 正常表达时细胞的生长; 在YPAD 培养基上, 仅当过表达外源的h ALG2 时,才能回补该菌株的生长缺陷。 提取对应的内质网膜蛋白组分进行免疫印记分析,仅能检测到过表达条件下的hAlg2p 条带 (50 000 左右),见图4(b)。 这些结果说明,h ALG2 基因在酵母细胞中具有功能同源性,而且仅在其过表达的条件下才能发挥功能。
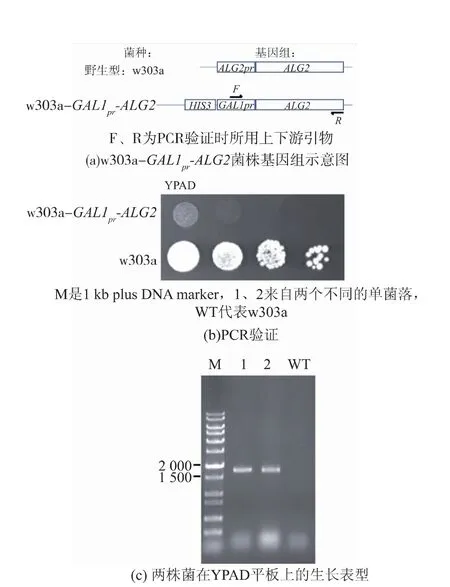
图2 w303a-GAL1pr-ALG2 菌株的构建和验证Fig. 2 Construction and verification of w303a-GAL1pr-ALG2 strain
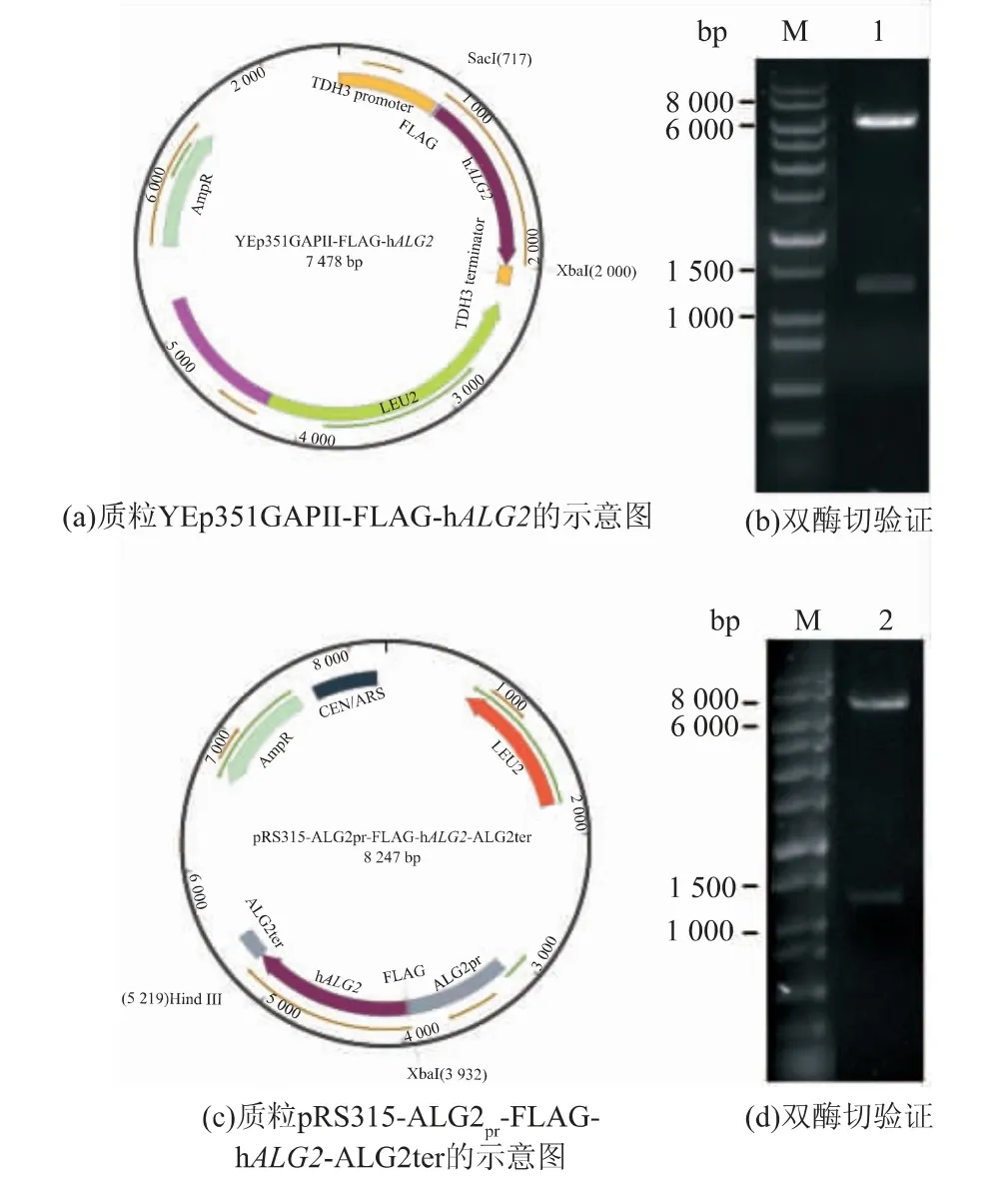
图3 在酵母中表达h ALG2 的质粒构建和验证Fig. 3 Construction and verification of yeast plasmids containing h ALG2

图4 h ALG2 基因在GAL1pr-ALG2 酵母中的回补和表达Fig. 4 Growth recovery and protein expression in GAL1pr-ALG2 strain by h ALG2 gene
2.4 h ALG2 大肠杆菌表达质粒的构建与鉴定
表达质粒pET32a-h ALG2 示意图见图5(a)。经双酶切后电泳验证(图5(b)),显示为两个条带,下端条带大小对应扩增的h ALG2 条带(1 267 bp);上端条带为载体片段,该质粒经过测序验证无碱基突变,说明表达质粒构建成功。
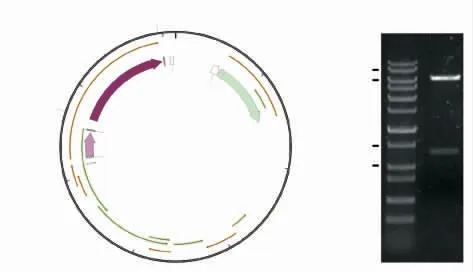
图5 质粒pET32a-h ALG2 的构建和验证Fig. 5 Construction and verification of pET32a-h ALG2
2.5 TrxA-hAlg2 蛋白在大肠杆菌中的表达和纯化
重组菌Rosetta (DE3)/pET32a-h ALG2 在IPTG终浓度为0.1 mmol/L 的含氨苄霉素抗性的TB 培养基中诱导培养20 h。 离心收集菌体,破碎离心纯化上清液蛋白质,将洗脱后的蛋白质进行蛋白质电泳分析。
理论上目的蛋白质TrxA-hAlg2 的相对分子质量为61 400,如图6(a)所示,相比于诱导前,诱导后在50 000~70 000 之间出现一条明显的蛋白质条带,表明TrxA-hAlg2 蛋白在大肠杆菌中成功表达。纯化后可以得到一条清晰的蛋白质条带,与诱导后条带大小相同。 蛋白质免疫印迹也能检测到对应相对分子质量的纯化后蛋白质(见图6(b)),这说明TrxA-hAlg2 蛋白成功从大肠杆菌破碎上清液中纯化得到。 浓缩除盐处理后得质量浓度为2.5 mg/mL的TrxA-hAlg2 蛋白。
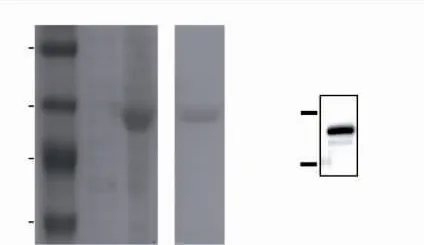
图6 TrxA-h Alg2 蛋白的表达和纯化Fig. 6 Expression and purification of TrxA-h Alg2 protein
2.6 TrxA-hAlg2 蛋白的活性分析
以PPGn2 代替天然底物,GDP-mannose 为供体, 由Alg1NΔTM 催化反应1 h 后,100 ℃下2 min终止反应并灭活Alg1NΔTM。 取一半反应液, 作为TrxA-hAlg2 的反应底物PPGn2M1, 加入纯化后的TrxA-hAlg2 后,继续30 ℃下反应1 h。 最后均向两份反应体系中加入等体积的20 mmol/L HCl,100 ℃下酸解1 h,释放脂肪链上的糖链。 糖链经固相萃取后,进行LC-MS 分析。
对于Alg1NΔTM 的反应, 在UPLC 液相色谱中分别出现8.73、9.03 的峰(见图7(a)),ESI-MS 质谱分析该峰对应的质荷比m/z 为609, 即其反应产物糖链的加钠值[Gn2-M1+Na]+(见图7 (b))。 对于TrxA-hAlg2 的反应,Gn2-M1 对应的峰完全消失,证明底物被TrxA-hAlg2 完全反应; 液相色谱显示在10.57、10.78 和12.25、12.45 有两组峰 (图7(a)),ESI-MS 质谱分析两组峰对应的质荷比m/z 分别为771 和933, 对应其反应产物糖链的加钠值[Gn2-M2+Na]+和[Gn2-M3+Na]+(图7(b))。这些结果说明,在大肠杆菌中表达纯化的TrxA-hAlg2 蛋白同样具有α-1,3/1,6 甘露糖转移酶活性, 即向PPGn2M1上添加两个甘露糖形成PPGn2M3。
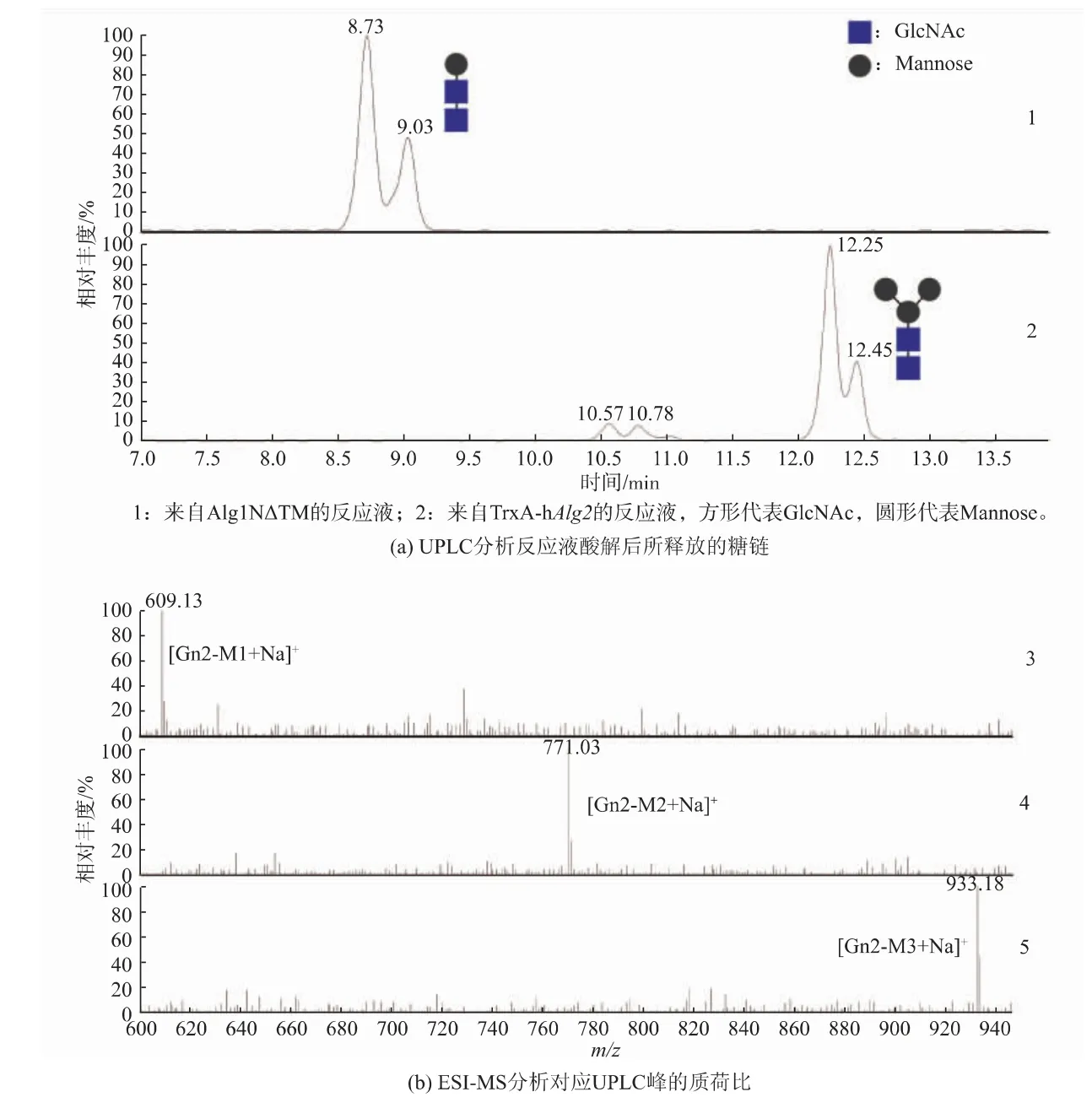
图7 TrxA-hAlg2 蛋白的活性测定Fig. 7 Activity assay of TrxA-hAlg2 protein
3 结 语
通过分析发现,人源Alg2 蛋白的84~104 位氨基酸是潜在的惟一膜结合区域,且疏水性较小。 尽管这和酿酒酵母ScAlg2 蛋白的膜拓扑结构完全不同, 但在酿酒酵母中过表达h ALG2 基因时,hAlg2蛋白能稳定表达, 且能够回补Sc ALG2 基因缺失时细胞的生长缺陷。 hAlg2 蛋白在酵母细胞体内的功能同源性和低疏水性的膜蛋白性质,为其在大肠杆菌中的表达纯化和后续活性测定提供理论依据。 作者在大肠杆菌中表达了hAlg2 并对其进行了纯化,相比动物细胞表达体系,成本较低。 在体外活性实验中, 结合LC-MS 技术, 证实hAlg2 具有催化PPGn2M1 形成中间体PPGn2M2 和终产物PPGn2M3的甘露糖基转移酶功能。 对N-糖基化途径中人源的甘露糖基转移酶hAlg2 的外源表达和体外活性进行的研究,为将来进一步探索Alg2 的酶学性质和晶体结构解析奠定了基础。 此外,利用大肠杆菌表达系统提纯的hAlg2, 也为研究ALG2-CDG 病人相关突变体的体外活性提供了更加直接、方便、快捷的方法。

