蓝舌病病毒、流行性出血病病毒和帕利亚姆血清群病毒三重RT-qPCR检测方法的建立及应用
杨振兴,李占鸿,肖 雷,谢佳芮,廖德芳,李卓然,李华春,朱建波,杨 恒
(云南省畜牧兽医科学院/云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224)
蓝舌病病毒 (Bluetongue virus,BTV)、流行性出血病病毒 (Epizootic hemorrhagic disease virus,EHDV)和帕利亚姆血清群病毒(Palyam serogroup virus,PALV)均为通过库蠓Culicoides传播的呼肠孤病毒科Reoviridae环状病毒属Orbivirus成员,广泛分布于热带、亚热带与温带地区,牛是3种病毒的重要宿主[1-3]。BTV、EHDV和PALV在全球引起的动物疫病的暴发和流行给牛羊养殖业造成了严重经济损失,导致牛羊进出口贸易受限,影响了国际畜产品正常贸易。据估计,2009年全球畜牧业仅因BTV引发蓝舌病而导致的经济损失就高达30亿美元[4];近年来EHDV在中东多国特别是在阿尔及利亚、突尼斯、摩洛哥和以色列等国家的牛群中多次引发流行性出血病的暴发,严重影响了当地畜牧业的健康发展[5];PALV感染妊娠期母牛能引起新生犊牛积水性无脑和小脑发育不全,曾在日本和韩国暴发,给两国的肉牛养殖业造成了严重的经济损失[6]。目前,蓝舌病和流行性出血病已经被世界动物卫生组织 (Office international des epizooties,OIE)列为法定报告的跨境动物疫病。
BTV、EHDV和PALV血清型众多,目前世界范围内已发现27种BTV血清型[7]、9种EHDV血清型[8]和10种PALV血清型[9]。2013年在公益性行业(农业)科研专项的资助下,在全国范围内开展了虫媒病毒的流行病学调查,发现我国主要流行12 种 BTV 血清型 (BTV-1、-2、-3、-4、-5、-7、-9、-12、-15、-16、-21 和-24)[10],5 种 EHDV 血清型(EHDV-1、-5、-6、-7 和-10)[11]和 3 种 PALV 血清型[Chuzan disease virus (CHUV)、D’Aguilar virus(DAV)与 Bunyip Creek virus (BCV)][12]等,表明流行于我国的BTV、EHDV和PALV血清型具有丰富多样性。对3种病毒的血清学调查发现,我国至少12个省区的牛羊群中同时存在BTV、EHDV和PALV抗体阳性,且阳性率由北向南逐渐升高,特别是在南方地区,如云南、广西和广东等地的牛群中,3种病毒的血清抗体阳性率均高于30%;说明BTV、EHDV和PALV在我国已经广泛存在,严重威胁我国畜牧产业的健康发展[13-15]。
快速诊断病原是动物疫病防控的重要一环,BTV、EHDV和PALV不仅具有共同的传播媒介与易感动物,在流行区域上也存在重叠;因此,建立一种能同时诊断这3种病原的检测方法具有重要的应用价值。多重RT-qPCR可在1个反应管中同时检测多种目的基因,克服了普通荧光PCR只能检测单一基因的缺点,具有特异性强、敏感性高和短时间内检测多种病原的优点,被广泛应用于动物传染病的诊断[16]。本研究旨在运用TaqMan探针技术建立一种三重RT-qPCR方法,提高病毒检出率,简化操作流程,降低检测成本,为临床快速鉴别检测BTV、EHDV和PALV提供有效的技术手段。
1 材料与方法
1.1 毒株、血液和核酸样品
24个BTV血清型(BTV-1~BTV-24)南非参考毒株由OIE南非蓝舌病参考实验室(Onderste-poort Veterinary Institute)提供,6个 EHDV 血清型(EHDV-1、-2、-5、-6、-7、-8)参考毒株由澳大利亚麦克阿瑟·伊丽莎白农业研究所(Elizabeth Macarthur Agricultural Institute,EMAI)提供,中国分离的12种BTV血清型、5种EHDV血清型和3种PALV血清型代表毒株信息见表1。阿卡斑病毒(Akabane virus, AKAV)核酸由云南省畜牧兽医科学院热带亚热带动物病毒病重点实验室保存,小反刍兽疫病毒(Peste des petits ruminants virus, PPRV)核酸由中国农业科学院哈尔滨兽医研究所惠赠,口蹄疫病毒(Foot-and-mouth disease virus, FMDV)、牛流行热病毒 (Bovine ephemeral fever virus, BEFV)核酸由中国农业科学院兰州兽医研究所惠赠。BTV Seg-10、EHDV Seg-5和PALV Seg-7基因节段重组质粒pLB-BTV-NS3-T7、pLB-EHDV-NS1-T7和 pLBCHUV-VP7-T7由云南省畜牧兽医科学院热带亚热带动物病毒病重点实验室前期制备并保存。

表 1 中国分离的不同蓝舌病病毒、流行性出血病病毒和帕利亚姆血清群病毒血清型代表毒株信息Table 1 Representative strains of different serotypes of bluetongue virus, epizootic hemorrhagic disease virus and Palyam serogroup virus isolated in China
1.2 主要试剂与仪器
病毒 RNA 抽提试剂盒 MagMAX-96 Viral RNA Isolation Kit购自Thermo公司,DNA胶回收试剂盒、荧光定量PCR试剂盒购自宝生物工程(大连)有限公司,T7启动子RNA体外转录试剂盒购自Promega公司,RNA纯化试剂盒、质粒DNA提取试剂盒、pLB平末端克隆载体购自天根生化科技有限公司,7500实时荧光定量PCR系统购自ABI公司。
1.3 引物和探针的设计与合成
从NCBI检索并下载BTV、EHDV、PALV病毒的全基因组序列,并根据云南省畜牧兽医科学院热带亚热带动物病毒病重点实验室分离的3种病毒的全基因组序列,利用MEGA-X进行序列对比分析,确定并选择 BTVNS3、EHDVNS1和 PALVVP7基因保守区序列,利用 Primer Express 6.0 软件设计相应的特异性引物,分别用FAM、VIC和TAMRA荧光基团标记TaqMan探针,使用BHQ1作为淬灭基团(表2)。引物和探针均由宝生物工程(大连)有限公司合成,并用 RNase-free 水稀释至 20 μmol/L。

表 2 蓝舌病病毒、流行性出血病病毒和帕利亚姆血清群病毒三重RT-qPCR的引物与探针Table 2 Primers and probes used for detecting bluetongue virus, epizootic hemorrhagic disease virus and Palyam serogroup virus by triplex RT-qPCR
1.4 标准品的制备
提取 pLB-BTV-NS3-T7、pLB-EHDV-NS1-T7和pLB-CHUV-VP7-T7基因序列重组质粒,使用XbaⅠ内切酶进行质粒的酶切线性化。取1 μg纯化后的DNA作为模板,使用T7体外转录试剂盒进行 BTV Seg-10 (822 bp)、EHDV Seg-5 (533 bp)和PALV Seg-7 (950 bp) ssRNA 的体外转录,反应体系为:DNA 模板 5 μL、RiboMAXTMExpress T7 2×Buffer 10 μL、T7 Express Enzyme Mix 2 μL,加入RNase-free 水补齐至 20 μL;37 ℃ 反应 30 min。使用RNA纯化试剂盒纯化转录产物,Nanodrop ND-2000测定核酸浓度后,根据相对分子质量计算纯化后ssRNA的拷贝数。
1.5 三重RT-qPCR反应条件的优化
以体外转录的 BTV Seg-10、EHDV Seg-5 和PALV Seg-7的ssRNA为模板,采用方阵法分别对三重 RT-qPCR 方法的引物浓度 (0.1~0.5 μmol·L−1)、探针浓度 (0.1~0.8 μmol·L−1)、退火温度 (50~60 ℃)和模板体积(2~8 μL)进行筛选,确定最佳反应条件。
1.6 特异性试验
以制备好的 BTV Seg-10、EHDV Seg-5 和PALV Seg-7的ssRNA模板作为阳性对照,与AKAV、PPRV、FMDV和BEFV核酸一同进行三重RT-qPCR检测,设立阴性牛羊血液总RNA及DEPC水分别作为阴性和空白对照,重复3次。
1.7 敏感性试验和标准曲线的绘制
分别将3种病毒的体外转录ssRNA以10倍梯度稀释获得拷贝数为1×1010~1×10−1μL−1的 12 个梯度,分别以阴性牛羊血液总RNA及DEPC水作为阴性和空白对照。所有样品及对照均设2个复孔,同时进行单重和三重RT-qPCR检测,并以RNA浓度的对数值为横坐标、三重RT-qPCR结果Ct值为纵坐标绘制标准曲线。
1.8 重复性试验
以BTV、EHDV和PALV体外转录的ssRNA的 3 个稀释度 (拷贝数分别为1×103、1×105和 1×107μL−1)为模板,每个稀释度各取 10 份样本分别在不同的时间重复检测3次,同时设立阴性牛羊血液总RNA及DEPC水分别作为阴性和空白对照,并通过计算Ct值的标准差和变异系数,验证三重RT-qPCR的批内和批间重复性。
1.9 混合病毒核酸样品的检测试验
将 BTV、EHDV 和 PALV 3种病毒高、中、低浓度 (拷贝数分别为1×106、1×104和 1×102μL−1)的ssRNA分别按体积比1∶1混合,同时进行单重和三重RT-qPCR检测,并设立阴性牛羊血液总RNA及DEPC水分别作为阴性和空白对照。在3种病毒核酸混合的情况下分析高浓度的核酸模板是否会影响三重RT-qPCR对低浓度核酸模板的检测结果。
1.10 毒株与临床血液样本的检测
提取2012—2016年在我国分离的BTV、EHDV和PALV不同血清型毒株及已分离毒株对应的阳性血液样本核酸,与24个BTV血清型及6个EHDV血清型参考毒株的核酸同时进行单重和三重RT-qPCR检测。比较试验结果,分析和评价该方法的临床实用性。
2 结果与分析
2.1 标准品的制备
以构建好的3种重组质粒为模板进行体外转录,获得 BTV Seg-10 (822 bp)、EHDV Seg-5 (533 bp)和 PALV Seg-7 (950 bp)的 ssRNA,经纯化后测定质量浓度分别为656.5、408.6 和 785.7 ng·μL−1,计算获得拷贝数分别为1.41×1012、1.36×1012和 1.46×1012μL−1。将获得的 ssRNA 样品作为三重 RT-qPCR灵敏性评价的标准品。
2.2 三重RT-qPCR方法的建立与优化
通过引物和探针浓度的不同配比试验及反应条件的优化试验,最终确定反应体系。总反应体积为20 μL,其中 2× One Step RT-PCR Buffer Ⅲ 10 μL,ExTaqHS (5 U·μL−1) 0.4 μL,PrimeScript RT Enzyme Mix Ⅱ 0.4 μL,Rox Reference Dye Ⅱ (50×)0.4 μL,BTV 上、下游引物各 0.2 μL 及探针 0.4 μL,EHDV 的上、下游引物各 0.3 μL 及探针 0.6 μL,PALV 上、下游引物各 0.2 μL 及探针 0.4 μL,变性模板RNA 4 μL,双蒸水补充至 20 μL。反应条件:42 ℃5 min;92 ℃ 10 s;92 ℃ 5 s,60 ℃ 34 s,40 个循环。
2.3 特异性试验
将3种病毒体外转录ssRNA作为阳性对照,同时对AKAV、PPRV、FMDV和BEFV的核酸及阴性对照进行三重RT-qPCR检测。结果(图1)显示,本研究建立的三重RT-qPCR具有高度特异性,仅与对应的BTV、EHDV和PALV核酸产生扩增曲线,其他病原(AKAV、PPRV、FMDV、BEFV)和阴性对照均无扩增曲线,判定为阴性。

图 1 三重RT-qPCR特异性试验Fig.1 Specificity test of triplex RT-qPCR
2.4 敏感性试验和标准曲线的绘制
以拷贝数为1×1010~1×10−1μL−1的 12 个梯度ssRNA作为模板,根据已优化的条件同时进行三重和单重RT-qPCR反应。结果显示,所有阴性对照及空白对照均无阳性扩增(图2a、2b、2c);在核酸拷贝数为1×1010~1×101μL−1的范围内,标准曲线均具有良好的线性,相关系数(R)均在0.998以上,引物扩增效率 (E)为91.99%~103.42%(图 2d、2e、2f)。各浓度体外转录ssRNA单重与三重RT-qPCR检测的Ct均值(表3)表明本研究建立的三重 RT-qPCR最低可检测到拷贝数为1×101μL−1的 BTV、EHDV 和PALV核酸,与单重检测结果一致。

图 2 蓝舌病病毒、流行性出血病病毒和帕利亚姆血清群病毒体外转录ssRNA对三重RT-qPCR灵敏性评价Fig.2 Sensitivity evaluation of bluetongue virus, epizootic hemorrhagic disease virus and Palyam serogroup virus in vitro transcribed ssRNA to triplex RT-qPCR

表 3 单重和三重RT-qPCR方法Ct值比较1)Table 3 Ct value comparison between monoplex and triplex RT-qPCR
2.5 混合病毒核酸样品的检测
将BTV、EHDV和PALV 3种病毒的ssRNA分别按高、中、低3个浓度等体积混合,同时进行单重和三重RT-qPCR检测。结果(表4)显示,一种病毒核酸模板浓度较高(拷贝数为106μL−1)而另一种病毒核酸模板浓度较低 (拷贝数为102μL−1)时,三重RT-qPCR依然可以同时检测到3种病毒,并且与单重RT-qPCR结果无明显差异。

表 4 混合病毒核酸样品单重和三重RT-qPCR检测结果Table 4 Results of mixed virus nucleic acid samples detected by monoplex and triplex RT-qPCR
2.6 重复性试验
以高、中、低3个稀释度的BTV、EHDV和PALV的ssRNA作为模板,分3个批次进行检测,每批次每个稀释度各10份样本,通过计算批内、批间变异系数评价多重体系的稳定性。结果(表5)显示,BTV、EHDV和PALV病毒核酸高中低3个浓度所对应的批内和批间Ct值的标准差均在0.5以内,变异系数均在2%以下,可见三重体系对于3种病毒核酸的检测均具有良好的稳定性。

表 5 三重RT-qPCR重复性试验中Ct值与变异系数Table 5 Means and coefficients of variation in repeatability tests of triplex RT-qPCR
2.7 毒株与临床血液样本的检测
对2012—2016年在我国分离的BTV、EHDV和PALV不同血清型毒株及分离出病毒的阳性血液样本和BTV、EHDV参考毒株核酸同时进行单重和三重RT-qPCR检测。结果(表6和表7)显示,本研究建立的三重RT-qPCR方法对参考毒株和在我国分离培养的毒株核酸检测Ct值为14.67~27.62,对血液样本检测Ct值为27.69~35.24;单重RT-qPCR检测病毒毒株Ct值为15.08~26.04,对血液样品检测Ct值为28.03~34.67。对2种方法的检测结果进行单因素方差分析,P>0.05,无显著差异。本研究建立的三重RT-qPCR方法可准确检测出国内外BTV、EHDV和PALV不同血清型毒株及临床血液样本中对应的不同血清型病毒核酸,具有较好的群特异性,与单重检测结果无明显差异。
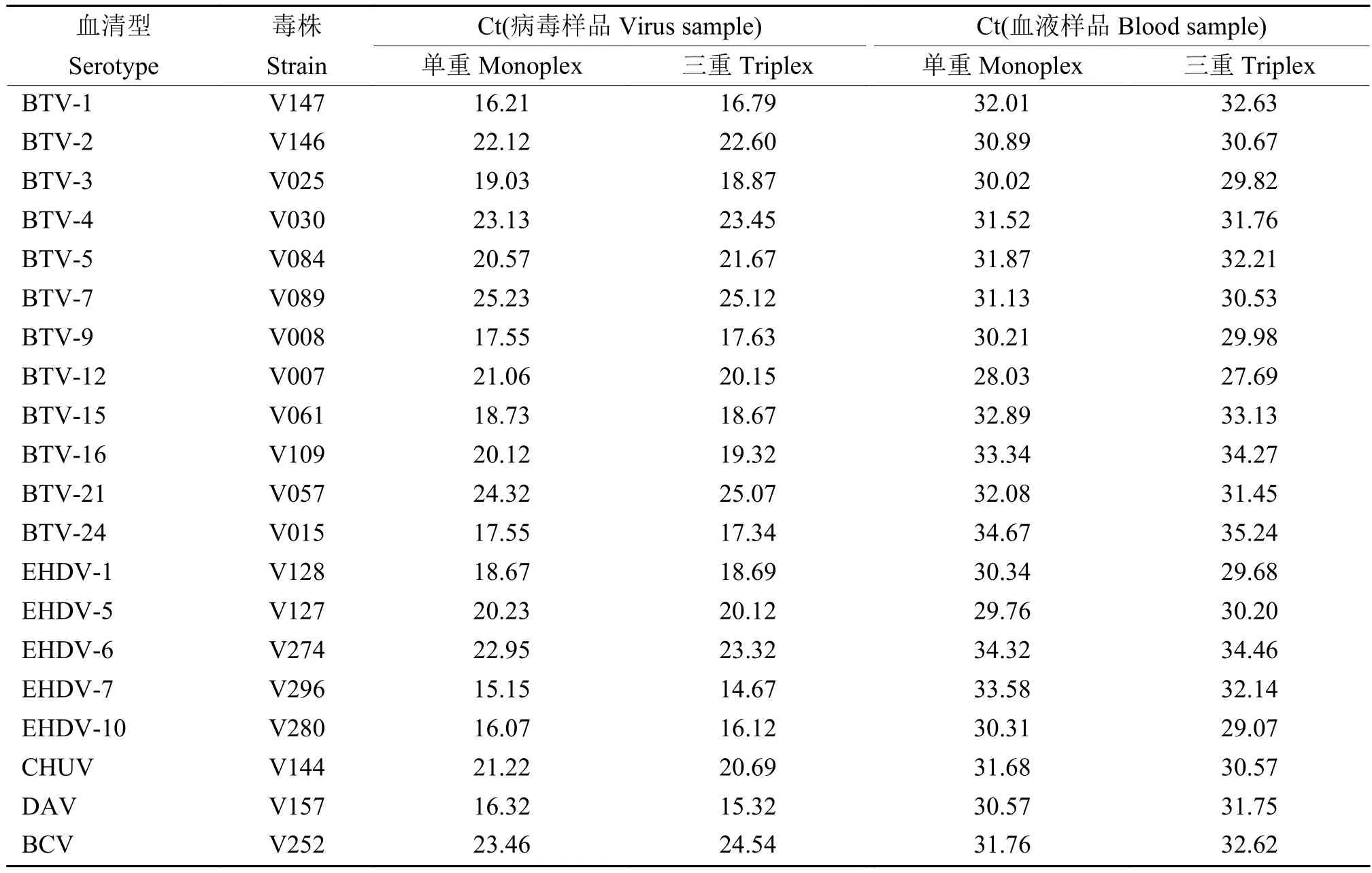
表 6 单重和三重RT-qPCR检测中国分离的蓝舌病病毒、流行性出血病病毒和帕利亚姆血清群病毒毒株及对应阳性血液样本的验证试验Table 6 Demonstration tests of bluetongue virus, epizootic hemorrhagic disease and Palyam serogroup virus strains isolated in China and corresponding blood samples by monoplex and triplex RT-qPCR

表 7 单重和三重RT-qPCR检测蓝舌病病毒和流行性出血病病毒参考毒株的验证试验Table 7 Demonstration test of reference strains of bluetongue virus and epizootic hemorrhagic disease virus by monoplex and triplex RT-qPCR
3 讨论与结论
作为虫媒病毒的BTV、EHDV和PALV血清型多样,传播途径相同,流行地域重叠,并且在动物感染早期存在部分相似的临床症状。国外研究曾报道3种病毒交叉感染的情况[17]。2013—2016年在公益性行业(农业)科研专项的资助下,云南省畜牧兽医科学院热带亚热带动物病毒病重点实验室在我国多个虫媒病毒监控点的不同哨兵牛上同时分离出了BTV、EHDV和PALV,对这3种病原的早期诊断是一项重大挑战,往往仅能检测出其中1种病毒核酸阳性忽略另外2种病毒,增加病毒检测的漏检率,不利于动物疫病的防控。基于此,本试验在原有RT-qPCR对虫媒病毒的检测基础上,建立了针对BTV、EHDV和PALV的三重RT-qPCR检测方法。
多重RT-qPCR方法易受引物、试剂和反应条件等诸多因素影响[18]。因此本研究首先根据BTVNS3、EHDVNS1和 PALVVP7基因的高度保守性和较好群特异性等特点[19-21],选择作为引物和探针设计的靶基因,同时适当引入简并碱基,并进行BLAST序列对比分析确保引物和探针的保守性和特异性。随后对反应体系的退火温度,模板体积、引物和探针浓度进行了一系列优化,确定了最优反应条件,将复合扩增中引物间、模板间和引物与模板间可能存的竞争抑制和相互干扰降到最低,从而实现从单种病毒检测到同时进行3种病毒的检测,节省样品用量、试验资源和操作时间。
本研究利用BTV、EHDV和PALV的体外转录ssRNA对三重RT-qPCR灵敏度进行测试并绘制标准曲线,结果显示,三重反应对病毒体外转录ssRNA拷贝数最低检测限在10 μL−1级别,与单重反应相比,灵敏度无明显差异。龚雪蕊等[22]建立的寨卡病毒、登革病毒和基孔肯雅病毒三重RT-PCR检测方法的最低拷贝数检出限为10 μL−1,Nunes等[23]报道的用于南美洲汉坦4种流行病毒的RT-qPCR 检测方法的拷贝数灵敏度为10 μL−1,二者均与本研究相近。本研究构建的标准曲线的相关系数均大于等于0.998,扩增效率基本相同且均大于90%,符合RT-qPCR扩增效率在90%~110%的合理范围。
前期调查发现,BTV、EHDV和PALV在临床上出现混合感染时,3种病毒在动物血液中的载量会存在较大差异;因此,本试验将3种病毒不同浓度的核酸模板进行混合,分析高浓度核酸模板是否对低浓度核酸模板存在干扰。结果显示,一种病毒核酸模板浓度较高而另一种病毒模板浓度较低时,所建立的三重RT-qPCR方法依然可以同时检测到3种病毒,并且与单重法的结果无明显差异,表明高浓度模板对低浓度模板的扩增检测干扰不明显。重复性试验中,对3种病毒高、中、低3个浓度的模板ssRNA进行检测,变异系数均小于2%,表明本研究建立的三重RT-qPCR检测方法具有较好的稳定性和重复性,有良好的检测效果。
2017年刘佳佳等[24]建立了BTV和EHDV双重RT-qPCR检测方法,但仅进行了1种BTV和EHDV血清型的特异性验证。本研究以单重RT-qPCR检测方法作为参照,使用建立的三重RT-qPCR同时对不同BTV和EHDV血清型参考毒株和我国主要流行的不同BTV、EHDV和PALV血清型毒株及其阳性血液样品进行检测。结果显示,本研究建立的三重RT-qPCR方法具有较好的群特异性,可以检测出不同血清型的参考毒株和在我国主要流行的毒株及其血液样品中对应病毒的核酸,与单重法的检检测结果无明显差异。
综上所述,本研究将在我国已经存在、主要流行于南方热带亚热带地区的3种虫媒病毒作为一个组合,首次建立了一套三重RT-qPCR检测方法,填补了同时检测BTV、EHDV和PALV 3种病毒核酸方法的空缺。该方法可应用于疫区或出入境动物带毒状况监测,对早期临床疫病鉴定和防疫指导具有参考价值。此外,多重RT-qPCR检测方法试验步骤简化、样本用量少、试验成本低,可为疫情防控争取宝贵时间。

