过氧化氢建立的高氧环境对幽门螺杆菌清除作用的研究*
狄 佳 张 军 屈 伟 程 妍 常丹燕 郑向红&
西安交通大学第二附属医院核医学科1(710004) 消化内科2
背景:随着幽门螺杆菌(Hp)对抗菌药物耐药性和感染复发率的上升,高效清除Hp的难度日益增大。目的:探讨过氧化氢(H2O2)建立的高氧环境对Hp的清除作用及其可能机制。方法:使用溶解氧测定仪测定体内外条件下的H2O2溶液氧含量。以H2O2处理Hp标准菌株和野生型菌株;建立蒙古沙鼠Hp感染模型并予H2O2干预。紫外分光光度计检测Hp生长情况;常量肉汤稀释法测定最低抑菌浓度(MIC)和最低杀菌浓度(MBC);Giemsa染色观察胃黏膜Hp定植情况;透射电子显微镜和正苯基萘胺法观察Hp细胞膜形态学及其渗透性变化。结果:水溶液和家兔胃液中添加H2O2后,溶液氧含量显著升高(P均<0.05)。Hp在含H2O2液体培养基中的生长水平随H2O2浓度升高而逐渐降低,直至完全不生长。蒙古沙鼠经H2O2溶液灌胃14 d,胃黏膜定植的Hp数量接近于零。H2O2可诱导Hp细胞膜损伤、破裂,胞质溢出,细胞膜渗透性显著增高(P<0.05)。结论:H2O2能有效提高水溶液中的氧含量,在体内外条件下均能对Hp发挥高效清除作用,其机制与菌体细胞膜损伤密切相关。
幽门螺杆菌(Helicobacterpylori, Hp)是一种革兰阴性微需氧弯曲棒状杆菌,已被证实是慢性胃炎、消化性溃疡和胃黏膜相关淋巴样组织淋巴瘤的主要致病因子,并与胃癌发生密切相关[1-2]。目前全世界大部分国家和地区的人群存在不同程度的Hp感染,总体感染率超过50%(约44亿)[3]。抗菌药物的应用是根除Hp感染的主要手段,但近年来随着Hp对抗菌药物耐药性的显著增加,根除成功率急剧下降,感染复发率迅速上升[4-5]。因此,寻求能高效清除Hp的新方法对于提高Hp感染的临床治疗水平以及预防胃癌等Hp相关疾病的发生具有重要意义。
作为一种专性微需氧菌,Hp对生长条件要求苛刻,其生长环境最适宜的氧含量约为5%~6%[6]。氧含量过高如大气环境,或过低如厌氧环境,均易导致Hp死亡。由此,本课题组根据Hp的微需氧特性提出了一种通过建立高氧环境以清除Hp的全新思路:利用过氧化氢(H2O2)分解释放氧气来提高环境中的氧含量,以实现对Hp赖以生存的微需氧环境的有效破坏,从而促进Hp死亡,最终达到高效除菌的目的。本研究旨在探讨H2O2是否能有效提高溶液中的氧含量,验证H2O2在体内外条件下对Hp的清除作用,并进一步探索除菌过程中Hp死亡的可能机制。
材料与方法
一、Hp菌株、实验动物、主要试剂和仪器
Hp国际标准菌株ATCC43504(美国模式菌种收集中心);Hp野生型菌株Ⅰ、Ⅱ、Ⅲ分离自就诊于西安交通大学第二附属医院内镜中心、诊断为消化性溃疡且13C-尿素呼气试验结果阳性患者的胃黏膜组织(伦理审批号:2016-1033)。
家兔由西安交通大学医学部实验动物中心提供,许可证号:SCXK(陕)2014-003;蒙古沙鼠由浙江省医学科学院实验动物中心提供,许可证号:SCXK(浙)2014-0001。
30% H2O2(广州金华大化学试剂有限公司);Hp专用液体培养基(青岛海博生物技术有限公司);哥伦比亚绵羊血琼脂培养基(Thermo Fisher Scientific);枸椽酸铋钾片/替硝唑片/克拉霉素片三联药物(丽珠维三联®,丽珠集团丽珠制药厂);Giemsa染液(上海远慕生物科技有限公司);阿莫西林胶囊(金石宁®,国药集团汕头金石制药有限公司);正苯基萘胺(大连美仑生物技术有限公司);Triton X-100(合肥博美生物科技有限责任公司)。
溶解氧测定仪(WTW, Xylem Analytics Germany Sales GmbH & Co. KG.);紫外分光光度计(上海美谱达仪器有限公司);普通光学显微镜(Olympus);透射电子显微镜(Hitachi);荧光酶标仪(Molecular Devices, LLC.)。
二、方法
1. 体外水溶液和家兔胃液氧含量测定
①体外水溶液氧含量测定:将30%H2O2与蒸馏水混合,分别配制成0.02、0.09、0.40、2.00 mg/mL H2O2溶液,以蒸馏水作为空白对照,溶解氧测定仪测定各组H2O2溶液氧含量。
②家兔胃液氧含量测定:将8只家兔随机分为2组,每组4只。禁食24 h,麻醉后沿胃幽门处作一切口,插入溶解氧测定仪探针,使用缝合线将探针扎紧于胃幽门切口,另将十二指肠端扎紧。测定给药前(0~10 min)胃液氧含量后,两组分别吸取 0.5、1.0 mg/mL H2O230 mL注入胃内,再次测定胃液氧含量。
2. Hp培养及其生长情况检测:以Hp国际标准菌株ATCC43504为例,吸取1×108CFU/mL Hp菌液200 μL,以体积比1∶100分别加入含0.8、1.0、1.2 mg/mL H2O2的Hp专用液体培养基,同时设立空白对照组,置于37 ℃恒温震荡培养箱内,150 r/min微需氧环境下培养5 d,紫外分光光度计每日检测液体培养基A600 nm。实验重复3次。
3. 最低抑菌浓度(minimum inhibitory concen-tration, MIC)和最低杀菌浓度(minimum bactericidal concentration, MBC)测定:MIC系指经体外培养18~24 h后抑制细菌生长的最低药物浓度,是测定抗菌药物活性的重要指标[7],MBC则是指杀死99.9%的细菌所需的最低药物浓度[8]。本研究采用常量肉汤稀释法测定MIC和MBC[9]。在1×108CFU/mL的Hp菌液中以体积比1∶100分别加入含倍数浓度H2O2的Hp专用液体培养基,37 ℃震荡培养24 h,观察液体培养基浑浊度。选取培养基清澈透明无细菌生长的最低H2O2浓度作为MIC。吸取上述清澈透明液体培养基100 μL,分别接种于哥伦比亚绵羊血琼脂平板,微需氧条件下培养3 d,选取无菌落生长的最低H2O2浓度作为MBC。实验重复5次。
4. 蒙古沙鼠Hp感染模型建立和干预:将60只蒙古沙鼠随机分为6组,每组10只:空白对照组、Hp组、1、2、4 mg/mL H2O2组和三联药物组。后 5组禁食4 h后予1×108CFU/mL ATCC43504菌液15 mL/kg灌胃,每日1次,连续20 d。Hp感染模型成功建立后,三组H2O2组分别予1、2、4 mg/mL H2O2水溶液15 mL/kg灌胃,三联药物组予三联药物混悬液(枸橼酸铋钾25 mg/L,替硝唑2 mg/L,克拉霉素1 mg/L) 15 mL/kg灌胃,Hp组予蒸馏水15 mL/kg灌胃,均为每日1次,连续14 d。
5. 蒙古沙鼠胃黏膜Hp计数:蒙古沙鼠麻醉后处死,剪取大小约2 cm2的腺胃部分胃黏膜,4%多聚甲醛溶液固定,石蜡包埋、切片,Giemsa染色观察胃黏膜完整性和Hp分布。于光学显微镜高倍视野(×1 000)下随机选取5个视野计数Hp,每视野以1个点表示。每只实验动物制作1张切片,每组共计50个点。
6. Hp细胞膜形态学观察:使用透射电子显微镜观察 H2O2(2 mg/mL)处理前后 ATCC43504菌株细胞膜超微结构变化,以阿莫西林(0.04 mg/mL)处理作为阳性对照,蒸馏水处理作为空白对照。各组Hp给药后孵育20 min,离心获取1 mm3菌体沉淀,2.5%戊二醛前固定、1%锇酸后固定,PBS冲洗后浓度梯度丙酮脱水(30%、50%、70%、80%、90%、100%),无水丙酮/环氧树脂以5∶1、3∶1、1∶3、1∶5比例包埋,切片后柠檬酸铅-乙酸铀双染色,干燥后置于透射电子显微镜下观察。
7. 正苯基萘胺法测定Hp细胞膜渗透性:制备1×108CFU/mL ATCC43504菌液,随机分为空白对照组、0.25、0.5、1.0、2.0 mg/mL H2O2组和Triton X-100组(阳性对照),并予相应处理。吸取300 μL菌液,加入6 μL正苯基萘胺溶液(500 μmol/L),混匀后加入黑色避光96孔板,每孔100 μL;在激发波长315 nm和发射波长400 nm条件下,以荧光酶标仪测定每孔相对荧光强度。实验重复3次。
三、统计学分析
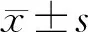
结 果
一、H2O2对水溶液和家兔胃液氧含量的影响
空白对照组水溶液在37 ℃正常大气条件下的氧含量为(6.72±0.56) μg/mL,与El-Sherif等[10]的报道(6.7~6.8 μg/mL)相一致。与空白对照组相比,0.02、0.09、0.40、2.00 mg/mL H2O2组水溶液氧含量明显升高,差异均有统计学意义(P均<0.05),各组平均氧含量分别为空白对照组的1.17、1.36、2.22和3.97倍(图1A)。
给药前(0~10 min)家兔正常胃液氧含量为(3.65±0.48)μg/mL;注入H2O2溶液后(10~30 min),0.5、1.0 mg/mL H2O2组胃液氧含量明显升高,差异均有统计学意义(P均<0.05),两组平均氧含量分别为正常胃液的4.17和5.15倍(图1B)。
二、体外培养条件下H2O2对Hp的清除作用
Hp国际标准菌株ATCC43504的生长曲线呈对数形态。培养5 d后,0.8、1.0 mg/mL H2O2组A600 nm与空白对照组相比差异均无统计学意义(P均> 0.05),1.2 mg/mL H2O2组A600 nm则较空白对照组明显降低,差异有统计学意义(P<0.05;图2A)。3株Hp野生型菌株Ⅰ、Ⅱ、Ⅲ培养5 d后A600 nm变化趋势与ATCC43504相似(图2B-2D)。
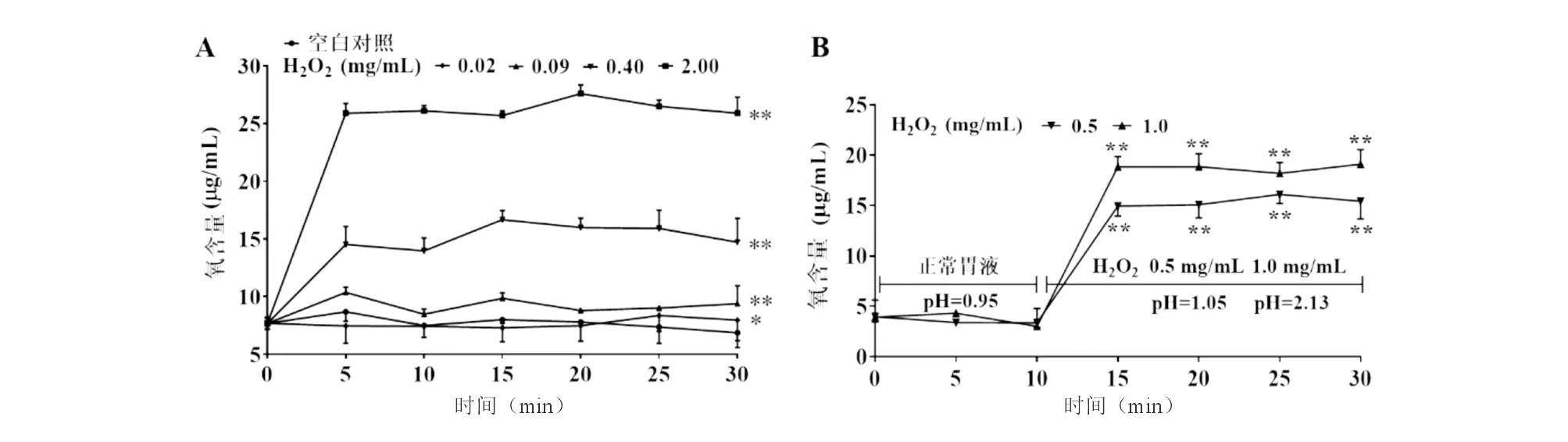
与空白对照组(A)或0~10 min正常胃液(B)比较,*P<0.05,**P<0.01

与空白对照组比较,*P<0.05,**P<0.01
H2O2对ATCC43504和野生型菌株Ⅰ、Ⅱ、Ⅲ的MIC分别为(1.75±0.35)、(0.65±0.15)、(1.10±0.50)、(0.95±0.45) mg/mL,MBC分别为(2.10±0.70)、(1.55±0.85)、(2.05±1.15)、(2.30±0.90) mg/mL。
三、H2O2对动物体内Hp的清除作用
各组蒙古沙鼠胃黏膜组织Giemsa染色显示,Hp组细菌数量较空白对照组明显升高,差异有统计学意义(P<0.05),表明Hp感染模型建立成功。1、2、4 mg/mL H2O2组与空白对照组相比,Hp数量未见明显增加(P均>0.05),表明H2O2能有效清除Hp;三联药物组Hp数量则较空白对照组明显增加,差异有统计学意义(P<0.05),表明清除效果不理想(图3)。
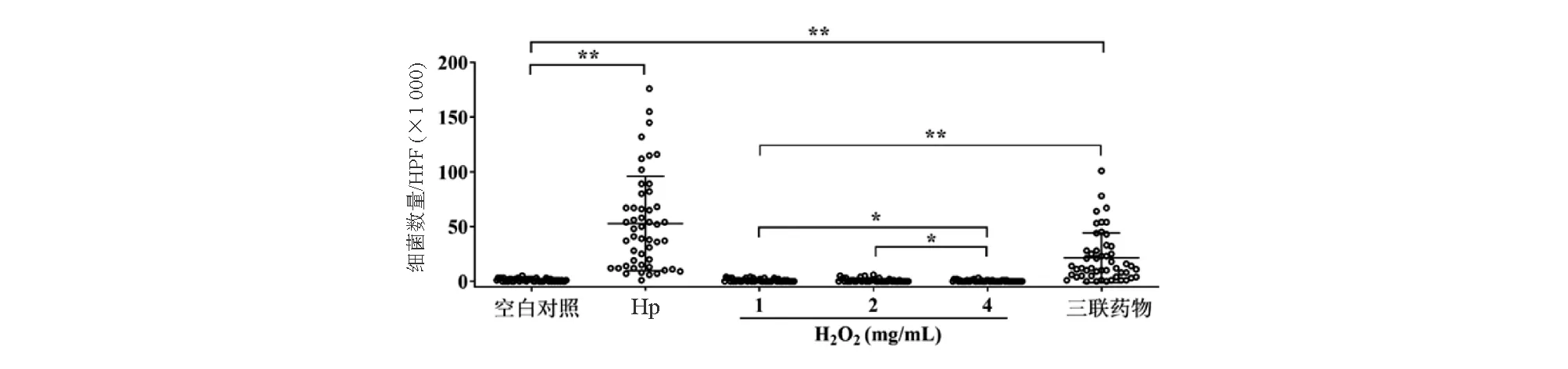
两组间比较,*P<0.05,**P<0.01
四、H2O2对Hp细胞膜的作用
透射电子显微镜观察显示,空白对照组Hp菌体细胞膜完整且透明,胞质均匀分布;H2O2组菌体细胞膜损伤、破裂、模糊不清,胞质溢出;阿莫西林组作为阳性对照,仅菌体细胞壁出现变形损伤,细胞膜完整(图4)。

阿莫西林仅破坏Hp细胞壁,细胞膜完整(黑色箭头示菌体细胞膜;比例尺:300 nm)
正苯基萘胺法细胞膜渗透性检测显示,0.5、1.0、2.0 mg/mL H2O2组相对荧光强度依次增高,且均明显高于空白对照组,除0.25 mg/mL组外,差异均有统计学意义(P均<0.05);Triton X-100组作为阳性对照,相对荧光强度明显高于空白对照组,差异有统计学意义(P<0.05;图5)。上述发现表明,Hp细胞膜渗透性随H2O2浓度增加而逐渐增高。

与空白对照组比较,*P<0.05,**P<0.01
讨 论
Hp作为一种典型的微需氧革兰阴性杆菌,主要定植于人和动物的胃窦黏膜上皮表面和黏液底层。目前,质子泵抑制剂联合抗菌药物仍是根除Hp感染的主要方法,根除治疗方案主要包括标准三联疗法、铋剂/非铋剂四联疗法(伴同疗法、序贯疗法等)[11]。然而,由于Hp耐药性等问题的存在,实现高效清除Hp的目标仍然十分困难。本研究利用Hp的微需氧特性,拟通过H2O2分解释放氧气的方式提高环境中的氧含量,最终诱导Hp死亡。
正常大气条件下,37 ℃水溶液的氧含量约为6.8 μg/mL[12];而在微需氧条件下,本课题组预实验结果显示,37 ℃水溶液的氧含量约为1.7~2.0 μg/mL。由于Hp定植于胃黏膜表面并被胃液包围浸润,可推断胃液属于适宜Hp生长的微需氧环境,即胃液氧含量也应在1.7~2.0 μg/mL范围内。当环境中的氧含量超过5.0 μg/mL(15%V/V)时[6],Hp因生存适应能力达到极限而无法存活。本研究证实,在37 ℃正常大气条件下,随着H2O2浓度的增加(0.02~2.00 mg/mL),水溶液中的氧含量随之升高,达到7.86~26.67 μg/mL,远远超过Hp极限生存的氧含量5.0 μg/mL。同样,家兔胃内注入H2O2溶液(0.5和1.0 mg/mL)后,胃液氧含量也显著升高,达到15.23和18.78 μg/mL,这一氧含量足以杀灭Hp。因此,H2O2在体内外条件下释放的氧含量均满足高效清除Hp的要求。
Hp在含H2O2的液体培养基中震荡培养5 d后,其生长状态发生显著变化,生长曲线呈现类似于“全”或“无”的趋势。低浓度H2O2组的Hp生长曲线呈对数形态,近似于空白对照组,表明在该氧含量下Hp尚能正常生长;而高浓度H2O2组Hp生长趋势差,曲线平缓,表明细菌无法生长甚至已死亡;中等浓度H2O2组的Hp生长曲线则多呈现先抑制、后生长的趋势,表明其生长状态介于抑制与正常之间。本研究结果显示H2O2对Hp国际标准菌株ATCC43504和野生型菌株Ⅰ、Ⅱ、Ⅲ的MIC上限为2.1 mg/mL,MBC上限为3.2 mg/mL,说明这些Hp菌株均对H2O2敏感,能被H2O2有效抑制和清除。本研究在体外条件下证实,H2O2建立的高氧环境对Hp这类微需氧菌具有广谱高效的清除作用。
蒙古沙鼠是目前国际公认的适用于Hp感染研究的动物模型[13],具有感染率高、定植菌量大、感染后组织学改变与人类相似等诸多优点。本研究通过Giemsa染色证实,蒙古沙鼠感染Hp后胃黏膜中有大量细菌定植,表明模型建立成功。经H2O2溶液连续灌胃14 d,各浓度H2O2组蒙古沙鼠胃黏膜Hp数量与空白对照组相比均无明显增加,表明H2O2在体内环境中同样发挥了高效清除Hp的作用,与体外实验结果一致。而三联药物组给药14 d后胃黏膜中仍存在大量Hp,提示较之临床常用于根除Hp的铋剂与抗菌药物组合,H2O2疗效更为显著。
H2O2为强氧化剂,如期望今后应用于Hp感染的临床治疗,将其浓度控制在安全范围内以充分保证使用安全性十分必要。根据本研究体内外除菌实验结果,2 mg/mL是H2O2在蒙古沙鼠中清除Hp的适宜浓度。本课题组在预实验阶段分别通过急性毒性实验和胃黏膜损伤实验验证了H2O2在体内应用的安全性。在急性毒性实验中,接受2 mg/mL H2O2灌胃14 d的蒙古沙鼠和昆明小鼠全部存活,体质量未见明显减轻;胃黏膜损伤实验证实经10 mg/mL H2O2灌胃的昆明小鼠胃黏膜完整、未见损伤,而阿司匹林阳性对照组小鼠胃黏膜可见多发糜烂灶,表明浓度不超过10 mg/mL的H2O2经口给药不会损伤胃黏膜。上述证据表明2 mg/mL H2O2经口给药不会出现毒性反应,且不会造成胃黏膜损伤,安全性良好。
本研究还探讨了H2O2清除Hp的机制是否与菌体细胞膜损伤有关。透射电子显微镜观察直接证实了2 mg/mL H2O2处理后的Hp细胞膜破坏严重,而阿莫西林阳性对照组仅有菌体细胞壁变形损伤,细胞膜保持完整。进一步利用正苯基萘胺与细胞膜磷脂结合产生蓝色荧光的特点观察Hp细胞膜渗透性的变化[14],结果显示相对荧光强度随H2O2浓度增加呈现剂量依赖性上升趋势,表明菌体细胞膜渗透性逐渐增高,间接证实了细胞膜破裂程度逐渐加重。
利用H2O2分解释放氧气的特点建立高氧环境,在体内外条件下均可成功清除Hp。目前这一成果已申请国家发明专利(CN109223825A),设想未来可将适宜浓度的H2O2制成多种剂型,如口服液、片剂、胶囊剂、粉剂、颗粒剂等,从而实现科研成果的临床转化。然而,目前距H2O2成功应用于临床Hp根除治疗还有相当大的距离,其药理学、毒理学、药代动力学等研究均有待进一步深入。首先,除口服外,还需探究其他给药途径的可行性,如腹腔局部给药、静脉给药等,并选择最佳给药方式;其次,应明确H2O2发挥除菌作用的剂量效应和时间效应;最后,需阐明H2O2清除Hp的关键机制,验证其发挥作用的具体分子靶点和相关信号通路。在进入临床试验前,需综合评价上述研究数据对拟行的临床试验的支持程度,以确保安全。
综上所述,本研究证实H2O2能有效提高水溶液中的氧含量,在体内外条件下均能对Hp发挥高效清除作用,其机制与菌体细胞膜损伤密切相关。根据Hp的微需氧特性,通过提高环境氧含量诱导Hp死亡,最终达到高效除菌目的,这一方法从从全新角度解决Hp感染的清除问题,为临床根除Hp提供了新思路和新选择。

