术后辅助化疗在消化道神经内分泌癌中的临床研究*
孙明明 熊燕燕 李丹阳 徐淑宁 乔磊 刘莺
神经内分泌癌(neuroendocrine carcinomas,NECs)是一类侵袭性强、预后差的罕见肿瘤,占神经内分泌肿瘤(neuroendocrine neoplasms,NENs)的10%~20%,仅8.7%位于肺外[1-2]。肺外NECs主要为消化道来源,年发病率仅0.4/10万,超过65%的患者初诊时为晚期,无法行根治性手术治疗,5年生存率低于15%[1]。目前消化道NECs的治疗方案多参照小细胞肺癌,以铂类为基础的化疗被推荐为晚期NECs的一线标准治疗,客观缓解率为30%~67%,但中位总生存(overall survival,OS)仅为11~19个月[2]。基于奥沙利铂(FOLFOX)或伊立替康(FOLFIRI)方案的小样本研究显示效果不佳,客观缓解率为23%~40%[2]。免疫治疗在改善患者生存方面缺乏相关临床研究证据[3],无有效的后线治疗方案。
近年研究显示[1],可切除的消化道NECs 患者5年生存率为25%~50%,可见早期治疗是NECs 患者预后的关键。同时强调应采取除手术治疗外更多的综合治疗措施来进一步提高生存获益。对于可切除的NECs 指南建议行根治性手术和辅助化疗,联合或不联合放疗[4]。然而,关于术后辅助化疗的作用尚不清楚,缺乏前瞻性研究,回顾性数据亦有限[4-5]。因此,本研究回顾性分析消化道NECs 术后辅助化疗与无病生存的相关性,并对不同术后辅助化疗方案的疗效进行探究,以期为术后治疗提供更多的临床数据。
1 材料与方法
1.1 临床资料
收集2018年6月至2020年9月于郑州大学附属肿瘤医院接受根治手术的消化道NECs 患者的临床病理资料。入组标准:1)患者年龄≥18岁;2)接受R0切除,同时经术后病理证实为低分化的消化道NECs;3)术后4~6 周开始至少给予2 个周期的辅助化疗;4)经随访有影像学证据证实疾病进展(复发或转移)。排除标准:1)分化好的消化道NECs;2)非消化道来源的NECs;3)术前接受了辅助放、化疗;4)合并有其他恶性肿瘤。
1.2 方法
1.2.1 分组 根据是否接受了以铂类为基础化疗将入组患者分为术后辅助化疗组(postoperative adjuvant chemotherapy,PAC)和单纯手术组(postoperative observation,PO)。其中PO组11例患者因经济原因放弃辅助化疗,6 例患者持无效或恐惧态度,余患者未进行术后辅助化疗原因不详。本研究分组充分考虑患者自身意愿,不存在利益冲突。
1.2.2 化疗方案 21例患者采用依托泊苷联合铂类(EP)的化疗方案:依托泊苷100 mg/m2,第1~3 天静脉滴注;顺铂80 mg/m2,第1天静脉滴注;卡铂按照血药浓度-时间曲线下面积为4~5进行计算,第1天静脉滴注,21 天为1 个周期。17 例患者采用伊立替康联合铂类(IP)化疗方案:伊立替康60 mg/m2,第1、8天静脉滴注;顺铂60 mg/m2,第1天静脉滴注;卡铂按照血药浓度-时间曲线下面积为4~5进行计算,第1天静脉滴注,21天为1个周期。
1.2.3 研究终点 主要研究终点为PAC 组与PO 组的2年无病生存率(disease-free survival,DFS),次要研究终点为不同辅助化疗方案的DFS。DFS 定义为从根治性手术开始到任何原因引起疾病进展或死亡的时间。随访方式为电话、门诊或住院随访。
1.3 统计学分析
采用SPSS 26.0软件进行统计学分析。计数资料采用率表示,组间比较使用χ2检验或Fisher′s 确切概率法。Kaplan-Meier 生存分析方法分析DFS。采用Log-rank 检验进行单因素分析。使用Cox 比例风险模型进行多因素分析。根据CTCAE 4.0 标准进行不良事件评估。采用Prism 8.0软件绘制生存曲线。以P<0.05为差异具有统计学意义。
2 结果
截至2020年10月随访结束,共筛选62 例患者,其中男性52 例(83.9%),女性10 例(16.1%),中位年龄为65(38~84)岁。食管NECs 为12 例(19.3%),胃NECs 为45 例(72.6%),小肠和结直肠NECs 为5 例(8.1%)。术后组织病理显示,CgA 阳性表达24 例(38.7%),SyN阳性表达60例(96.8%),神经侵犯阳性33 例(53.2%),脉管癌栓阳性39 例(62.9%),淋巴结阳性31 例(50.0%)。Ki-67 中位数为80%(30%~90%)。PAC 组38 例辅助化疗患者的中位化疗周期为3 周,其中21 例(55.3%)接受EP 方案治疗,17 例(44.7%)接受IP 方案治疗。21 例患者化疗超过4 个周期。24 例(38.7%)患者接受单独手术治疗。随访期间26例患者疾病进展,7例复发,18例出现以肝脏和淋巴结为主的远处转移,1例患者同时出现复发和转移。患者的基线特征见表1。
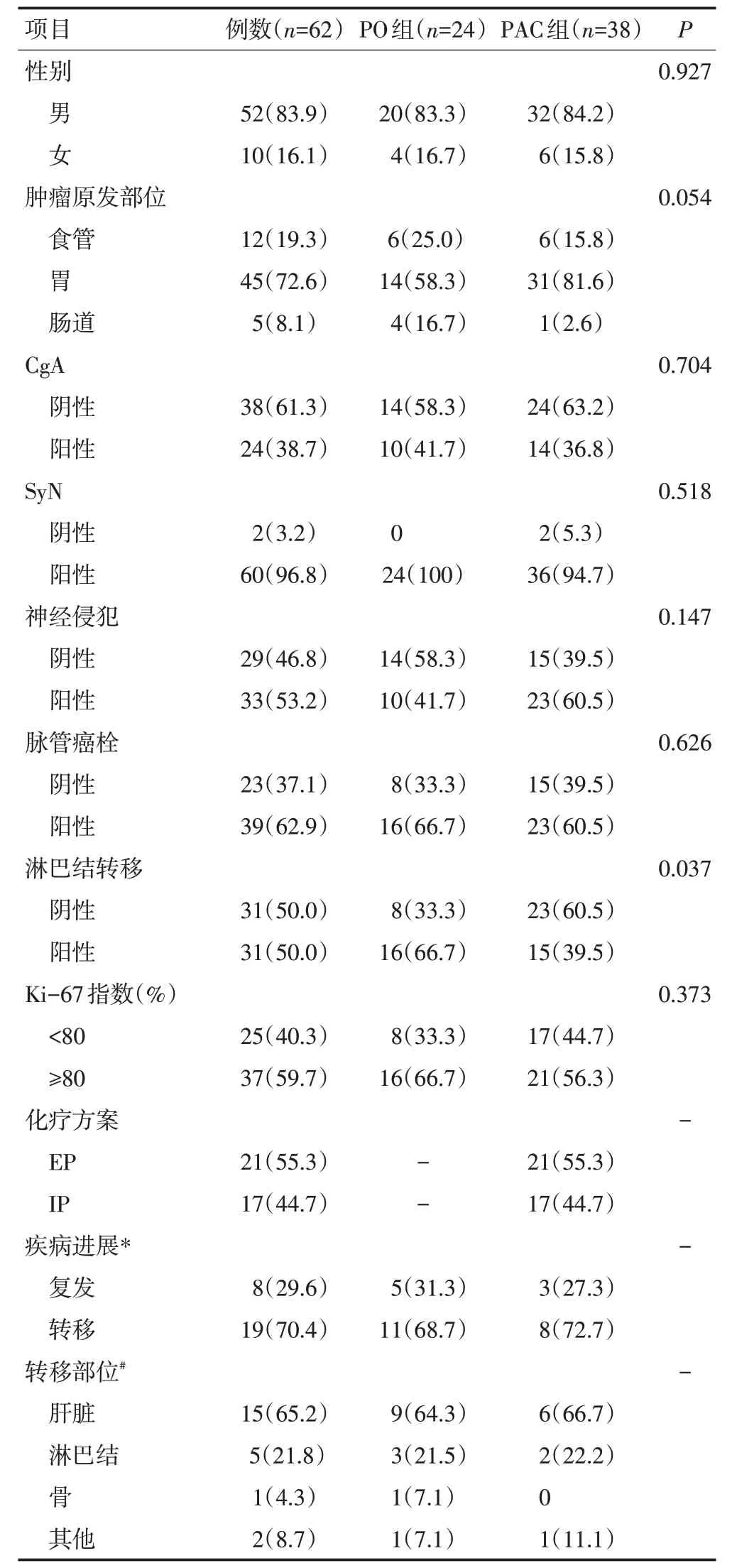
表1 62例消化道NECs患者基线特征
本研究中位随访时间为21.7(2.5~28.2)个月。62例患者的2年DFS 为48.2%,中 位DFS 为17.4(6.5~28.3)个月。PAC组2年DFS为58.7%,PO组为14.7%。PAC 组较PO 组明显提高2年DFS(P<0.001,图1)。亚组分析显示,EP 治疗组的2年DFS 为84.4%,IP 治疗组为43.0%,两组的2年DFS 差异无统计学意义(P=0.105,图2)。对接受不同化疗周期数的患者进行分析发现,辅助化疗<4 个周期与≥4 个周期对患者的生存期无显著影响(P=0.946,图3)。将38例接受术后辅助化疗患者的年龄、性别、CgA、神经侵犯、脉管癌栓、Ki-67 增殖指数、淋巴结等因素纳入Cox风险比例回归模型。结果显示,淋巴结阳性的患者接受术后辅助化疗可改善DFS 获益(HR:6.043,95%CI:1.329~27.465,P=0.020,表2)。
根据CTCAE 4.0不良事件评价标准,接受术后辅助化疗的不良事件见表3。两组主要不良反应为骨髓抑制和胃肠道反应。组间贫血、血小板减少、恶心呕吐、腹泻发生率比较差异无统计学意义(P>0.05)。EP组3级以上的白细胞减少症发生率明显高于IP组(85.7%和52.9%),差异具有统计学意义(P=0.011)。在本研究中无治疗相关性死亡。

图1 PO组和PAC组患者的无病生存曲线

图2 接受EP和IP治疗患者的无病生存曲线

图3 接受不同辅助化疗周期患者的无病生存曲线
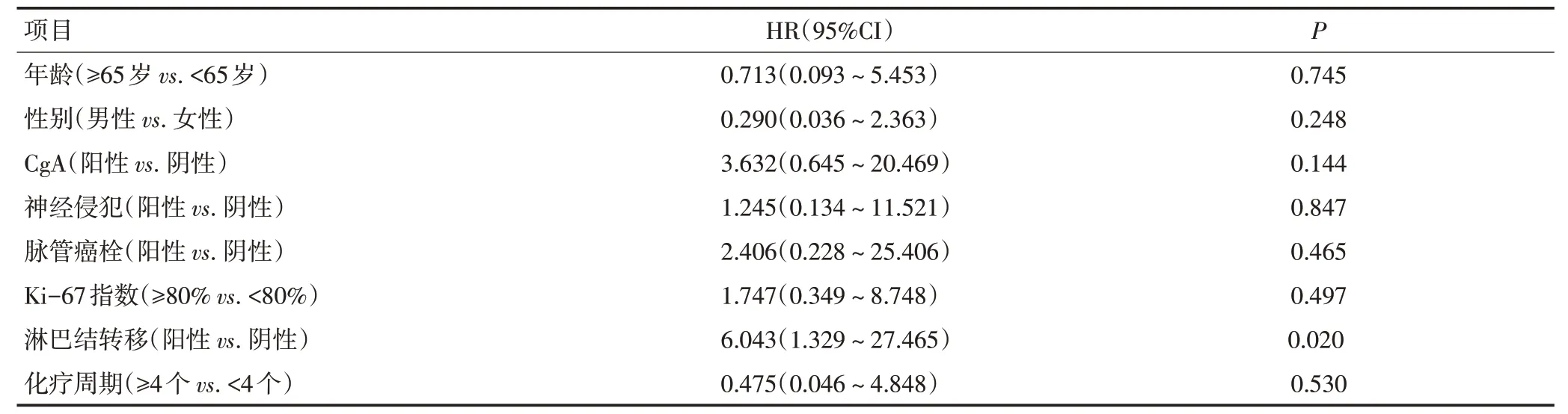
表2 38例接受术后辅助化疗患者DFS的多因素分析

表3 至少接受2个周期辅助化疗患者的不良反应
3 讨论
目前在食管、胃等消化道恶性肿瘤的治疗过程中,根治术后接受辅助化疗已成为共识,尤其是局部晚期肿瘤,辅助化疗有助于降低术后复发转移的风险,改善生存获益。在消化道NECs 中,有关术后辅助化疗的作用尚不清楚。除与NECs 发病率较低有关之外,与疾病早期临床表现不典型、诊断时多为疾病晚期有关[1]。为了改善患者预后,针对NECs 根治术后易出现复发转移的特点,美国国立综合癌症网络(NCCN)、欧洲神经内分泌肿瘤学会(ENETS)等多项指南均建议根治性手术的患者术后常规接受辅助化疗[4-5]。国内有关NECs 根治术后接受辅助化疗的回顾性数据分析较少,且缺乏前瞻性研究[6]。因此,本项回顾性研究分析了单纯手术治疗和术后辅助治疗与NECs根治术后2年DFS的关系,结果显示,术后接受辅助化疗能够显著降低术后复发转移风险,为NECs根治术后患者带来生存获益。
Casas等[7]进行的一项小样本研究显示,食管小细胞癌患者术后辅助化疗比单纯手术治疗可显著提高生存获益,中位OS分别为20个月和5个月(P<0.001)。但张唐娟等[6]对529例主要采用依托泊苷或氟尿嘧啶为基础治疗的食管小细胞癌患者进行分析,结果显示术后辅助治疗对患者OS无影响(P=0.254)。此外,另有研究分别基于SEER和NCDB数据库的研究同样未发现NECs术后应用化疗可增加患者的生存获益[8-9]。因此,目前关于NECs术后辅助化疗的价值尚不十分明确。与本研究结果不同,分析原因可能是上述研究按照世界卫生组织(WHO)2010年分类标准纳入了对化疗不敏感但预后较好的G3 NETs,使得研究结果存在差异。
研究已经证实,当Ki-67指数>20%时,不同分化程度的NENs之间存在显著的疗效和预后差异,因此WHO 分类标准(2019年)将异质性的G3 NENs 分为高分化的NETs G3 和低分化的NECs G3[10]。本研究根据该指南,对患者的术后组织病理进行了重新检查,排除了G3 NETs,仅对低分化NECs 进行分析,结果显示术后辅助化疗较单纯手术治疗可显著提高NECs患者的2年DFS率,降低术后复发转移风险,改善生存获益。然而与本研究结果不同,Merola等[11]研究未能证实术后辅助化疗可降低复发风险。该研究共纳入40例行根治性手术的胃肠胰NECs患者,其中接受术后辅助治疗的18 例患者中13 例为结直肠NECs。化疗方案主要为依托泊苷联合铂类。结果显示,单纯手术治疗和术后辅助治疗NECs 的2年无复发生存率(repalse free survival,RFS)无差异,分别为31.8%和36.4%(P=0.43)。该研究接受辅助治疗的患者较少,且主要以结直肠NECs 为主,研究对象中还包括13 例(32.5%)胰腺NECs,所用化疗方案与本研究存在差异,上述原因均可能导致研究结果的不同。
关于化疗方案的选择,除了EP方案外,IP方案也被推荐为晚期NECs 标准治疗,但两种方案的优越性尚有争议[12-15]。与日本研究[12-13]结果不同,美国等研究[14-15]均未证实IP方案较EP方案可显著提高患者的生存获益,分析可能与研究对象的种族和地理位置不同有关。为了明确IP 方案的疗效,国内一项Ⅱ期临床试验[16]结果发现,EP和IP方案的中位PFS(分别为6.4 个月和5.8 个月,P=0.81)或中位OS(分别为11.3 个月和10.2 个月,P=0.37)之间无显著性差异。此外,日本最近的一项Ⅲ期临床试验显示[17],与EP方案相比,IP方案作为肺高级别NECs 术后辅助化疗方案未显著改善3年RFS(分别为65.4%和69.0%,P=0.619)。与上述研究结果类似,本研究发现接受根治性手术的NECs 患者术后接受EP和IP方案治疗疗效相当,2年DFS无显著性差异(P=0.105)。但IP组2年DFS 较低(43.0%),考虑与化疗周期短、样本量小有关。不良反应方面,EP方案可导致更高的血液毒性,而IP 方案则主要以消化道症状为主,这与大多数临床研究结果一致[12-16]。
多因素分析结果显示,淋巴结阳性是DFS的主要影响因素。与法国的一项多中心回顾性研究一致[18],发现淋巴结阳性与较差的DFS相关(HR:2.54,95%CI:1.31~4.96,P=0.006)。目前法国指南已经建议术前进行18FDG-PET/CT 检查,以提高对术前淋巴结转移和(或)远处转移的检测[19]。淋巴结阳性有可能作为高危因素在制定治疗决策时进行考虑。
Ki-67 指数也被认为是影响预后的预测因素。但与另两项研究[11,20]结果不同,本研究未发现Ki-67阈值达到55%对生存结果有任何影响,这可能与纳入人群中不包括晚期和分化良好的G3 NENs 有关。根据NENs 的组织病理学特征,一般认为NECs 具有高增殖活性,其Ki-67 值>50%。因此,Pellat 等[18]研究对73 例高增殖指数(Ki-67 值中位数为70%)的可切除NECs 进行回顾性分析,其中70%为胰腺和结直肠NECs,结果显示,Ki-67阈值为80%时对DFS和OS具有预测价值(P=0.012 和P=0.045)。然而,本研究排除了胰腺等非消化道来源的NECs 进行分析,发现Ki-67 截断值为80%时,对预后无预测价值(P>0.05)。因此,推测Ki-67 指数能否作为NECs 预后的预测因素,可能与肿瘤来源异质性相关。
原发肿瘤部位能否作为预后指标一直存在争议[10,21-22]。有研究发现,原发肿瘤部位与预后相关,晚期胰腺NECs 患者的中位OS 为15~21 个月,GEPNECs 患者的中位OS 为11 个月[20-21]。然而日本的一项研究中[21],来源于肝胆胰部位的NECs 患者的生存期较其他胃肠道原发NECs 患者短(7.9 个月和13 个月),分析可能与化疗方案不同、纳入人群不均等因素相关。此外,有研究[22]显示原发肿瘤部位在非转移性NECs 中同样具有预测价值。Mao 等[22]对806例非转移性结直肠NECs 患者进行分析,结果显示,接受辅助治疗的左侧结直肠NECs 患者(HR:0.55,95%CI:0.44~0.68)OS 较右侧结肠NECs(HR:0.89,95%CI:0.74~1.07)显著改善(P<0.001)。目前普遍认为,左侧结直肠腺癌和右侧结肠腺癌具有不同的分子特征,是导致生存和治疗反应存在差异的根本原因。Takizawa等[23]研究证实结直肠NECs在基因突变方面与结直肠腺癌有一定的相似之处,这可能是左侧结直肠NECs 患者从辅助治疗中受益更多的结果。因此,更好地了解NECs 的生物学特征对于确定何种人群可能从治疗中取得最佳获益至关重要。
综上所述,本研究结果表明辅助化疗在消化道NECs中可降低术后复发转移风险,提高生存获益,但关于辅助化疗方案的选择仍需进行深入的研究。

