表没食子儿茶素没食子酸酯对脂多糖诱导的子宫内膜炎症反应的影响
王友元,石丽颖,孙凯鑫,李前庆,吕文发*,王 军*
(1.现代农业技术教育部国际合作联合实验室,吉林长春 130118;2.动物生产及产品质量安全教育部重点实验室,吉林长春 130118)
在奶牛生产过程中,子宫内膜炎是最为常见的繁殖障碍性疾病,该病可降低奶牛的繁殖性能甚至造成不孕,不仅减少产奶量还增加饲料消耗,给奶牛养殖业造成巨大的经济损失。革兰氏阴性细菌通常认为是损害子宫内膜的病原体[1-2],脂多糖(LPS)是革兰氏阴性细菌细胞壁外膜的组成部分,是免疫系统中最有效的刺激物之一[3],已广泛用于急性肺损伤、乳腺炎、子宫内膜炎等炎症模型的建立[4-5]。据报道,LPS 可以诱导Toll 样受体4(TLR4)信号通路活化,继而导致炎症细胞因子过量表达[6],当LPS 刺激TLR4 表达时,会诱导NF-κB 途径激活[7-8],促进白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)等炎症细胞因子的分泌,从而加剧炎症反应对机体的损伤[9-10]。
表没食子儿茶素没食子酸酯(EGCG)是绿茶中的主要活性成分[11],是众多绿茶提取物中对抗细菌、病毒和真菌的最有效物质[12],并且具有强大的抗氧化、抗炎和抗肿瘤作用[13-14]。试验研究和临床研究表明,EGCG 可以有效抑制大鼠乳腺炎及小鼠急性肺损伤的发生[15-16],但在子宫内膜炎上的研究还未见报道。本研究旨在探讨EGCG 对LPS 诱导的小鼠子宫内膜炎的治疗作用及其机制,为EGCG 预防和治疗LPS 诱导的子宫内膜炎的研究和应用提供参考。
1 材料与方法
1.1 试验材料 EGCG(纯度≥98%,上海源叶生物科技有限公司),LPS(Sigma,美国);抗体均为CST (美国)产品;小白鼠购自沈阳长生生物技术股份有限公司。
1.2 试验设计 选取60 只10 周龄体重为30~35 g、健康状况良好的雌性昆明小白鼠,按体重随机分为5 组,每组12 只,适应7 d 后将小鼠随机分为对照组、LPS 组、EGCG(1、5、10 mg/kg)+LPS 组。将LPS 和EGCG 溶于无菌生理盐水中至所需浓度。麻醉小鼠后用留置针软管向小鼠子宫内注入20 µL LPS(2.5 mg/mL)以建立子宫内膜炎模型[17],灌注LPS 6 h 后,EGCG+LPS 组小鼠腹腔内分别注射不同浓度的EGCG(1、5、10 mg/kg)3 次,每6 h 注射1 次,对照组和LPS 组以相同方式注射生理盐水。24 h 后全部小鼠进行安乐死,并收集子宫组织冻存于-80℃,用于后续检测试验。
1.3 qRT-PCR 分析 采用RNAiso Plus(TaKaRa,日本)提取小鼠子宫组织的总RNA,并反转录为cDNA,用于qRT-PCR 试验。本试验所需的基因引物序列见表1。引物由宝生物工程(大连)有限公司设计及合成。反应条件:95℃预变性120 s;95℃变性15 s,60℃退火30 s,扩增40 个循环。运用 2-△△Ct方法进行数据分析。引物退火温度均为60℃。
1.4 ELISA 检测 严格按照试剂盒(江苏酶免实业有限公司)说明书进行操作,利用连续光谱酶标仪(Biotek,美国)检测所有小鼠子宫组织裂解液中的髓过氧化物酶(MPO)、IL-6、IL-1β和TNF-α含量。
1.5 Western blot 检测 根据蛋白大小分别配制12% 的聚丙烯酰胺凝胶,采用BCA 蛋白浓度测定试剂盒(碧云天生物技术公司)测定蛋白浓度,上样20 μg/ 孔。80 V 电压电泳至分离胶变为160 V 电压至电泳结束。采用半干法转膜,转膜条件为0.12 A 28 min,将目的蛋白转印到硝酸纤维素膜(NC)上。采用封闭液封闭1.5 h,一抗(1:1000)p-p65、p65、p-IκBα和IκBα(3033S、8242S、2859S 和4812S),4℃孵育过夜,TBST 洗5 次,每次5 min。孵育二抗(1:10000),室温1 h,TBST 洗5 次,每次5 min。最后用ECL 发光液显影,用TanonGis 软件进行灰度值分析。
1.6 统计分析 采用SPSS 18.0 软件进行单因素方差分析,比较组间差异性,数据用平均值± 标准差表示,P<0.05 表示差异具有统计学意义,使用GraphPad Prism 8.0 软件作图。
2 结果
2.1 子宫组织解剖学观察 如图1 所示,对照组小鼠具有健康的组织学形态,无病理学变化;在LPS 组中,子宫表现出明显的病理损伤,伴有严重的充血和肿胀现象;经EGCG 治疗后,充血和肿胀明显减少,子宫状态得到显著改善。

表1 基因引物合成信息

图1 EGCG 治疗效果验证
2.2 EGCG 对TLR4和MPO 活性的影响 如图2 所示,LPS 组中TLR4 和MPO 活性较对照组极显著增加,当EGCG 注射量达到5 mg/kg 时TLR4极显著下降,MPO显著下降,当EGCG 注射量达到10 mg/kg 时,两者均极显著下降。试验结果说明EGCG 缓解LPS 对子宫内膜的侵害具有剂量依赖性。
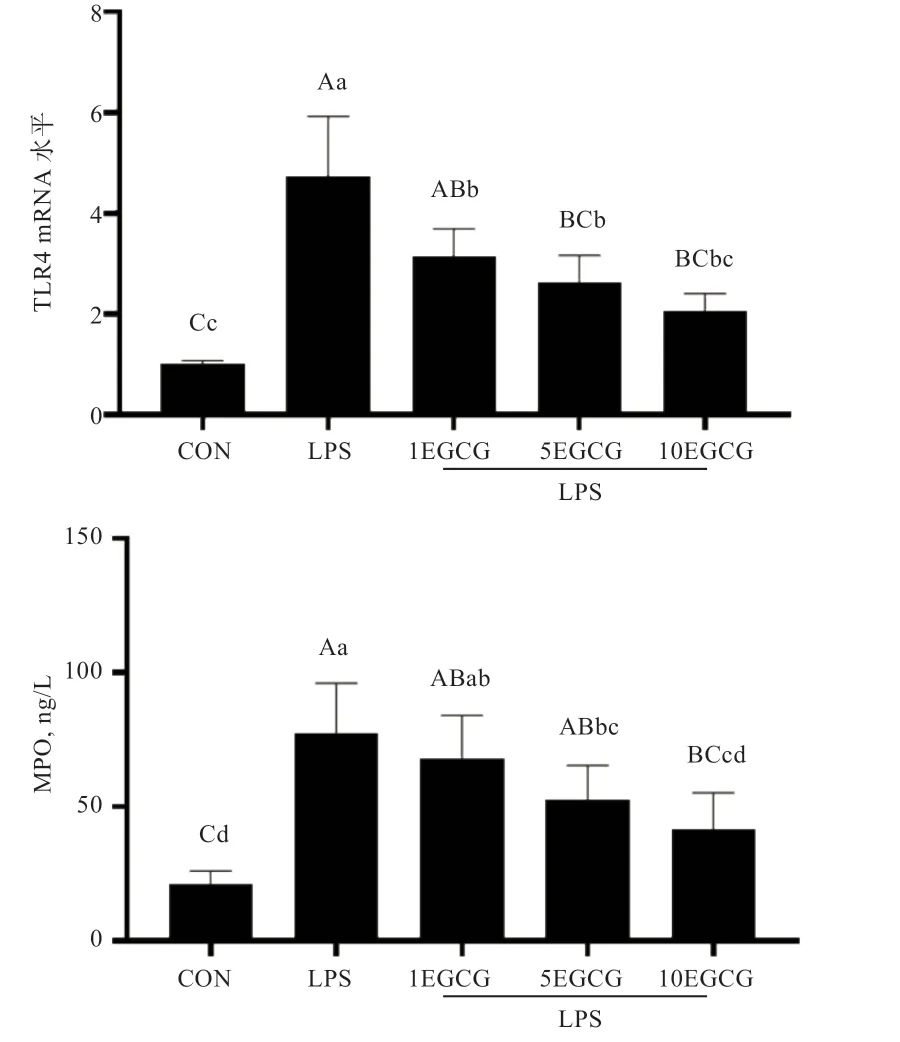
图2 EGCG 对TLR4 和MPO 表达的影响
2.3 EGCG 对炎症细胞因子表达的影响 如图3 所示,qRT-PCR 检测表明,LPS 组 的IL-6、IL-1β和TNF-αmRNA 水平较对照组极显著上升,在EGCG 治疗组中极显著降低。ELISA 检测显示相同趋势,当EGCG 注射量达为1 mg/kg 时,IL-6、IL-1β和TNF-α显著下降;当EGCG 注射量为5 和10 mg/kg 时,IL-6、IL-1β和TNF-α极显著下降。结果表明EGCG 抑制了LPS 诱导的子宫组织中炎症细胞因子的表达及分泌。
2.4 EGCG 抑制LPS 诱导的NF-κB 途径活化 由图4可知,使用Western blot 分析表明,LPS 极显著诱导了p65 和IκBα蛋白的磷酸化;10 mg/kg EGCG 显著降低了p65 的磷酸化,极显著降低了IκBα的磷酸化。试验结果表明,EGCG 可通过抑制TLR4 介导的NF-κB 活化减轻炎症反应。
3 讨 论
子宫内膜炎是子宫的一种炎症状态,大肠杆菌是最常见的病原体之一[1]。LPS 由大肠杆菌分泌,是一种有效的致炎物质[18-19],能够作用于TLR4 从而激活NF-κB信号通路,随后促进IL-6、IL-1β和TNF-α等炎症细胞因子的分泌来诱导炎症反应,导致嗜中性粒细胞的募集,从而加重子宫内膜上皮的损伤。本研究用LPS 诱导小鼠子宫内膜炎模型,随后腹腔注射EGCG 进行治疗试验,结果表明EGCG 可抑制TLR4介导的NF-κB 激活,从而减弱子宫内膜炎发生过程中炎症细胞因子的释放。
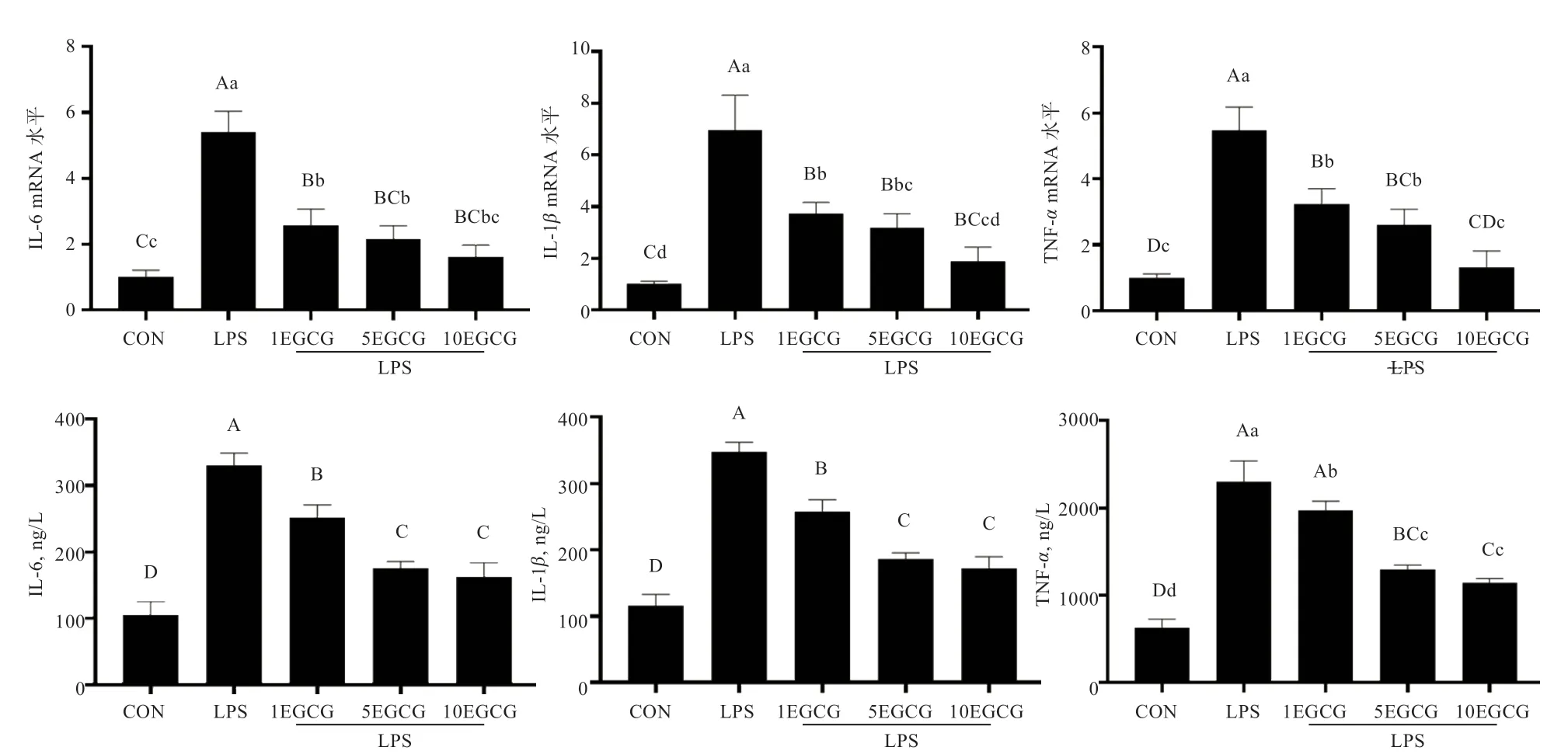
图3 EGCG 对炎症细胞因子表达的影响
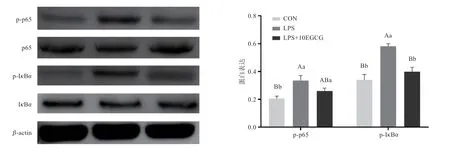
图4 EGCG 抑制LPS 诱导的NF-κB 途径活化
EGCG 对炎症反应具有一定的抑制作用[16]。本研究的解剖学观察也表明,LPS 可导致子宫组织炎症的发生,而EGCG 可显著改善子宫的病理变化。MPO 活性与嗜中性粒细胞呈正相关关系,可以间接反映炎症的严重性[20],MPO 活性减弱意味着抗炎反应降低,这表明EGCG 对LPS 诱导的子宫内膜炎具有缓解作用。TLR4 是TLR(Toll 样受体)家族之一,是LPS 的受体[21]。研究表明,LPS 可通过TLR4 诱导免疫反应并介导NF-κB 途径的活化[22]。NF-κB 是一种广泛表达的核转录因子,是炎症最重要的调节剂之一[23],当IκBα发生磷酸化时,NF-κB 将被激活,然后迁移至细胞核内,加剧炎症细胞因子的表达[24-25]。本试验结果表明,EGCG 可剂量依赖性地抑制TLR4的mRNA 表达,并抑制p-IκBα和p-p65 的蛋白水平,这表明EGCG 在治疗LPS 诱导的小鼠子宫内膜炎中是通过NF-κB 途径实现的。IL-6 由细胞产生以应对侵袭和伤害,这对白细胞募集和组织动态平衡起着重要作用[26]。IL-1β是炎症的主要介质,主要由活化的巨噬细胞分泌[27]。TNF-α是一种多向性的促炎症细胞因子,由多种细胞分泌,具有多种生物学功能[28]。有研究报道,LPS 诱导的子宫内膜炎可以促进IL-6、IL-1β和TNF-α的表达[29]。本试验结果表明,EGCG 可显著地减少这些炎症细胞因子的表达和分泌,从而减少LPS 对小鼠子宫内膜的侵害。
4 结 论
本试验结果表明,EGCG 可下调TLR4 和MPO 的表达,抑制炎症细胞因子IL-6、IL-1β和TNF-α的分泌,阻止NF-κB 信号通路的激活,提示EGCG 可作为预防和治疗LPS 诱导的子宫内膜炎的潜在药物。

