川芎非根际、根际及根茎内生真菌群落差异分析
张秫华 方千 贾红梅 韩桂琪,2 严铸云 何冬梅
(1. 成都中医药大学药学院 中药资源系统研究与开发利用国家重点实验室培育基地,成都 611137;2. 成都中医药大学医学技术学院,成都 611137)
土壤作为真菌群落的“种子库”,是许多植物内生菌的最初来源,植物根系分泌物可吸引特定的菌群在根际聚集,形成与植物具特殊关系的根际菌群,而植物组织作为特化性更强的环境,与其共存的真菌群落和植物生长发育更加息息相关[1-3]。李毳等[4]认为植物-微生物-土壤相互作用形成特定的土壤生态系统,为道地药材的生长提供了特异的生境。据报道,杜仲的根际真菌和内生真菌对其道地性及其活性成分含量具重要影响影响[5],野生地黄和怀牛膝抵御病害的能力与根际益生菌和病原菌比例有关[6-7]。由此可见健全而平衡的土壤微生物和内生菌群落对药用植物生长、发育、代谢及品质形成的重要性。然而,我们对根际微生物、内生菌群的构建规律知之甚少,由此也在一定程度上制约了药用植物微生态调控技术的发展。
药材川芎是伞形科植物川芎(Ligusticum chuanxiong Hort.)的根状茎,具有活血行气、祛风止痛的功效,主要用于治疗月经不调、头风头痛、风湿痹痛等疾病[8]。川芎是典型的单道地药材,近代以来,其道地产区由传统产区都江堰向新兴产区眉山、彭州等地扩张[9-10]。有研究显示新老产地川芎有效成分具有差异[11],还有研究显示川芎根际真菌[12]和内生菌群落[13-14]均存在地理差异,并发现川芎挥发油及其有效成分含量与内生真菌有关[15]。此外,从川芎内生真菌中分离出的镰孢属、木霉属和青霉属内生真菌能有效拮抗土传病害——川芎根腐病病原菌[16-18],并发现川芎在栽培过程中始终存在一部分丰度随栽培地变化的真菌类群[19]。由此推测川芎土壤微生物和内生真菌菌群之间形成的微妙平衡关系对其道地性品质和抗病性等至关重要。
然而,上述研究对川芎根际和根茎内生真菌的探查技术的通量有限,更全面川芎微生态结构尚不清楚,川芎内生菌群与土壤真菌之间存在什么样的关系未见研究报道。本研究拟通过高通量测序技术(high-throughput sequencing,HTS) 和 FUNGuild分析比较川芎内、外环境中的真菌群落结构,并分析真菌群落的生态功能,挖掘川芎内、外环境真菌的关联性,揭示川芎产地真菌群落结构特征。这有助于科学认识微生态结构对川芎道地性品质的贡献,为探究川芎区域品质与环境微生物的关系奠定基础。
1 材料与方法
1.1 材料
在川芎传统道地产区及非传统道地产区分别设置各设6个采样点(表1)。于2018年4月下旬采集川芎非根际土(S)、根际土(R)及川芎根茎(P)。川芎传统道地产区以都江堰市石羊镇封堆村(SY1)为中心,沿东南西北设计1 km×1 km采样套方,在4角分别设采样点(SY2、SY3、SY4、SY5),此外,在样方附近的川芎种植示范基地设置采样点(SY6)。川芎非传统道地产区选择崇州观胜(CZ)、邛崃回龙(QL)、眉山修文(XW)、彭州敖平(PZ)、眉山谢家(XJ)和眉山永寿(YS)进行样品采集,采集样地为川芎栽培地,共计12批样品。
1.2 方法
1.2.1 样品采集与前处理 在各样点面积为100 m×100 m的川芎栽培地内,采用十字交叉法,用已消毒的铁铲和土钻(直径5 cm)采集川芎植株之间5-20 cm的耕作层土壤作为非根际土(S),每个样点采集20份土壤,经除杂、混合均匀后四分法收集约2 kg,取约150 g土壤装入经灭菌的50 mL离心管,以冰盒临时保存并迅速带回实验室,于-20℃保存以供DNA提取,剩余土壤带回实验室后放于阴凉通风处自然风干用于理化性质的测定。另以十字交叉法采集新鲜、无病害川芎植株50株,抖根法收集根际土(R),按非根际土处理办法对样品进行分装、保存。
于50株川芎植株中随机选取15株,取根茎(P)以冰盒临时保存,迅速带回实验室,洗去泥沙,用手术刀轻轻刮去外皮,75%酒精浸泡40 s,经无菌水清洗3遍,2% NaClO溶液浸泡15 min,无菌水清洗5遍,于超净工作台内平均纵剖成6小块。从15株根茎中各取1小块形成一份根茎混合样品,于-20℃保存用于DNA提取。

表1 川芎样品采集样地信息Table 1 Sampling plot information of L. chuanxiong Hort.
1.2.2 样品DNA提取 上述土壤及川芎根茎样品经液氮充分研磨成粉末,取0.5 g,按试剂盒说明书进行DNA提取,每份样品进行3个重复。1% 琼脂糖凝胶电泳及核酸测定仪检测DNA浓度及纯度,样品委托上海美吉生物有限公司完成高通量测序。
1.2.3 PCR扩增及高通量测序 针对真菌ITS区选择PCR扩增通用引物对ITS1F / ITS2R(ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′;ITS2R :5′-GCTGCGTTCTTCATCGATGC-3′)。 扩 增 体 系(20 μL)为 10× Buffer 2 μL,2.5 mmol/L dNTPs 2 μL,正、反引物 0.8 μL,rTaq polymerase 0.2 μL,BSA 0.2 μL,DNA 10 ng,补足ddH2O 至20 μL。反应程序为95℃3 min ;95℃ 30 s,55℃ 30 s,72℃ 45 s,35 个循环,72℃ 5 min,4℃保存。对PCR产物进行检测定量,构建MiSeq文库后进行Illumina MiSeq PE300高通量测序。
1.2.4 土壤理化性质的测定 总有机质(Organic matter,OM)采用重铬酸钾容量法—外加热法测定;pH值采用电位测定法;全氮(total nitrogen,TN)采用半微量凯氏法测定[20-21]。速效磷(available phosphorus,AP)采用紫外 /可见分光光度计测定[22];速效钾(available potassium,AK)采用火焰光度计法测定[23];水解氮(hydrolyzed nitrogen,HN)参考采用碱解扩散法测定[24]。
1.2.5 数据分析 经高通量测序得到的双端序列经拼接与质控过滤得到优化序列,采用Usearch(vesion 7.0 http://drive5.com/uparse/) 进 行 OTU 聚类,对97%相似水平的OTU与Unite(Release 7.2 http://unite.ut.ee/index.php)数据库比对并进行OTU物种注释;采用mothur(http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity)指数分析软件计算样本α多样性指数;采用Welch t检验(Welch′s t test)对α多样性指数进行显著性差异分析;通过R语言及vegan软件包作Venn分析、PCoA分析、RDA分析及ANOSIM等分析;利用FUNGuild 对真菌进行功能预测分析;采用SPSS 21 对土壤理化性质进行显著性差异分析。
2 结果
2.1 真菌ITS测序结果和群落丰富度和多样性
通过MiSeq测序和质控后共得到6 841 071条优化序列,平均长度227 bp。按照97%相似性进行OTU聚类得到6 702个OTU。其中S组注释到15门60纲141目333科764属5 763个OTU,R组注释到14门60纲128目297科655属4 448个OTU,P组注释到11门60纲100目233科471属1 786个OTU。
Pan/Core物种分析用于判断样本量是否充足以及评估环境中总物种丰富度和核心物种数。物种Pan/Core曲线(图1)显示随着样本数的增加,曲线趋于平缓,说明样本量充足。川芎非根际土和根际土的总OTU和核心OTU的物种丰富度均高于根茎,非根际土的总OTU数高于根际土,而核心OTU数少于根际土。说明川芎非根际土具有较高的物种丰富度,而核心物种在根际土集中分布,川芎根茎的内生真菌丰富度均明显少于外界土壤。
真菌群落a多样性指数分析显示(表2),川芎非根际土、根际土及根茎真菌群落的Coverage指数大于0.99,说明测序结果能够反映出所测样本中真菌的真实情况。Ace指数和Chao指数显示R>S>P,Shannon even 指数、Shannon 指数 S>R>P,Simpson指数P>R>S;说明相较于川芎内生菌,土壤的真菌群落具有更高的丰富度、均匀度及多样性。而根际土相较于非根际土具有较高的物种丰富度,非根际土具有较高的物种均匀度和多样性。

图1 川芎非根际土、根际土真菌及内生真菌物种曲线Fig. 1 Species curves of bulk、rhizosphere soil and endophytic fungi in L. chuanxiong Hort.

表2 川芎非根际土真菌、根际土真菌及内生真菌的α多样性指数Table 2 α diversity indices of bulk soil, rhizosphere soil and endophytic fungi in L. chuanxiong Hort.
2.2 真菌群落物种组成
以相对丰度>1%的物种作为优势菌群,采Kruskal-Wallis秩和检验(Kruskal-Wallis H test)对其进行多组样本显著性差异分析。在门分类水平上,川芎非根际、根际及根茎内生真菌均主要以囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢菌门(Mortierellomycota)和罗兹菌门(Rozallmycota)为优势菌群(表3),且4 门优势菌在各样本类型中的相对丰度总和均达90%以上(S 90.71%、R 96.75%、P 98.94%)。4 门优势菌在各样本类型中的相对丰度菌达到显著性差异,其中子囊菌门(Ascomycota)为3 组样本类型的最优势菌群,其丰度占比从非根际到根茎内部逐渐逐渐增大,在根茎内生真菌中的占比高达90.05%;担子菌门(Basidiomycota)为第二优势菌群,其在非根际和根际中的相对丰度显著高于根茎内部;其余2 门优势菌被孢菌门(Mortierellomycota)和罗兹菌门(Rozellmycota)的相对丰度均为S>R>P。

表3 川芎非根际、根际及内生真菌优势门相对丰度Table 3 Relative abundance of dominate fungal communities in bulk soil, rhizosphere soil and endophytic fungi of L. chuanxiong Hort. at Phylum level
在属分类水平(表4),川芎非根际、根际及根茎内生真菌分别有20、24、11个优势属,其相对丰度的总和均大于90%(S 93.05%、R 93.84%、P 95.01%)。Phaeosphaeria、Sordariomycetes未 定属、Fusarium、Plectosphaerella 4属为3组样本共有的优势属。Mortierella、Fungi未定属、Saitozyma、Pleosporales未 定 属、Cladosporium 5个 属 为 非根际土与根际土中共有。Glomerellales未定属、Dactylonectria、Cercospora、Calophoma 4属为根际土与根茎中共有。非根际土与根茎中不存在共有优势属。此外,非根际土中测定到Beauveria、Zopfiella、Cercophora、Emericellopsis等11个特有优势属。根际 土 中 测 定 到 Gibberella、Cadophora、Botrytis等11个特有优势属。根茎中仅见Nectriaceae未定属、Rhizoctonia、Paraphoma 3个特有优势属。除Gibberella、Sordariomycetes未定属和Nectriacea未定属外,其他优势属的相对丰度在3组间具有显著性差异。Plectosphaerella和Cercospora在根茎中的相对丰度分别为50.80%和10.66%,显著高于非根土际和根际土。Phaeosphaeria在非根际土与根际土中相对丰度最高(分别为32.63%和20.33%),在根茎中却中仅占6.08%。
以OTU为分类单元作Venn图(图2),结果显示3组有1 324个共有OTU;川芎非根际土与根际土中有2 367个共有OTU;非根际土与根茎中有114个共有OTU;根际土与根茎中有166个共有OTU。非根际土中独有1 958个OTU,根际土独有591个OTU,根茎中独有182个OTU。
以相对丰度>1%的OTU作为优势物种,结果显示(表5)川芎非根际、根际及根茎中分别有14、19、8个优势物种,其相对丰度的总和皆大于90%(S 94.85%、R 96.51%、P 98.07%)。OTU715(2.76%)为根茎中独有;根茎中其余7个OTU可见于川芎根际土,且有6个OTU在根茎中的相对丰度高于根际土,其中OTU1565在根茎中相对丰度(50.21%)显著高于根际土(16.35%)及非根际土(1.65%),是 3组 唯 一 共 有 的 OTU;OTU1750、OTU4345、OTU2533、OTU2449为川芎非根际和根际中的共有OTU,OTU2449在根际的相对丰度(7.05%)高于非根际土(1.26%);OTU2533、OTU1750 和OTU4345在根际土中的相对丰度低于非根际土。
以上结果表明川芎非根际、根际及根茎皆含有丰富的真菌群落结构,不同的分类水平上,川芎非根际、根际及内生真菌皆由少数物种占据优势地位,且各优势菌在不同样本类型中分布具有明显差异,其中非根际土与川芎内生真菌的差异性最大,非根际土和根际土之间的差异性明显低于与川芎内生真菌的差异性。
2.3 真菌群落组间及产地差异
在OTU分类单元水平上,采用weighted-unifrac算法对样本进行PCoA、ANOSIM、距离heatmap分析。PCoA分析结果显示3组样本在PC1(45.93%)上分开,来自不同产区的同一样本类型聚在一个置信圈内(图3-A)。ANOSIM分析结果显示(图3-B)(R=0.839 2,P=0.001)3组样本的组间差异大于组内差异。样本距离heatmap图(图3-C)显示川芎非根际与根茎之间的真菌群落结构差异最大,根茎与根际土之间次之,非根际土与根际土的差异最小。以上结果显示,样本类型是影响川芎真菌群落结构主要因素,其中川芎非根际与根际、根际及根茎和非根际与根茎的真菌群落结构差异依次增大。

表4 川芎非根际土、根际土及内生真菌中优势属的相对丰度Table 4 Relative abundance of dominate fungal communities in bulk soil, rhizosphere soil and endophytic fungi of L.chuanxiong Hort. at genus level

图2 OTU单元下川芎非根际土、根际土及内生真菌的物种Venn图Fig. 2 Venn diagram of species in bulk soil, rhizosphere soil and endophytic fungi of L. chuanxiong Hort. at OTU level
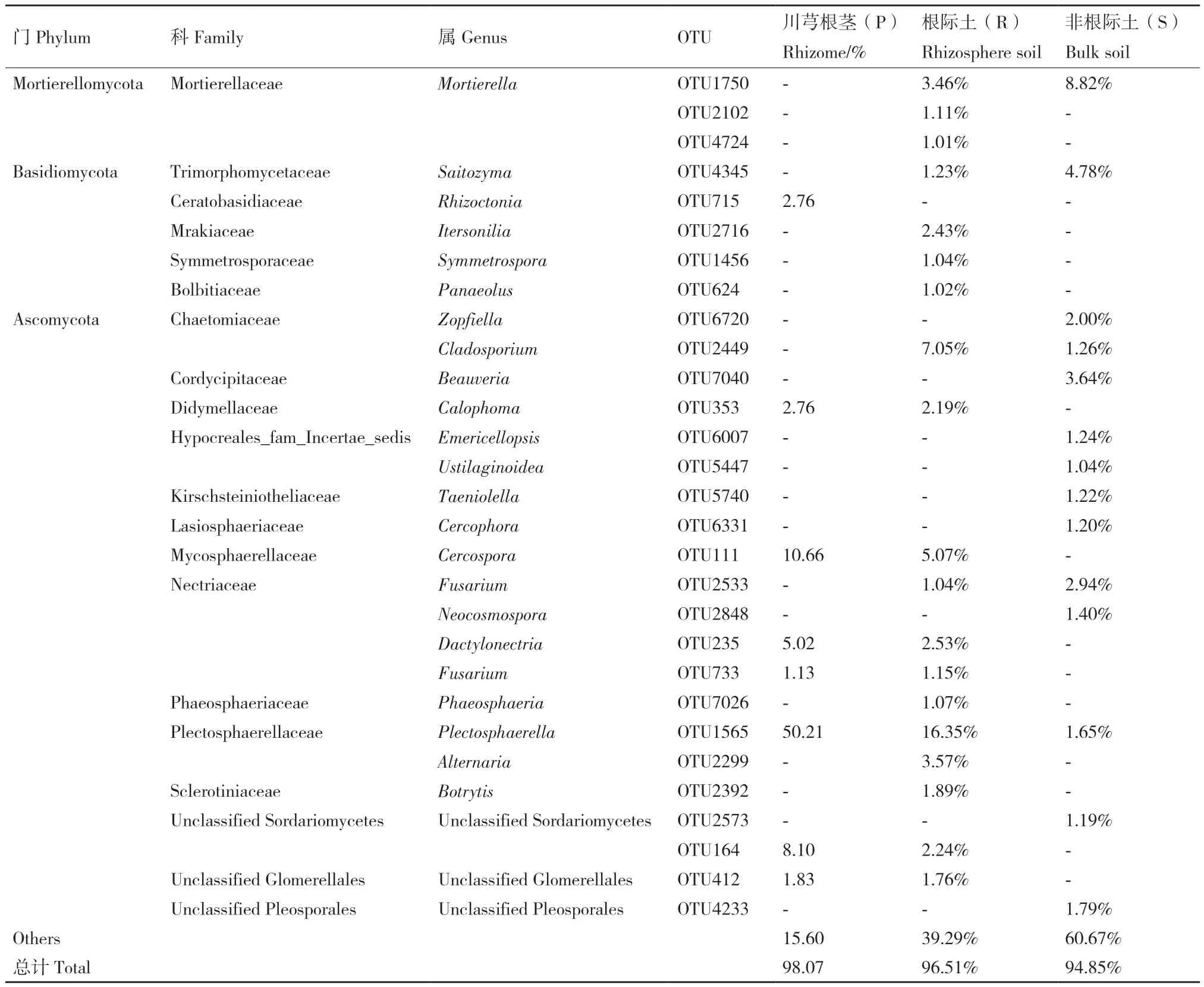
表5 川芎非根际土、根际土及内生真菌的优势物种(相对丰度>1%)相对丰度Table 5 Relative abundance of dominant fungal composition (Relative abundance > 1%) in bulk soil, rhizosphere soil and endophytic fungi of L. chuanxiong Hort. at OTU level

图3 川芎非根际土、根际土及内生真菌的物种PCoA分析(A)、ANOSIM分析(B)及距离heatmap图(C)Fig. 3 PCoA analysis (A)、ANOSIM analysis (B) and distance heatmap analysis (C) of fungal composition in bulk soil,rhizosphere soil and endophytic fungi of L. chuanxiong Hort.
以相对丰度排位前40的属作不同产地群落heatmap图(图4),结果显示,在非根际土中,来自传统道地产区都江堰的样品(SSY1、SSY2、SSY3、SSY4、SSY5、SSY6) 距 离 较 近 ;在 R组中,来自眉山的样品(RXW、RXJ、RYS)、来自都江堰的大部分样品(RSY1、RSY2、RSY3、RSY4、RSY5)分别相聚为1类;在P组中,来自都江堰的部分样品如PSY1、PSY2、PSY3、PSY6聚在一起,PSY4和PSY5聚在一起,眉山产区的样品聚类不整齐。由此可见,在同一样本类型中,传统产区都江堰的真菌群落存在较高的相似性;真菌群落结构体现不同程度的产地差异性,这种差异在非根际土中表现最明显,其次是根际土,川芎内生菌的产地差异性相对最小。
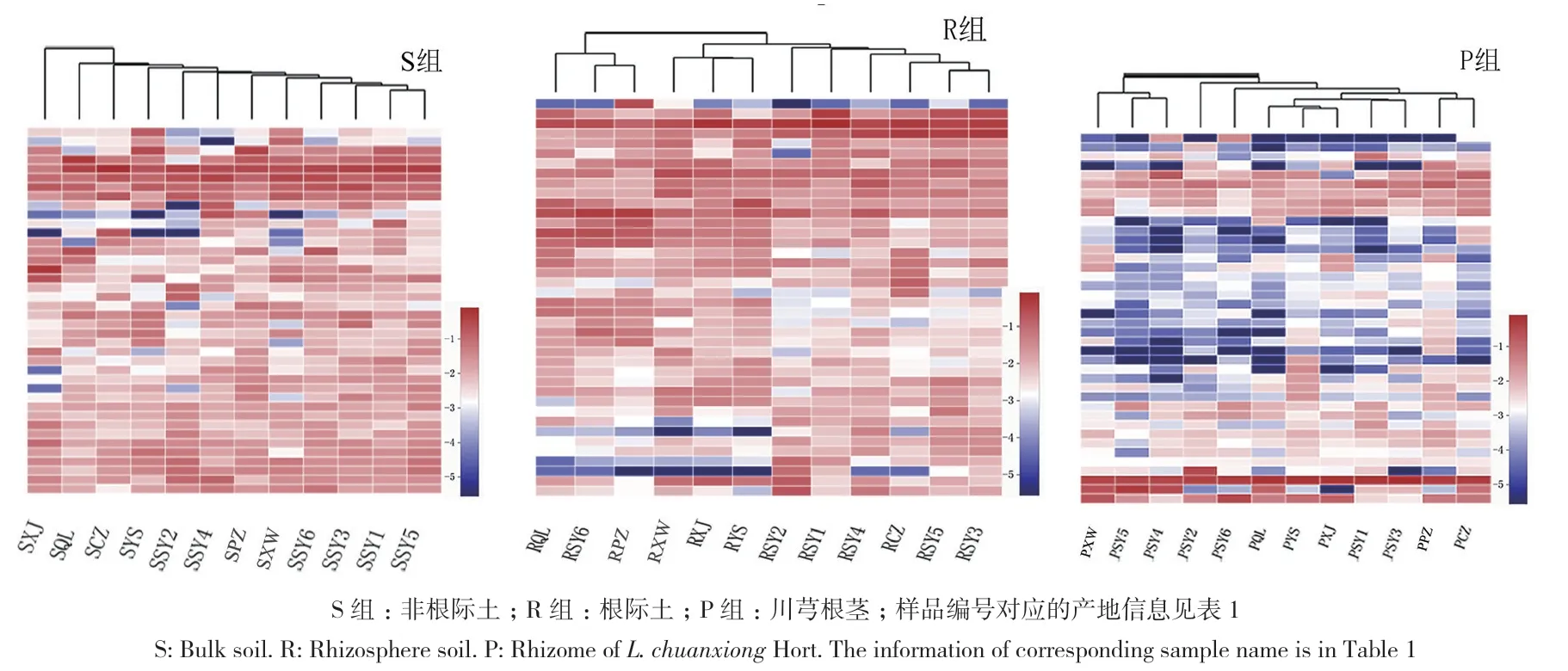
图4 川芎非根际土、根际土及内生真菌群落heatmap图Fig. 4 Heatmap of fungal communities in bulk, rhizosphere soil and endophyte in L. chuanxiong Hort.
土壤环境因子显著性差异分析显示(表6),在非根际土中,有效磷(AP)、有效钾(AK)、有机质(OM)和总氮(TN)具有显著性差异,而水解性氮(HN)和pH在各产区间无显著性差异。其中,有效磷含量以邛崃、眉山和石羊产区较高;邛崃产区有效钾含量显著高于其他产区,石羊产区最低;有机质以彭州产区最高,崇州和眉山产区最低;总氮以彭州、邛崃及石羊含量最高。RDA分析(图5-A)结果显示除总氮以外,其余5个环境因子对川芎非根际土真菌群落具有显著影响,眉山产区和和崇州产区与石羊产区在RDA1轴上分开,有效磷、水解氮和有机质为主要解释因子。邛崃产区和彭州产区与石羊产区分开在RDA2轴分开,pH值、有效钾和有效磷为主要解释因子。在根际土中,不同产区的水解氮、有效磷含量及pH值具有显著性差异(表7)。石羊、眉山及彭州产区的水解氮显著高于崇州和邛崃产区,石羊、眉山产区的有效磷含量显著高于其他产区;石羊、眉山及崇州的pH值高于彭州及邛崃。RDA分析(图5-B)结果显示,石羊(RSY6除外)和崇州产区的根际土真菌群落具有较高的相似性,与其余产区在RDA1轴分开。值得注意的是,仅有效磷和有效钾对川芎非根际土真菌群落具有显著影响。以上结果说明土壤理化性子对川芎非根际和根际真菌群落结构皆具有不同程度的影响,且对非根际真菌的影响较大。

表6 川芎非根际土壤环境因子及RDA分析结果表Table 6 Environmental factors of bulk soil of L. chuanxiong Hort. and db-RDA analysis

图5 川芎非根际、根际真菌与环境因子RDA分析Fig. 5 RDA analysis of bulk soil and rhizosphere soil fungi with environmental factors in L. chuanxiong Hort
2.4 真菌群落功能预测
采用FUNGuild对川芎非根际、根际及根茎内生真菌群落进行功能预测分析,置信水平仅选用probable和highly probable,以获得真菌生态营养型及各营养型在不同样本中的丰度信息。结果显示样本中的真菌类群主要预测得到病理营养型(pathotroph)、共生营养型(symbiotroph)、腐生营养型(saprotroph)、病理-腐生营养(pathotrophsaprotroph)等8个营养型(图6-A)。病理、共生、腐生、病理-腐生4种营养型的相对丰度较高,在S、R、P组中的相对丰度总和分别达到98.06%、97.01%和94.37%,为各样本的优势类群。其中腐生营养型(S>R>P)、病理营养型(P>R>S)在 3组样本中呈现相反的渐次性差异。
3组样本预测得到16个生态共位群,其相对丰度如图6-B所示,非根际土(S)中主要包括植物病原菌(plant pathogen,13%)、动物病原菌(animal pathogen,13%)、未定腐生菌(undefined saprotroph,33%)、粪腐生菌(dung saprotroph,13%)等共位群。根际土(R)主要以植物病原菌(plant pathogen,41.05%)、 未 定 义 腐 生 菌(undefined saprotroph,15.88%),凋落腐生-植物病原菌(litter saprotrophplant pathogen,5.33%)等共位群,主要分类单元分别为小不整球壳属(Plectosphaerella,36.28%)、帚枝霉属(Sarocladium,2.43%)、锁霉属(Itersonilia,5.33%)。内生真菌(P)中主要为病原菌功能群,其中相对丰度较高的生态功能群主要有植物病原菌(plant pathogens,71.74%),分类单元为小不整球壳菌属(Plectosphaerella,70.41%),余下为植物病原-未 定 腐 生 菌(plant pathogen-undefined saprotroph,14.78%)、真菌寄生-植物病原-植物腐生菌(fungal parasite-plant pathogen-plant saprotroph,2.02%)、兰花菌根-植物病原-木腐生菌(orchid mycorrhizalplant pathogen-wood saprotroph)。

图6 川芎非根际土、根际土及内生真菌的物种真菌功能预测分析Fig. 6 FUNGuild analysis of the fungi in bulk soil and rhizosphere soils and endophytic fungi of L. chuanxiong Hort.
3 讨论
川芎主产区的非根际土(S)、根际土(R)及根茎(P)的真菌群落结构之间的差异研究结果表明,子囊菌门、担子菌门等4门真菌为川芎内外环境的优势真菌,其中子囊菌门在内生真菌中占比高达90%,是川芎根茎内生菌群结构中为优势类群。在属水平和OTU水平川芎非根际土、根际土及根茎内生真菌均具有较高的物种多样性,但相对丰度>1%的物种仅占少数,其相对丰度总和却达到90%以上,说明川芎植株内、外环境均以少数真菌物种占优势,尤其在川芎根茎中,真菌各属的优势差异更加悬殊。赤霉菌属(Gibberella)、Cadophora 及链格孢霉属(Alternaria)等11个优势属在川芎根际土中的相对丰度高于非根际土和川芎根茎,小不整球壳菌属(Plectosphaerella)、尾孢属(Cercospora)及球腔菌属(Phaeosphaeria)等11个优势属在川芎内生真菌的总丰度中占比达95%,推测这几种真菌与川芎的生长发育可能存在着密切关系。其中小不整球壳菌属(Plectosphaerella)在川芎根茎内生真菌中占明显优势,功能预测该菌属于植物病原菌,另有研究发现表明,Plectosphaerella属真菌并非川芎植物特有,它在其他植物内具有生防作用[25-26]。因此,Plectosphaerella属在川芎生长发育中所起的功能作用还有待进一步研究。此外,球腔菌属(Phaeosphaeria)、小 丛 壳 目 未 定 属(Unclassified Glomerellales)、Dactylonectria、Calophoma等川芎内生真菌属为首次发现。
FUNGuild功能预测结果显示,非根际土、根际土及根茎内均含有较高比例的植物病原菌,尤其川芎内生菌中比例最高,推测这些无症状植株体内存在的致病菌在一定条件下并不引起发病,以潜伏状态或以条件致病菌方式生活在植物组织内部[27],这些真菌类群也可能具有其他的生理功能有待发现。研究结果中还含有一定比例未知功能的真菌类群,且有一定数量的真菌具有多个生态功能群,这可能因为FUNGuild数据库参照菌株较少,真菌功能预测的准确性在未来还有待提高[28]。
土壤微生物作为环境因子和地理因素的综合表现[29],可有效反映环境的综合生态环境,对中药材道地性的形成有着重要作用。本研究结果显示,从非根际土到根际土,再到川芎根茎组织内部环境,真菌的物种多样性、主要营养型、生态共位群、优势真菌属、同类型样本在不同产地之间的差异程度、环境因子对非根际土和根际土的影响效应等多个方面呈现出明显的渐次性增/减趋势。某些真菌在川芎根茎内中的富集和耗尽表明,植物可主动选择一些专职化真菌的定殖,而真菌群落结构可能不仅由植物单独引起,微生物间的相互作用也是重要原因[30]。前人研究显示川芎内生真菌具有一定的地域性,都江堰作为川芎传统道地产区,其微生物具有较高的丰富度及稳定性[31],这些菌群与宿主植物之间可能形成了相对稳定的共生关系,因此内生菌群结构受宿主的影响明显大于土壤对其的影响。本研究中所涉及的6个环境因子对土壤真菌群落的影响有限,说明还有其他重要的影响因子有待继续探索。气候因素、植被类型、土壤特性等对土壤真菌群落具重要影响[32],根际土真菌群落除了受土壤本身影响外,还受植物类型及其基因型的影响[33],根茎作为特化性更强的环境,对真菌群落具有更强的选择性。因此,从非根际土壤,到根际土壤,再到根茎内,微生物菌群的地域差异性也在不断缩小。
4 结论
(1)川芎土壤及其根状茎中具有丰富的真菌群落多样性和功能多样性,而根际土比非根际土具有更高的物种丰富度,非根际土比根际土具有更高的物种均匀度和多样性;(2)川芎土壤及其根状茎中仅有少数真菌类群表现优势效应,且优势真菌类群的相对丰度具有较大组间差异,川芎及土壤中存在的特有优势类群及有差别的优势类群,作为潜在的微生物资源或可能的药用植物品质调控外因,值得深入研究和利用;(3)真菌群落的物种多样性、主要生态功能群及产地差异性在非根际土、根际土与川芎根茎之间都呈现出明显的渐次变化规律,证明川芎在栽培过程中,川芎植株从产地土壤中获得部分物种并发生了连续积累或消减,形成特定的内生菌群,一方面表明三者之间存在菌群的横向联系,另一方面也表明,微环境特化程度越高(如宿主川芎内部环境),对微生物的选择性和富集性越强,这为理解中药道地性品质形成提供了科学参考。

