雏鹅肾脏肿胀综合征的诊断与治疗
韦玉勇 徐 步 张兰琴 张 斌 沈欣悦 龚建森 俞 燕 吴 坤 董永毅*
1.江苏省家禽科学研究所,江苏扬州225125;2.江苏省扬州市江都区畜牧兽医站,江苏扬州225200;3.江苏省扬州市畜牧兽医站,江苏扬州225000;4.江苏省动物疫病预防控制中心,南京210036
2015年下半年开始,江苏多家养殖企业的雏鹅出现一种以拉白色粪便、腿脚瘫痪为主要症状的高发病率与病死率疾病,造成严重经济损失。初步诊断确定为雏鹅肾肿综合征(俗称鹅痛风病),通过实验室病原分离鉴定、动物回归试验,确诊为由鹅星状病毒继发大肠杆菌感染,及时采取治疗措施后有效控制了疫情。
1 发病情况及病史调查
经调查得知,江苏省内的扬州鹅、泰州白鹅、大三花及其杂交品种鹅苗在大规模育雏阶段,饲喂全价配合饲料5~7 d 后,约60%的鹅群出现弓背、缩头、怪叫、拉白色粪便等症状;初期病程急且死亡率较高,后期常出现关节肿胀、跛行、瘫痪,总体死淘率呈逐年升高趋势,最高近30%;发病鹅群一般在1日龄、4~5日龄采取小鹅瘟抗体注射。有部分养殖企业曾用星状病毒抗体预防,也有部分养殖场用小苏打、双尿酸钠饮水对症治疗,但效果不显著[1]。
2 临床症状
雏鹅发病初期表现为弓背缩头、行动迟缓、蹲伏、不愿走动(图1A),有的甚至瘫痪(图1B),精神沉郁,食欲减退,羽毛蓬乱,排灰白色水样稀粪或石灰渣样粪便(图1C)。随着病程发展,出现趾跗关节肿胀、突出(图1D),部分伴有发热。本病病程通常7 d 左右,病情严重者可达10 d 以上。一旦有混合或继发感染,症状更为复杂并出现批量死亡。

图1 临床症状
3 病理变化
病死雏鹅剖解病变可见:心脏表面尿酸盐及絮状物沉积、部分雏鹅心包积液或绒毛心(图2A),心肌增生肥大、心脏血管充盈(图2B);肝脏表面尿酸盐沉积,质地变脆(图2C);肾脏极度肿胀、出血,形成典型花斑肾,两侧肾小管里面有大量尿酸盐沉积(图2D);部分病死鹅在肌肉组织、关节组织(图2E)、肠腔及腹膜上有广泛性尿酸盐沉积(图2F);严重病例可见腺胃内尿酸盐广泛沉积(图2G)。

图2 病理变化
4 实验室诊断
4.1 细菌分离与鉴定
选择肾脏病变典型的雏鹅脑组织样品,无菌条件下取脑组织分别接种于普通营养琼脂、麦康凯培养基,置37 ℃培养24 h。临床多份脑组织样品在麦康凯培养基上呈现圆形隆起、边缘整齐、表面光滑、大小不等的红色菌落。
对分离的细菌采用革兰氏染色镜检,可见两端钝圆、革兰氏阴性、无芽孢的小杆菌、符合大肠杆菌形态特点;生化试验结果显示,其能发酵棉子糖、山梨醇、葡萄糖并产生气泡,能利用硝酸盐,不能利用尿素、枸橼酸盐(表1)。判定分离菌为大肠杆菌。
表1 4 株分离菌生化反应结果
针对分离的多株大肠杆菌,结合临床用药实际,筛选部分药物进行药敏试验[2],其药敏结果显示,分离菌株对头孢噻呋钠、大观霉素高度敏感,宜作为治疗时首选药物;对强力霉素、黏杆菌素低敏(表2)。

表2 药敏试验结果
4.2 病毒分离与鉴定
将采集的有典型病变雏鹅的肝、肾等组织样品,研磨成匀浆后反复冻融3 次,离心取上清,0.22 μm 滤器除菌后,将滤液分成2 份待用,一份用于病毒分离,另一份用于相关病毒PCR 检测。
1)病毒分离。取组织样品滤液经卵黄囊途径接种10 枚10日龄鹅胚,置37 ℃温箱孵育,连续观察5~10 d,收集尿囊液,病变明显的尿囊膜和组织脏器研磨并混匀。收获的组织处理液继续接种10日龄鹅胚,连续盲传至第4 代。在第3 代开始发现胚体死亡,绒毛尿囊膜增厚并附有尿酸盐沉积(图3A),胚体发育不良伴有水肿、出血,剖检胚体发现肝脏呈现土黄色、斑块状出血(图3B);个别胚体肾脏苍白、双侧输尿管尿酸盐轻度沉积。
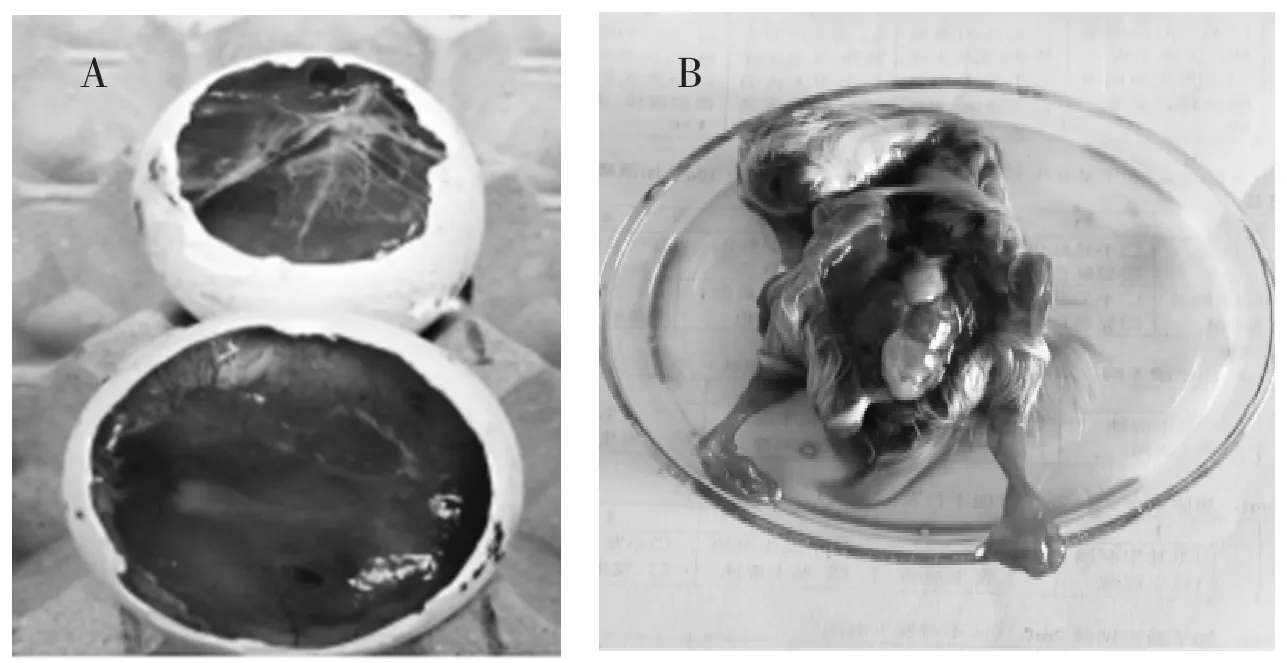
图3 鹅胚病变
2)RT-PCR 检测。取接种前处理组织样品1 份、接种后处理组织样品1 份,分别抽提RNA 并反转录为cDNA。根据GenBank 上已发表的鹅星状病毒(GAstV)的ORF1 基因序列,使用Primer5.0 软件设计1 对特异性鉴定引物,引物序列如下:上游引物F:5'-GATTGGACCCGTTATGATGG-3',下游引物R:5'-TTTGACCCACATACCAAAGAC-3',用于扩增鹅星状病毒ORF1b 约435 bp 的片段[3]。对组织样品cDNA 进行PCR 扩增检测,结果发现,经鹅胚接种后的组织样品显示较强星状病毒特异性引物扩增条带(图4)。检测结果表明,样品中存在星状病毒,由此推断患病鹅群感染了鹅星状病毒。

图4 鹅胚组织样品PCR 检测结果
4.3 动物回归试验
为了解分离的病毒是否为引起雏鹅发病的病原,从未发生雏鹅痛风病的种鹅场购买了20 只已接种小鹅瘟抗体的健康苗鹅,随机分为A、B 两组,每组10 只。A 组经肌肉接种0.5 mL 发病雏鹅病毒分离尿囊液,B 组作为对照组不作处理。接种后分别隔离饲养,观察14 d。
A 组苗鹅接种后,前5 d 精神、食欲正常,第7天开始陆续表现出减食、拉白痢、弓背、关节肿胀等雏鹅肾肿综合征自然病例类似的早期症状,并死亡2 只,第10、11 天各死亡3 只,死亡苗鹅剖检后发现关节囊、心肌表面、腹膜、肾脏等部位有广泛性尿酸盐沉积;同时伴有肾脏肿胀及输尿管尿酸盐沉积等病变。无菌采集攻毒后死亡苗鹅病料,按常规方法处理后经卵黄囊途径接种10日龄鹅胚,收取死亡鹅胚的尿囊液,经RT-PCR 检测鹅星状病毒阳性。B 组鹅苗在隔离饲养期间一切正常,RT-PCR 检测阴性。
5 治疗措施
根据患鹅的临床症状、剖检病变,结合实验室相关诊断,对临床类似病例初诊疑为鹅星状病毒感染诱发雏鹅肾肿综合征。在发病初期一般可采取全群对因注射抗病毒、对症口服中药或二者结合方案的抗病毒治疗方案[4-8]。
1)方案一:50 万IU/瓶干扰素按200 羽/瓶剂量、2 mg/mL 反义核酸按0.2 mL/羽剂量、2 000 羽/瓶白介素按200 羽/瓶剂量、1 g 头孢噻呋钠按100 kg体重剂量和匀配合鹅星状病毒高免抗体肌注2.5 mL/只,隔日视情况复注1 次;禽用口服补液盐快速饮水,连用3~5 d;柴胡护肝颗粒+车钱草提取物饮水,连用3~5 d。
2)方案二:双黄连注射液1 mL/kg,头孢西丁1 g/100 kg,地塞米松0.05 mg/kg,混合均匀后肌注。隔日观察,必要时复注。
3)方案三:干扰素配合白介素混合饮水250 羽/套,2~3 h 用完;痛星舒散方剂(主药:黄芪、枳壳)拌料500 g/80 kg 料,全天使用,连用4~5 d;速控痛星舒(主药:金银花、茵陈、车前草、泽泻、牛膝)方剂饮水(1 000 只鹅/500 g),连用4~5 d;晚上结合禽用口服补液盐(主要成分为双乙酸钠)饮水,200 g/300 kg,连用5 d。
积极采取上述治疗方案,同时降低饲喂日粮蛋白水平,有目的地降低嘌呤代谢水平。加强对鹅群动态观察,及时隔离发病患鹅或淘汰无治疗价值的患鹅;调节适宜育雏温、湿度;适当降低日粮蛋白水平[8-9],增饲青料,减少夜间饲料投喂;有条件时加强户外运动。加强消毒防范措施,对鹅舍和活动场地进行喷雾消毒,早晚各1 次。
6 结果与分析
针对雏鹅肾肿综合征发病初期采取上述治疗方案或措施,一般2~3 d 后鹅群健康状况总体有所好转,第5 天精神状态恢复、偶发零星死亡,第7 天临床症状完全消失,饮水、采食恢复至正常水平。据统计,2019年2月-2020年6月临床共诊治86 例雏鹅肾脏肿胀综合征,治愈率达85%,说明药物的使用可以有效抑制或减缓本病在鹅群进一步发生与发展。对于本病中后期患病鹅群疗效有待进一步评估与分析。在雏鹅肾肿综合征高发病区域应慎重采取注射式治疗方案,在病情判断不明时,不当使用易诱发雏鹅大量死亡,建议采取中药对症、对因治疗方案。对鹅养殖量较大的肉鹅场,建议在育雏阶段采取早期药物投饲与饲养管理相结合的方式加强对本病的防控。后期跟踪调查显示,发病鹅群经治愈后生产性能略受影响,一般推迟5~7 d 出栏,推测为雏鹅发病期间饲料摄入量不足而引起。
7 小 结
雏鹅肾脏肿胀综合征在江苏省内呈现流行性态势,该病的发生、发展及其危害日趋加重,影响了全省鹅产业持续性发展、提质增效进程。为确切了解该病发生情况,摸清发病原因,寻找防治方案,在江苏省内展开了针对本病的流行病学调查工作,重点调查分析疫病分布、流行特点、发病原因。通过调查研究得出如下几点意见,供业界同仁参考:①无序种源杂交可能是诱发本病的源头[3];②苗鹅频繁被动免疫存在人为传播的风险和速度;③种鹅发生黄病毒病与雏鹅发生本病存在直接或间接联系;④部分炕孵业种蛋来源不确定性增加本病防控难度;⑤现有商品鹅生产模式与方式促进了本病的传播;⑥育雏鹅料营养水平有待进一步研究[9];⑦密切关注大日龄鹅发病情况,警惕隐性感染。

