肾功能不全对急性缺血性卒中患者发病4.5 小时内静脉溶栓 治疗效果的影响
朱 凯,曾光豪,曹 华
(同济大学附属第十人民医院急诊医学科,上海 200072)
重组组织型纤溶酶原激活剂(Recombinant tissuetype plasminogen activator,rt-PA)静脉溶栓(Intravenou s thrombolysis,IVT)是目前治疗急性缺血性卒中(Acute ischemic stroke,AIS)唯一有效的方法[1]。大约三分之一的AIS 患者合并肾功能不全(Renal dysfunction,RD),定义为肾小球滤过率(eGFR)低于60 mL/min/1.73m2。由于血小板功能不全和凝血功能异常,RD 患者有较高的自发性脑出血风险[2]。因此,是否对伴有RD 的AIS患者进行IVT 仍有争议,因为与RD 相关的症状性脑出血(symptomatic intracerebral hemorrhage,SICH)风险增加可能会减弱甚至超过IVT 的益处[3]。以前的随机对照试验和西方主要指南均未将RD 作为IVT 的禁忌症[4]。然而,日本指南指出,对于患有“严重肾功能紊乱”的卒中患者,IVT 应谨慎使用[5]。此外,一项观察性研究表明,与没有接受IVT 治疗的AIS 患者相比,接受IVT 治疗的AIS 患者RD 的不良预后风险增加了约50%[6-7]。因此,阐明RD 是否会影响AIS 患者IVT 的有效性很重要。本研究旨在探讨RD 对卒中患者发病后4.5 小时内IVT 治疗的预后影响。
1 资料与方法
1.1 一般资料 对本院急诊科2017 年5 月~2020 年3 月连续接受静脉rt-PA 治疗的AIS 患者进行回顾性分析。纳入标准:(1)年龄≥18 岁;(2)根据临床表现和体征结合头颅计算机断层扫描和/或磁共振成像诊断AIS,并在症状出现后4.5 小时内按照指南[8]接受静脉注射rt-PA(0.9 mg/kg,最大剂量90 mg);(3)提供了详细的病史和用药史。排除标准如下:(1)24 小时内接受桥接治疗或手术/分流减压的患者;(2)入院时eGFR数据缺失、治疗前严重残疾(定义为病前改良Rankin 量表[mRS]评分≥3)或3 个月时mRS 评分数据缺失的患者。
1.2 临床资料收集 收集所有患者的以下变量:年龄、性别、使用NIH 卒中量表(NIHSS)评估的初始卒中严重程度、卒中症状发作至治疗时间、先前使用抗血栓药物的治疗以及卒中险因素包括高血压、糖尿病、心房颤动、高脂血症、卒中或短暂性脑缺血发作史以及吸烟。采用改良Rankin 量表(mRS)通过临床随访或电话评估3 个月时的功能结果。所有患者在治疗前和治疗后24~36 小时进行脑部CT 扫描。根据简化的慢性肾脏病流行病学协作方程计算eGFR:eGFR(mL/min/m2)=144×(SCr/0.7)-0.329×(0.993)年龄(适用于女性且SCr ≤0.7mg/dL);eGFR=144×(SCr/0.7)-1.209×(0.993)年龄(适用于女性且SCr>.7mg/dL);eGFR=141×(SCr/0.9)-0.411×(0.993)年龄(适用于男性且SCr ≤0.9 mg/dL);eGFR=141×(SCr/0.9)-1.209×(0.993)年龄(如果男性且SCr>0.9 mg/dL)。计算得到的eGFR 小于60 mL/min/1.73m2视为具有临床意义的RD[9]。
1.3 结局指标 主要转归是3 个月时出现不良转归(mRS 评分为3~6 分)或死亡。次要转归接受IVT 治疗患者出现SICH,所有患者在IVT 后24 至36 小时内都接受了计算机断层扫描或磁共振成像。SICH 是根据美国国家神经疾病和卒中研究所rt-PA 试验中使用的标准定义的:最初36 小时内新脑出血的计算机断层扫描或磁共振成像证据,与基线NIHSS 评分相比增加了1分以上。
1.4 统计分析 连续变量被描述为平均值±标准差或具有四分位间距的中位数(IQR)。使用学生的t 检验或Mann-Whitney U 检验分析组间差异。分类变量被描述为频率和百分比,并使用皮尔逊卡方检验或Fisher精确检验进行比较。多因素logistic 回归分析用于评估IVT 和RD 的影响以及它们之间的相互作用对主要结局的影响。数据分析软件采用SPSS 21.0,双尾P 值<0.05具有统计学意义。
2 结果
2.1 脑卒中合并和不合并RD 患者的基线特征 在症状出现后4.5 小时内入院的477 名连续卒中患者中,93 名患者有资格进行后续分析,其中36 名(39%)患者有RD。年龄65±11 岁,男性63 例(68%),发病时间中位数(IQR)为75(40~130)分钟,eGFR 中位数(IQR)为66(52~83 mL/min/1.73m2)。有或无RD 患者的基线特征和结果如表1 所示。与非RD 组相比,RD 患者年龄显著增大(P<0.05),高血压、心房颤动、既往卒中和抗血栓治疗人数较高(P<0.05),发病至到院时间缩短(P<0.05),以及NIHSS 评分更高(P<0.05)。
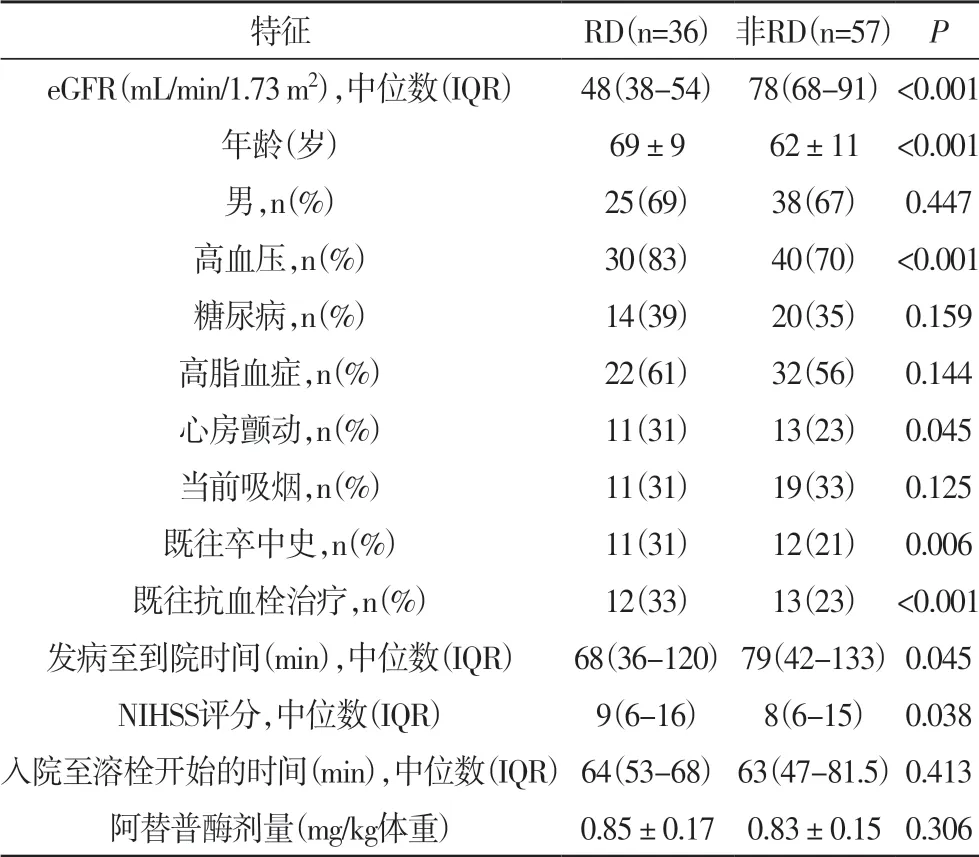
表1 脑卒中合并和不合并RD患者的基线特征
2.2 脑卒中合并和不合并RD 患者的结局比较 在3个月的随访中,RD 组患者的mRS 评分高于非RD 组患者[中位数(IQR);5(2-5)vs. 2.5(1-5),P< 0.05]。3个月时,RD 组患者的不良转归(75%,27/36)和死亡率(28%,10/36)明显高于非RD 组(分别为49%(28/57)和16%(9/57))(P<0.05)。同样,RD 组预后良好率(mRS为0-1)(19%,7/36)显著低于非RD 组(44%,25/57)(P<0.05)。RD 组和非RD 组间SICH 发生率比较无统计学意义(3% vs. 7%,P=0.323)。
2.3 结局指标的相关因素分析 在单变量分析中,eGFR 每降低10 mL/min/1.73 m2,不良转归(OR=1.19,95%CI=1.09-1.30)和死亡(OR=1.18,95%CI=1.06-1.32)的风险显著增加(表2)。在多变量分析中,将所有单变量分析中P<0.1 的变量调整到模型中。调整后,RD(eGFR<60 mL/min/1.73 m2)仍与不良转归相关(OR=2.15,95%CI=1.01-4.56,P=0.045),但与死亡率之间不相关(OR=0.625,95%CI=0.34-1.14,P=0.215)(表3)。

表2 患者临床特征的单因素分析。
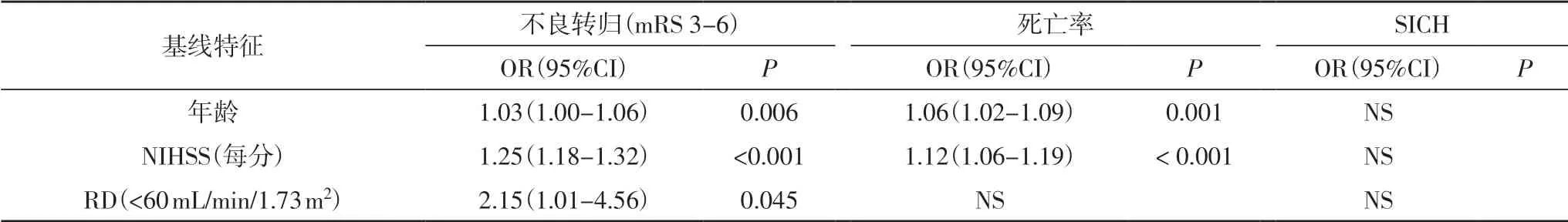
表3 主要结局的多变量分析
3 讨论
本研究发现,在接受静脉注射rt-PA 的患者中,RD与3 个月随访的不良转归独立相关。以前关于RD 与不良转归风险之间关系的报道相互矛盾[4-7]。这可以解释为这些研究使用了不同的肾损害分类、不同的不良结局评分定义、不同的随访评估时间段、不同的研究对象基线特征以及不同的肾功能评估方法。随着eGFR的逐渐下降,死亡和残疾的风险增加。最近,Hao 对7796 名卒中患者进行的meta 分析表明,RD 会增加接受溶栓治疗的患者预后不良的风险[10]。此外,Bhat 在一项大规模的基于人群的研究中评估了1120295 名成年人,结果显示,eGFR<60 ml/min/m2的受试者发生心血管事件的风险和死亡率急剧上升[11]。
决定卒中后结果与肾损害影响之间联系的机制尚不清楚。体外研究表明,患有严重肾脏疾病的患者会产生纤维蛋白凝块,这些凝块更紧密,更不易渗透以及被纤维蛋白溶解[12]。在这项研究中,RD 与SICH 的风险增加无关。类似的结果在大多数相关研究中都有报道[13]。在Huhtakangas 等对11 个欧洲卒中中心4780 名接受IVT 治疗的患者进行的评估显示,eGFR 低的患者的SICH 发生率较高;但在多变量logistic 分析中,SICH发生率并不显著[13]。根据本研究的结果,结合其他研究,RD 患者IVT 后预后不良率较高可能与SICH 的发生无关。RD 与常见的血管危险因素有关,包括衰老、高血压、糖尿病、血脂异常和吸烟。此外,发病率和死亡率通常可归因于其他原因,如心脏病和感染易感性[14]。
虽然这项研究在设计上是回顾性,无法证明因果关系;但是结果表明RD 是接受静脉注射rt-PA 患者长期预后不良的独立危险因素,因此在将来的研究中可能被认为是一个重要的危险因素,甚至用于制定相关的指导方针。临床医生必须在急性卒中情况下迅速行动,以实现有效和早期再通。因此,基于eGFR 评估肾功能是一种快速实用的IVT 候选患者检测方法。对急性脑卒中患者而言,调查蛋白尿是一项有效但耗时的检查,可在IVT 后数小时或数天内考虑。在进一步的研究中,应分析eGFR 引起的蛋白尿。
总之,在接受IVT 的急性卒中患者中,RD 与3 个月时卒中不良结局风险增加相关。

