上尿路尿路上皮癌的临床治疗进展
蔡孟会,刘峰,葛波
(桂林医学院第二附属医院泌尿外科,广西 桂林 541199)
0 引言
尿路上皮癌(Urothelial carcinoma,UC)是第四大恶性实性肿瘤,也是泌尿系统最常见的恶性肿瘤[1]。UC最常见于膀胱尿路上皮癌(urothelial carcinoma of the bladder,UCB),而上尿路尿路上皮癌(upper tract urothelial carcinoma,UTUC)只占5-10%,据统计,其每年发病率约1-2/10万[2];在中国台湾地区,UTUC发病率要高于这一比例,其占该区域UC病例的20-25%[3]。在近几十年里,由于诊断技术不断改进,UTUC的发病率呈现上升趋势[4]。与其他人种相比,被诊断为UTUC的亚洲人的肿瘤分期及分级更高[5]。
UTUC发生于肾盂及输尿管,其中,原发于肾盂的肿瘤是输尿管的两倍[2]。60%的UTUC患者初诊时就已发生肌层浸润,这要远比UCB高(15-25%)[4]。肌层浸润性UTUC患者预后极差,T2/T3期患者5年生存率低于50%,而T4期<10%[6]。与UCB相比,除了原位癌,UTUC患者预后更差[7]。由于UTUC与UCB存在一些相似之处且其发病率低,因而长期以来的UTUC治疗方案,是采用基于UCB收集的证据的临床决策。但近年来,研究表明这两种实体肿瘤在病因、分子及病理特征等方面存在差异,需要采取不同的治疗措施[8]。本文基于国内外学者对UTUC的临床研究进行综述,单独谈论其系统治疗(外科手术、化疗、放疗及免疫治疗),为UTUC临床治疗提供参考。
1 上尿路尿路上皮癌的系统治疗
1.1 根治性肾输尿管切除术
目前,欧洲泌尿外科指南指出[9],将UTUC依据相关风险因素分为高危和低危UTUC(如表1)。根治性肾输尿管切除术(radical nephroureterectomy,RNU)联合膀胱袖状切除术是高危UTUC的一线术式,如此可减少输尿管远端及其膀胱开口肿瘤复发风险,而且已有研究表明,在膀胱袖不完全切除的情况下,残余输尿管残端/输尿管周围道区肿瘤复发的风险为30-64%[10]。此外,RNU对转移性UTUC的作用是控制症状(如解除肠梗阻及控制出血等)。
RNU的方式有多种,主要包括开放术式、腹腔镜术式及机器人术式,其中腹腔镜方式衍生出多种手术入路。
开放术式需切除患侧肾脏、全程输尿管及输尿管末端开口的一部分膀胱壁组织,可采取单切口(腰部)或双切口(腰部联合下腹部)进行操作。但此术式创伤大、术中出血量大、围术期手术并发症较多、住院周期长以及患者术后舒适度较差。
随着腹腔镜技术不断的发展,腹腔镜术式在一定程度上解决了开放术式的弊端。Favaretto等[11]回顾性分析发现两种术式对UTUC患者的无进展生存率及CSS无差别;另一项回顾性研究(80例非转移性UTUC患者)表明[12],开放和腹腔镜术式在无转移生存率和CSS方面无差异;Hanske等[13]回顾性分析发现开放与腹腔镜术式对患者生存影响无差别,但后者可减少血栓栓塞及输血事件,并缩短患者住院时间;然而,在T3期或者高级别UTUC人群中就发生了变化,与腹腔镜术式相比,开放术式显著改善了患者的无转移生存率和CSS[14]。基于这些发现,对于晚期患者,建议选择开放术式。此外,国外报道发现腹腔镜术后发生腹膜的种植转移和沿套管转移高达2.8%[14],因此,选择此术式需注意防治这类事件出现。
RNU的腹腔镜术式包括多种入路(经腹腔和经后腹腔)。由于不进入腹腔,经后腹腔入路切除肾及输尿管可减少对胃肠道的刺激以及腹腔的种植转移[14],经腹腔入路操作空间较大,可缩短手术时间[15]。近年来,泌尿外科医师更倾向于选择腹腔后入路[16]。与腹腔后入路相比,改良经腹腔入路(经脐单孔腹腔镜入路)的出现,减少了切口数目、减轻了对腹壁的损伤,同时患者获得了更好的舒适度,尤其是女性患者,腹部更美观[17,18]。
基于目前的研究现状,UTUC首选腹腔镜RNU,但从患者长期生存考虑,晚期患者应首先考虑开放手术,这还需前瞻性临床随机研究来证实这一现象;关于腹腔镜入路的选择,目前的回顾性报道暂未发现三种入路对患者的生存影响有差异,因此,在没有高质量前瞻性临床研究的支持下,临床医师可根据患者的肿瘤解剖位置而选择。
膀胱袖状切除的方式主要是经膀胱(膀胱腔内切除)、经尿道内镜和膀胱外入路[10]。Li等[19]单中心回顾性分析发现上述三种处理输尿管末端的方式对患者的肿瘤结果无明显差异;Walton等[16]回顾性分析138例UTUC患者发现,内镜下处理输尿管末端和开放术式具有相同的肿瘤学结果,并且前者减少了手术时间,而对于低位输尿管肿瘤,内镜术式应保证切缘阴性;而Xylinas等[10]多中心回顾性分析发现,经尿道内镜入路处理输尿管末端的方法出现膀胱内肿瘤复发的风险比其他两种术式明显高;Lai等[20]最近的meta分析发现,与其他两种术式相比,经膀胱入路能改善患者的肿瘤学结果。欧洲泌尿外科协会指南指出三种术式均可使用,但不建议行输尿管剥离术[21]。未来尚需更多高质量前瞻性临床随机试验来证实三种术式的效果。
在现代,机器人手术技术得到迅速发展,已应用于多种肿瘤。Veccia等[22]meta分析发现,在患者肿瘤学结果方面,机器人技术与其他术式无明显差异,但机器人技术缩短了患者住院时间;王晨阳等[23]回顾性分析44例均经机器人手术的UTUC患者发现,此技术便于术者操作,减少了术中及术后并发症。目前,关于机器人技术的报道较少,缺乏长期随访数据,还有待进一步研究明确机器人技术对UTUC患者的效果。
1.2 淋巴结清扫术
区域淋巴结侵犯是UTUC最常见的转移事件[24],淋巴结清扫术(Lymphadenectomy,LND)对膀胱癌作用已被证实,而对于UTUC尚未明确。Dong 等人[25]利用SEER数据库研究发现LND可显著改善淋巴结阴性(N0/NX)的肌层浸润性UTUC(T2-4期)患者的生存结局;曾志华荟萃分析也发现LND对肌层浸润性UTUC的生存有利[26]。2018年欧洲泌尿外科协会UTUC指南建议浸润性UTUC(≥T2期)进行LND[20]。然而,这些研究结果均是基于回顾性分析得出的,尚需进一步前瞻性随机对照试验来证实。对于高危患者,临床医师可考虑LND,但低危患者需慎重,以免降低患者的生活质量。
1.3 保肾术
保肾手术可降低对患者肾功能的损害,并减少了RNU所致的心血管疾病等手术并发症[19]。最初,此术式主要用于无法行RNU的患者或一些特定人群(解剖或功能上的孤立肾,肾功能严重损害或双侧肿瘤)[3];目前,保肾术式被推荐[27]应用于低危UTUC人群(见表1)。Seisen等[28]研究发现保肾手术和RNU对这类人群的肿瘤学结果相似。
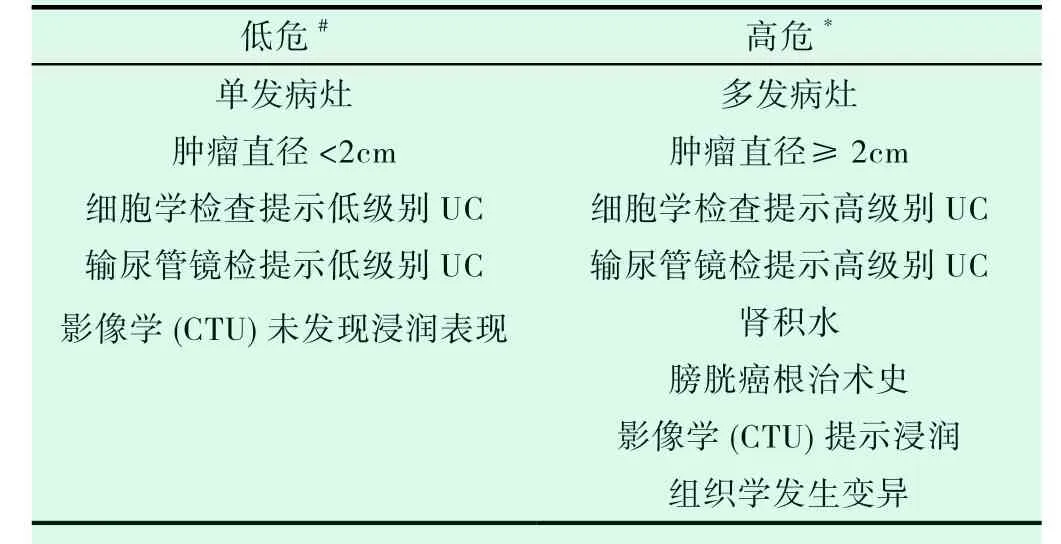
表1 UTUC患者危险分层
保肾手术包括内镜(输尿管镜和经皮肾镜)手术及输尿管节段切除术(开放和腹腔镜)。据报道,内镜技术出现肿瘤播散的风险较大[29];在病理分期及LND方面,输尿管节段切除术更有优势[28]。目前,指南[30]推荐远端低风险输尿管肿瘤及部分需行保肾术的高危UTUC(孤立肾)患者选择输尿管节段切除术。但对于上段和中段输尿管,内镜技术突显优势,此外,尚无报道表明肾或肾盂部分切除术治疗UTUC[20]。目前,指南关于保肾术式的选择尚未达成共识,因此,临床医师可根据肿瘤的解剖特点而选择合适的术式。
1.4 化疗
1.4.1 术后膀胱灌注
由于UTUC术后易复发膀胱肿瘤(风险为22%-47%),建议患者RNU术后常规行膀胱灌注化疗[31]。之前的随机临床试验和meta分析证实了膀胱灌注对UTUC的作用,结果显示,RNU后72小时内单次注射丝裂霉素C可使术后1年内膀胱肿瘤复发的风险降低52%[32,33]。因此,UTUC患者术后应常规进行膀胱灌注,特别是高危患者。
1.4.2 新辅助化疗
基于顺铂方案新辅助化疗对肌层浸润性膀胱癌患者的作用已被证实[34],但目前还没有前瞻性的随机试验证实新辅助化疗对UTUC的作用,而且国家综合癌症网络指南也未推荐新辅助化疗应用于UTUC[35]。Kubota等[36]多中心回顾性分析发现基于铂类方案新辅助化疗对局部晚期(T3/T4期或淋巴结阳性)UTUC患者无病及肿瘤特异性生存率有益;Li 等[37]meta分析发现新辅助化疗可改善高危UTUC患者的病理分期及生存率。欧洲泌尿外科协会指南总结多数回顾性分析研究指出,含顺铂的化疗方案对晚期UTUC的总体生存率和无病生存率有益,但这一推荐主要是基于膀胱癌的数据而提出的[27]。至今为止,关于UTUC的新辅助化疗报道比较少见,特别是前瞻性临床研究,这可能源于UTUC相对少见,因而,我们应加大对UTUC的单独研究,寻求解决转移性UTUC患者预后差的措施。
1.4.3 辅助化疗
目前,关于UTUC的辅助化疗相关报道较少,并且其方案是依据膀胱癌的数据而提出,相关协会关于UTUC的辅助化疗尚未达成共识。Leow等[38]的meta分析发现基于顺铂方案的辅助化疗可明显改善UTUC患者总体生存率和肿瘤特异性生存率,而非顺铂方案却没发生这种现象;Quhal等[39]研究发现辅助化疗与新辅助化疗均对局部高危UTUC患者生存有利,此外,新辅助化疗可降低患者的病理分期;但Kang等[40]回顾性分析却发现辅助化疗对局部晚期UTUC患者生存率无意义;Song等[41]回顾性分析发现辅助化疗可改善T3N任何M0期UTUC患者无病生存率,却对患者总体生存率和CSS无作用;罗勇等[42]前瞻性随机对照研究发现,高危UTUC术后(RNU)接受吉西他滨及顺铂化疗的患者的生存期明显改善;而杜智勇等[43]分析却发现是否辅助化疗对高危UTUC患者的生存无影响。此外,由于RNU术后患者肾功能明显下降,辅助化疗可能会加重患者的肾脏负担。UTUC患者术后肾功能会受到打击,特别是RNU术后患者,如此,降低了辅助化疗的安全性,甚至降低患者的总体生存期。基于目前的报道,辅助化疗主要是针对高危患者,但尚未达成共识,还有待更科学地前瞻性临床随机试验来剖析真实情况,如此可减少因辅助化疗而加重患者脏器损害的事件发生。
1.5 放疗
辅助放射治疗对围术期UTUC的作用存在争议。转移性UTUC为控制出血可采用放射治疗,但对患者的生存率影响无明显价值[44]。一项小样本(n=31)回顾性分析发现,与单纯辅助放疗相比,局部晚期UTUC患者选择顺铂化疗联合辅助放疗可患者五年总体及CSS均有所改善[45],但此研究样本少且只进行单因素分析,降低了证据强度;而Hahn等[46]和Huang等[47]分析发现辅助放疗对局部晚期UTUC的生存无意义。基于目前的研究,UTUC患者选择放射治疗应谨慎处理,否则,可能适得其反。
1.6 免疫治疗
目前,对于局部进展或转移性或无法手术切除的UTUC的治疗仍然棘手,随着免疫治疗的兴起,打破了这一局面。至今为止,五种可通过阻断程序性细胞死亡1受体或其配体而发挥抗肿瘤作用的免疫抑制剂已获批准上市,主要包括atezolizumab,pembrolizumab,durvalumab,avelumab and nivolumab[48]。
Rosenberg等[49]研究atezolizumab对转移性UTUC作用的Ⅱ期临床试验证实了其在转移性UTUC的有利作用;Balar等[50]多中心Ⅱ期临床试验表明,对于局部晚期、无法切除或转移性UC患者,pembrolizumab可有效地发挥抗肿瘤作用,并且更加安全,尤其是对于老年、严重肾功能损害的患者;Nishiyama等[51]Ⅲ期临床随机试验发现,在使用铂类化疗后的转移性UC发生肿瘤复发的日本患者中,pembrolizumab可发挥显著的抗肿瘤效应;Zajac等[52]研究发现,在UC患者中,durvalumab发挥良好的抗肿瘤作用;Apolo等[53]的多中心Ⅰb期临床试验表明,avelumab能延长难治性(铂类化疗失败)转移性UC患者的生存率;Ohyama等[54]分析全球270名接受nivolumab治疗的无法切除的局部进展或耐铂类药物的转移性UC患者发现,其可安全、有效地延长患者的生存。此外,Tafuri等[55]的荟萃分析发现上述五种免疫抑制剂均可改善转移性UC患者的生存。
综上所述,免疫治疗明显优于辅助放化疗,尤其是RNU术后患者的耐受方面,因此,对于转移性UTUC患者可首选免疫治疗,以此更安全有效地延长生存期。由于UTUC比较少见,免疫治疗相关研究常常将UTUC与UCB归为一类进行,同时,UTUC与UCB的肿瘤生物学行为存在差异,因而不能简单地将UTUC和膀胱癌相提并论,这可能掩盖UTUC的实际效应。
2 展望
目前,国内外关于UTUC围术期辅助治疗的相关报道较少,尤其是前瞻性临床随机研究。并且,UTUC的辅助治疗仍参照膀胱癌,这可能阻碍了UTUC的精准治疗发展。对于UTUC患者的辅助治疗方式,未来需要单独研究,而不是笼统地与膀胱癌归为一处讨论。免疫治疗在肿瘤的地位越来越高,特别是高度侵袭性肿瘤,UTUC也不例外,未来UTUC的免疫相关研究不应受到忽视。此外,人种差异可能会影响UTUC的治疗效果[56],我们在选择辅助治疗时,需兼顾种族影响。

