miR-100-5p通过靶向FGFR3抑制非小细胞肺癌细胞迁移、侵袭和糖酵解
李晓君,江 娟,冯红刚,冯 丽,江 明
(1.襄阳市第一人民医院/湖北医药学院附属医院健康体检科,湖北 襄阳 441002;2.襄阳市中心医院/湖北文理学院附属医院心胸外科,湖北 襄阳 441002;3.武汉科技大学附属医院肿瘤科,湖北 武汉 430064)
肺癌是世界上常见的致命性恶性肿瘤之一。每年新发病例超过20万,死亡率非常高[1]。大多数肺癌是非小细胞肺癌(non-small cell lung cancer,NSCLC),其特征是发展迅速、转移风险高以及对治疗的抵抗力强[2]。尽管临床在外科切除、化学疗法和放射疗法方面已经取得了持续的进展,但晚期NSCLC患者的5年生存率仅为5%~20%,这与高复发和高转移有关[3]。癌细胞的常见代谢特征是有氧糖酵解,即使在富氧条件下,癌细胞也倾向于通过糖酵解而不是氧化磷酸化来消耗更多的葡萄糖以产生乳酸,这种现象会很大程度上加速肿瘤生长[4]。因此,肿瘤糖酵解被认为是癌症治疗的潜在靶标。microRNA(miRNA)是内源的非编码RNA,大约有22个核苷酸。miRNA通过与mRNA的3’非翻译区(3’-UTR)结合来调节基因表达,从而抑制mRNA切割的翻译或诱导。miRNA参与细胞分化、细胞周期、细胞凋亡和炎症反应[5]。已有研究表明,miR-100-5p在多种癌症细胞中异常表达,在口腔鳞状细胞癌[6]、前列腺癌[7]等肿瘤中具有促进癌细胞增殖的作用,在胃癌[8]、脊索瘤[9]等肿瘤中具有抑制癌细胞增殖的作用。低miR-100可能是NSCLC患者的不良预后因素,其通过转录后调节PLK1的表达抑制NSCLC的生长[10],但是miR-100-5p对NSCLC细胞迁移、侵袭和糖酵解的影响尚不清楚,因此,本研究主要探究miR-100-5p对NSCLC细胞迁移、侵袭和糖酵解的影响及作用机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂及仪器 miR-NC、miR-100-5p mimic、miR-100-5p inhibitor、pc-NC、pc-FGFR3质粒和实验所用各种引物由北京奥科生物科技有限公司设计并合成,Lipofectamine 2000转染试剂购自上海少辛生物科技有限公司(批号:11668-019),RPMI-1640培养基购自上海慧颖生物科技有限公司(批号:C11875500BT),胎牛血清购自北京百奥莱博科技有限公司(批号:QS071),青霉素和链霉素双抗溶液购自北京沃比森科技有限公司(批号:C0160-611),miRcute miRNA分离试剂盒和miRcute miRNA第一链cDNA合成试剂盒购自北京天根生物科技有限公司(批号:DP501、KR201),SYBR-Green PCR试剂盒购自嘉兴蓝诺盛生物科技有限公司(批号:RT0411-03),Transwell小室购自北京明阳科华生物科技有限公司(批号:254480),葡萄糖摄取比色测定试剂盒和乳酸测定试剂盒Ⅱ购自广州伟伯生物科技有限公司(批号:3091336、3104233),ATP比色测定试剂盒购自武汉艾美捷科技有限公司(批号:K354-100),BCA试剂盒购自西安浩特生物科技有限公司(批号:WB027),Seahorse XF糖酵解应激测试试剂盒和Seahorse XF细胞线粒体应激测试试剂盒购自美国Seahorse公司(批号:103325-100、103275-100),辣根过氧化物酶标记的山羊抗兔二抗、FGFR3兔来源的单克隆抗体购自上海艾博抗生物科技有限公司(批号:ab36151、ab180906),双荧光素酶报告基因检测试剂盒购自北京威格斯生物技术有限公司(批号:T002),FluorChem HD2凝胶成像系统购自美国Proteinsimple公司,Seahorse XF-96分析仪购自美国Seahorse公司,ThermoFisherbrand数码生物显微镜购自上海睿安生物科技有限公司。
1.1.2 组织样品 收集襄阳市第一人民医院2016年1月至2018年12月经病理确诊的NSCLC患者手术切除的癌组织和癌旁组织60对,其中男47例,女13例,年龄3~78岁,中位年龄为57岁。患者手术前均未接受放疗、化疗及其他辅助治疗。本研究经我院医学伦理学委员会批准,所有研究对象均签署知情同意书。
1.1.3 细胞及培养 正常肺上皮细胞BEAS-2B和NSCLC细胞系(H1703、A549、H1299、L78、PGCL3、H1650)均购自上海素冉生物科技有限公司。在37℃、5%CO2条件下,所有细胞于含10%胎牛血清、100 U/mL的青霉素和链霉素双抗溶液的RPMI-1640培养基中培养。
1.2 方法
1.2.1 RT-qPCR检测miR-100-5p的表达 采用miRcute miRNA分离试剂盒从研磨的NSCLC组织或培养的正常肺上皮细胞BEAS-2B和NSCLC细胞系(H1703、A549、H1299、L78、PGCL3、H1650)中提取总RNA,并通过miRcute miRNA第一链cDNA合成试剂盒将靶miRNA逆转录为cDNA。以cDNA为模板,通过SYBR Green PCR试剂盒进行RT-qPCR,并在CFX96系统测定miRNA的表达水平。miR-100-5p的循环条件为:96 ℃、10 s,55 ℃、10 s,72 ℃、90 s,35个循环,用U6标准化,使用2-ΔΔc t方法计算。miR-100-5p上游引物:5’-ATCATTAAACCCGTAGATCCGAA-3’;下游引物:5’-AATGGTTGTTCTCCACACTCTCTC-3’。U6上游引物:5’-CTCGCTTCGGCAGCACA-3’;U6下游引物:5’-AACGCTTCACGAATTTGCGT-3’。
1.2.2 细胞转染 取对数期NSCLC H1650细胞接种于12孔板(1×106/孔),达到85%融合时,根据Lipofectamine 2000说明书将miR-NC、miR-100-5p mimic、miR-100-5p inhibitor、pc-NC、pc-FGFR3质粒分别或联合转染入H1650细胞,分为:对照组、miR-NC组、miR-100-5p mimic组、miR-100-5p inhibitor组、miR-100-5p mimic+pc-NC组、miR-100-5p mimic+pc-FGFR3组。
1.2.3 划痕实验检测细胞迁移 将按1.2.2项转染后的NSCLC H1650细胞接种于12孔板(1×106/孔),铺满单层后,用小号枪头垂直在孔中间划痕,然后用PBS清洗2次。在CO2体积分数为5%、37 ℃恒温的培养箱中培养24 h后,使用Image J评估细胞迁移能力。于划痕0 h和24 h拍摄图像,划痕闭合率=(0 h时的划痕面积-24 h时的划痕面积)/0 h的划痕面积×100%。
1.2.4 Transwell实验检测细胞侵袭 在基底胶包埋的Transwell小室上室接种按1.2.2项下转染后的NSCLC H1650悬浮液和不含血清的培养基,并在Transwell小室下室加入含血清的培养基,培养24 h后,取出Transwell小室,侵袭细胞用4%多聚甲醛固定,0.5%结晶紫染色30 min,并在显微镜下观察分析。
1.2.5 细胞葡萄糖摄取、乳酸生成和ATP含量检测 分别按照葡萄糖摄取比色测定试剂盒、乳酸测定试剂盒Ⅱ和ATP比色测定试剂盒说明书检测细胞葡萄糖摄取、乳酸生成和ATP含量。对于葡萄糖摄取比色法,将细胞以每孔1 500个的密度接种于96孔板中。通过用含2% BSA的100 mL KRPH缓冲液预孵育40 min,使细胞处于葡萄糖饥饿状态,随后加入10 mL 10 mmol/L 2-DG孵育细胞20 min。对于乳酸和ATP测定,收集1×106细胞于100 mL相应试剂盒提供的检测缓冲液中匀浆,离心样品,测定可溶性组分含量。
1.2.6 细胞外酸化率(extracellular acidification rate,ECAR)和细胞耗氧率(cellular oxygen consumption rate,OCR)检测 根据试剂盒说明书,使用Seahorse XF 96细胞外通量分析仪确定细胞ECAR和OCR。以1×104/L将细胞接种到Seahorse XF 96细胞培养微孔板中。在进行基线测量后,对于ECAR,在指定的时间点依次将葡萄糖、氧化磷酸化抑制剂寡霉素和糖酵解抑制剂2-DG分别注入每个孔中;对于OCR,依次注射寡霉素、可逆性氧化磷酸化抑制剂对三氟甲氧羰基氰化物苯腙(p-trifluoromethoxycarbonyl cyanide phenylhydrazone,FCCP)和线粒体复合物Ⅰ抑制剂鱼藤酮加线粒体复合物Ⅲ抑制剂抗霉素A(Rote/AA)。数据通过Seahorse XF-96 Wave软件进行评估。OCR以pmols/min显示,ECAR以mpH/min显示。
1.2.7 双荧光素酶实验检测靶向关系 收集生长至对数期的H1650细胞,接种于24孔板中,培养24 h。然后将1 mg PGL3- FGFR3-WT(FGFR3野生型)或PGL3- FGFR3-MUT(FGFR3突变型)以及miR-NC或miR-100-5p mimic和PRL-CMV质粒共转染入H1650细胞,分为miR-NC组、miR-100-5p mimic组、pc-NC组、pc-FGFR3组。转染48 h后,裂解H1650细胞15 min,采用双荧光素酶检测系统测量荧光素酶的相对活性。
1.2.8 蛋白印迹法检测FGFR3蛋白表达水平 收集按1.2.2项转染后的NSCLC H1650细胞,用RIPA裂解液提取总蛋白,然后用BCA试剂盒定量蛋白的浓度。将蛋白样品用SDS-PAGE分离后,再用半干转膜仪转移到聚偏二氟乙烯膜,室温下于脱脂牛奶中封闭蛋白2 h。随后加入对应的兔来源的单克隆一抗(FGFR3 1∶800、GAPDH 1∶1 000),4 ℃封闭过夜。然后,加入对应辣根过氧化物酶标记的山羊抗兔单克隆二抗(1∶2 000)室温封闭1 h,最后滴电化学反应液曝光。以GAPDH为内参,使用软件Image-Pro plus 6.0分析蛋白条带灰度,蛋白相对表达量=目标蛋白吸光度值/内参蛋白GAPDH吸光度值。
1.3 统计学方法

2 结果
2.1 NSCLC miR-100-5p表达与临床病理特征的关系
在NSCLC中,miR-100-5p表达与性别、年龄和病理类型无关(P>0.05),而与吸烟史、肿瘤大小、TNM分期、淋巴结转移和分化程度有关(P<0.05),见表1。
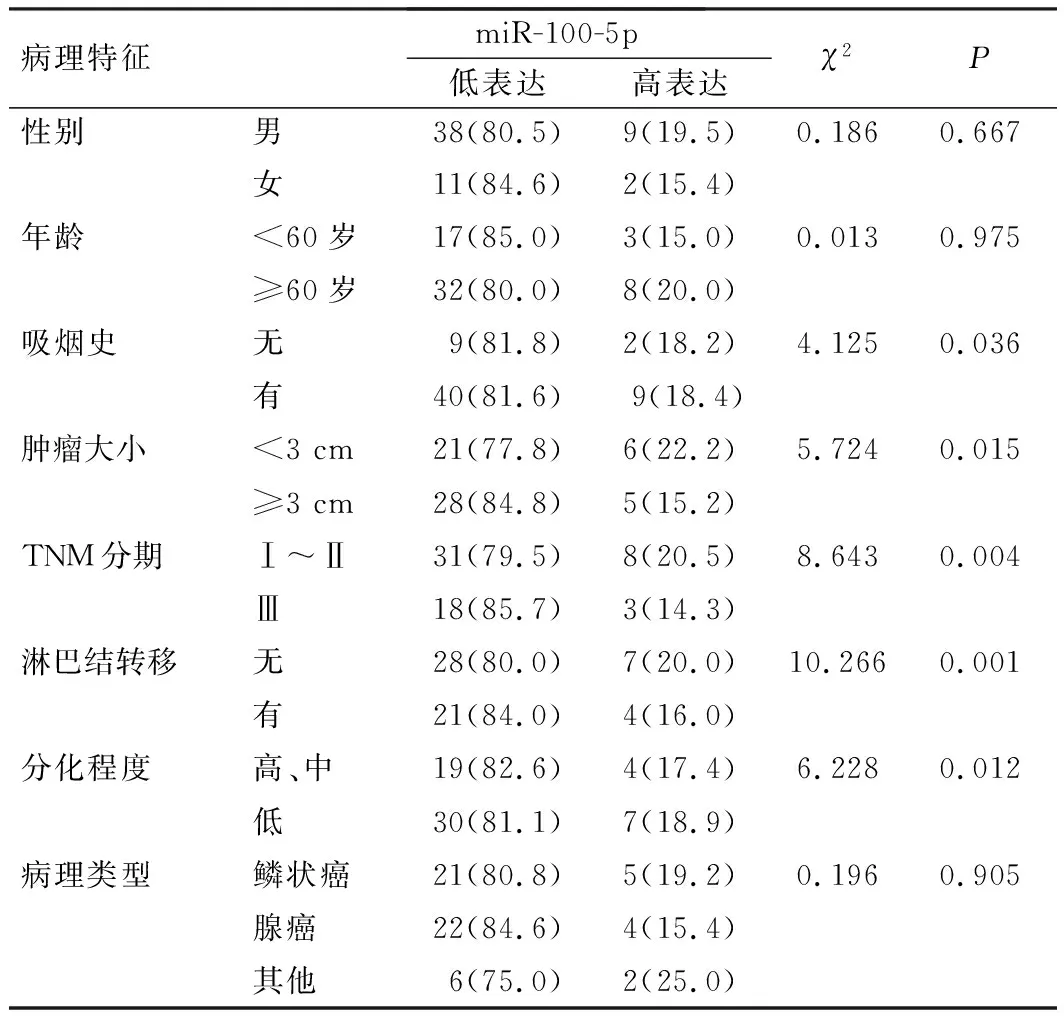
表1 NSCLC患者的miR-100-5p表达水平与临床病理特征的关系[例(%)]
2.2 miR-100-5p mRNA在NSCLC组织和细胞中低表达
与癌旁组织相比,NSCLC组织中miR-100-5p mRNA表达显著下调(P<0.01),见图1a;与正常肺上皮细胞BEAS-2B相比,NSCLC细胞系H1703、A549、H1299、L78、PGCL3、H1650中miR-100-5p mRNA表达显著下调(P<0.01),见图1b,选取H1650细胞做后续实验。与对照组相比,miR-NC组H1650细胞中miR-100-5p mRNA表达无明显变化,miR-100-5p mimic组H1650细胞中miR-100-5p mRNA表达显著上调(P<0.01),miR-100-5p inhibitor组H1650细胞中miR-100-5p mRNA表达显著下调(P <0.01),表明转染成功,见图1c。
2.3 miR-100-5p抑制NSCLC细胞迁移和侵袭
与对照组相比,miR-NC组划痕闭合率和侵袭细胞数目无明显变化(P>0.05),miR-100-5p mimic组划痕闭合率显著较低(P<0.01),侵袭细胞数目显著较少(P<0.01),miR-100-5p inhibitor组划痕闭合率显著较高(P<0.01),侵袭细胞数目显著较多(P<0.01),见图2。
2.4 miR-100-5p抑制NSCLC细胞糖酵解
与对照组相比,miR-NC组H1650细胞中葡萄糖摄取量、乳酸产生量、ATP含量、ECAR、OCR均无明显变化(P>0.05),miR-100-5p mimic组H1650细胞中葡萄糖摄取量、乳酸产生量、ATP含量及ECAR显著较低(P<0.01),OCR显著较高(P<0.01),miR-100-5p inhibitor组H1650细胞中葡萄糖摄取量、乳酸产生量、ATP含量及ECAR显著较高(P<0.01),OCR显著较低(P<0.01),见图3。

a:RT-qPCR检测NSCLC组织中miR-100-5p mRNA的表达;b:RT-qPCR检测NSCLC细胞中miR-100-5p mRNA的表达;c:RT-qPCR检测转染后NSCLC中miR-100-5p mRNA的表达 △:与癌旁组织相比,P<0.01;#:与BEAS-2B相比,P<0.01;*:与对照组相比,P<0.01
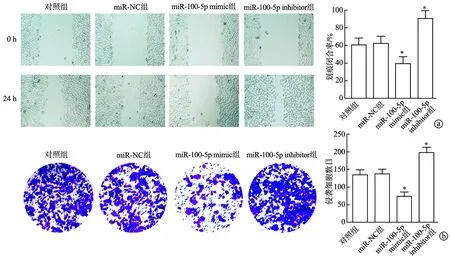
a:划痕实验检测细胞迁移(×100);b:Transwell实验检测细胞侵袭(结晶紫×200);*:与对照组比较,P<0.01

a:葡萄糖摄取比色测定试剂盒检测葡萄糖摄取;b:乳酸测定试剂盒Ⅱ检测乳酸生成;c:ATP比色测定试剂盒检测ATP含量;d:Seahorse XF糖酵解应激测试试剂盒检测ECAR;e:Seahorse XF细胞线粒体应激测试试剂盒检测OCR *:与对照组相比,P<0.01
2.5 miR-100-5p靶向下调FGFR3
通过Targetscan软件预测发现,miR-100-5p与FGFR3具有靶向关系,在3’UTR区存在结合位点(图4a);通过双荧光素酶发现,miR-100-5p与FGFR3-WT共转染显著降低了荧光素酶活性(P<0.01),见图4b。与miR-NC组相比,miR-100-5p mimic组FGFR3蛋白表达水平显著下调(P<0.01),说明miR-100-5p靶向下调FGFR3;与pc-NC组相比,pc-FGFR3组FGFR3蛋白表达显著上调(P<0.01),表明转染成功,见图4c。
2.6 miR-100-5p通过靶向FGFR3对NSCLC细胞迁移、侵袭和糖酵解起抑制作用
与miR-100-5p mimic+pc-NC组比较,miR-100-5p mimic+pc-FGFR3组H1650细胞划痕闭合率较高,侵袭细胞数目较多,葡萄糖摄取量、乳酸产生量、ATP含量及ECAR显著较高,OCR显著较低,差异均具有统计学意义(P<0.01),见图5。

a:Targetscan软件预测miR-100-5p与FGFR3结合靶点;b:双荧光素酶实验验证miR-100-5p与FGFR3靶向关系;c:蛋白印迹法检测FGFR3蛋白表达水平 *:与miR-NC组相比,P<0.01;#:与pc-NC组相比,P<0.01

a:划痕实验检测细胞迁移(×100);b:Transwell实验检测细胞侵袭(结晶紫×200);c:葡萄糖摄取比色测定试剂盒检测葡萄糖摄取;d:乳酸测定试剂盒Ⅱ检测乳酸生成;e:ATP比色测定试剂盒检测ATP含量;f:Seahorse XF糖酵解应激测试试剂盒检测ECAR;g:Seahorse XF细胞线粒体应激测试试剂盒检测OCR *:与miR-100-5p mimic+pc-NC组比较,P<0.01
3 讨论
NSCLC病情发展迅速、转移风险高、病死率高,是恶性程度较高的肿瘤之一。现有治疗手段无法控制NSCLC导致的低生存率和高病死率,因此医学研究者将目光转向了生物治疗[10]。本研究主要探究miR-100-5p对NSCLC细胞迁移、侵袭和糖酵解的影响及作用机制。
miRNA的失调是癌症的发病机制之一,某些miRNA在人类癌症的诊断和治疗中具有重要作用。本研究结果表明,miR-100-5p表达与NSCLC患者的性别、年龄和病理类型无关,而与吸烟史、肿瘤大小、TNM分期、淋巴结转移和分化成程度有关,miR-100-5p在NSCLC组织和细胞中低表达,说明miR-100-5p与NSCLC的发展密切相关,这与已有研究结果NSCLC组织中miR-100相对低表达与患者的不良预后相关一致[11]。NSCLC的高复发率和高病死率与该细胞具有较强转移能力密切相关,而肿瘤细胞的侵袭能力和迁移能力反映了癌症的转移能力。因此,寻找能够抑制NSCLC侵袭和迁移的新型分子或治疗靶标具有重要意义。本研究表明,miR-100-5p过表达抑制NSCLC细胞迁移和侵袭,miR-100-5p低表达促进NSCLC细胞迁移和侵袭,这与miR-100通过靶向IGF1R抑制鼻咽癌的迁移和侵袭[12]、miR-100通过靶向FZD-8抑制乳腺癌细胞的迁移和侵袭[13]等结果相符。
癌细胞经常表现出高速率的有氧糖酵解,即Warburg效应。癌细胞葡萄糖代谢的发生率高于正常细胞[14]。从氧化磷酸化到有氧糖酵解的代谢重编程是癌症进展中的常见事件[15]。尽管就每个葡萄糖的ATP数量而言,糖酵解不如氧化磷酸化提供的能量有效,但其为合成代谢提供了多种糖酵解中间体,满足了快速增长的癌细胞对构件的需求[16]。此外,糖酵解的增加会导致肿瘤微环境中葡萄糖的缺乏和乳酸的积累,从而抑制淋巴细胞浸润并降低抗免疫疗法效果[17]。靶向代谢途径已被证明是控制肿瘤生长和增强抗癌疗效的有效途径[18]。已有研究表明,HIF1A通过miR-100-5p激活lncRNA RAET1K的转录调控低氧诱导的肝癌细胞糖酵解[19]。同样,本研究也显示,miR-100-5p过表达抑制NSCLC细胞糖酵解,miR-100-5p低表达促进NSCLC细胞糖酵解。
miRNA通过与靶基因的3’U端结合,诱导基因或蛋白降解,在转录后抑制基因表达。已有研究表明,过表达miR-100通过FGFR3抑制骨肉瘤的生长[20],miR-100在人类胶质母细胞瘤中通过FGFR3抑制细胞增殖、迁移和化学敏感性[21]。同理,本研究结果表明,miR-100-5p可靶向下调FGFR3。FGFR由1个细胞配体结构域组成,该结构域由3个免疫球蛋白样结构域,1个跨膜螺旋结构域和1个具有酪氨酸激酶活性的细胞内结构域组成[22]。FGFR3在多种肿瘤细胞的增殖、侵袭、迁移和转移中起着至关重要的作用,具有成为肿瘤治疗靶标的潜力。siRNA沉默FGFR3可抑制NSCLC A549细胞的侵袭[23]。FGFR3对内皮糖酵解的调节是成年血管生长和发育的关键过程[24]。同样,本研究表明,miR-100-5p过表达靶向下调FGFR3表达抑制NSCLC细胞迁移、侵袭和糖酵解。
综上所述,miR-100-5p过表达靶向下调FGFR3表达抑制NSCLC细胞迁移、侵袭和糖酵解,这说明miR-100-5p和FGFR3可能为NSCLC的潜在治疗靶点。本研究仅是miR-100-5p对NSCLC细胞迁移、侵袭和糖酵解作用机制的初步探讨,更为深入的分子通路机制有待进一步研究。

