‘中烟100’根系响应镰刀菌侵染的转录组数据分析及生理生化变化研究
赵凤霞,米琳,丁燕芳,宋学立,何嘉,孙小瑞,徐沛瑶,王海涛
(河南省农业科学院烟草研究所,河南 许昌 461000)
烟草是我国重要的经济作物,也是一种重要的模式植物,在基础研究和应用研究方面发挥了巨大作用。烟草病害一直是严重制约世界烟草生产和科研发展的重要难题,其中烟草镰刀菌根腐病是近年来危害烟草行业的最重要病害之一[1,2],在河南、山东、云南、贵州等地均有发生,发病范围和程度有逐年加重的趋势,部分省市重病烟田发病率达30%以上[2,3]。2013年河南省平顶山烟区发病率高达5%~10%,造成3 000万元左右的经济损失。本课题组对烤烟根腐病的分离和鉴定以及河南省主栽烤烟品种抗病性进行了大量研究,认为引起河南省烟草镰刀菌根腐病的优势致病菌为尖孢镰刀菌,约占总致病菌的81.25%[4,5]。
目前根腐病的防治主要采用抗病育种和生物防治的方法,但具体操作具有一定局限性,由于缺乏特效药剂和抗性品种,烟草根腐病的治理难度相当大,危害极其严重[6]。只有充分认识病原菌的致病机制,才能找到最经济、有效、环保的防治方法,降低根腐病的危害程度。目前对烟草抗病机理的研究主要集中在抗病基因定位和分子标记辅助育种[7]、基因组学和抗性基因的转化等方面[8],而通过转录组学方法结合抗病相关生理生化指标的检测,对烤烟抗病性开展的研究较少。
转录组学为抗病性研究提供了同步进行多处理、多组织比较的平台,研究植物在病原菌侵染条件下多重应对通路的串扰,有利于全面了解植物针对病原菌侵染的应对网络[9]。目前,转录组测序技术已广泛应用于基础研究、临床诊断和药物研发等领域。王元英[10]对普通烟草种红花大金元及野生种林烟草、绒毛状烟草、耳状烟草开花时期的主要器官(根、茎、叶和花)进行了转录组测序与分析,对比绒毛状烟草全基因组,并根据绒毛状烟草基因组抗病相关R基因的生物信息分析结果,选取其中的重要基因批量设计引物,构建了高通量的烟草RNAi载体库,为进一步开展烟草抗病相关R基因的克隆及其功能的鉴定验证奠定了基础。Ferrario-Méry等[11]研究了烟草中碳氮的代谢途径,整合了该代谢途径中转录组、酶活性及代谢组学的相互关系,分析了谷氨酰胺合成酶在氮代谢过程中的作用。
研究镰刀菌根腐病侵染后烤烟根系基因表达以及抗病相关酶类活性和物质含量的差异,结合内源激素含量差异分析,有助于深入研究烤烟抗病机理,为烤烟根腐病的预测预警提供数据支撑和根腐病的有效防治和培育高抗品种提供理论依据。
1 材料与方法
1.1 试验材料
供试品种为河南省主栽品种‘中烟100’。选取大田生长条件下感病烟株(记作T),经鉴定为尖孢镰刀菌(Fusarium oxysporum)致病株,以同地块未侵染的正常生长烟株作为对照(记作CK)。
1.2 测定指标与方法
1.2.1 转录组学研究方法 提取样本RNA,检测合格后,用带有Oligo(dT)的磁珠富集真核生物mRNA,加入Fragmentation Buffer将mRNA进行随机打断,以mRNA为模板,用六碱基随机引物(random hexamers)合成第一条cDNA链,然后加入缓冲液、dNTPs、RNase H和DNA polymeraseⅠ合成第二条cDNA链,利用AMPure XP beads纯化cDNA,纯化的双链cDNA再进行末端修复、加A尾并连接测序接头,然后用AMPure XP beads进行片段大小选择,最后通过PCR富集得到cDNA文库。库检合格后,用HiSeq 2500进行高通量测序,测序读长为PE100。对Raw Data进行数据过滤,去除其中的接头序列及低质量Reads获得高质量的Clean Data,将Clean Data进行序列组装,获得该物种的Unigene库。采用Trinity软件进行组装,使用BLAST[12]软件将Unigene 序 列 与 NR[13]、Swiss-Prot[14]、GO[15]、COG[16]、KOG[17]、KEGG[18]数据库比对,预测完Unigene的氨基酸序列之后使用HMMER[19]软件与Pfam[20]数据库比对,获得Unigene的注释信息。
1.2.2 根系外观形态检测 使用EPSON LA2400扫描仪观察根系形态差异,利用WinRHTZO根系分析系统进行图像分析。
1.2.3 酶类活性等生理指标测定 参考前人的检测方法[21]:超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑(NBT)光还原法;过氧化氢酶(CAT)活性的测定采用比色法;抗坏血酸过氧化物酶(APX)、多酚氧化酶(PPO)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽S-转移酶(GST)活性、总抗氧化能力(T-AOC)和超氧阴离子清除率采用酶标仪法;苯丙氨酸解氨酶(PAL)活性的测定采用紫外分光光度法;过氧化物酶(POD)活性的测定采用愈创木酚比色法;氧化型谷胱甘肽(GSSG)含量采用2-VP法测定;脯氨酸(PRO)含量采用可见分光光度法测定;丙二醛(MDA)含量的测定采用2-硫代巴比妥酸显色法。
1.2.4 内源激素含量测定 采用HPLC法进行测定:称取0.1 g样本,放入研钵中磨碎,加入1mL预冷的试剂一,4℃浸提过夜。8 000×g离心10 min,残渣用0.5 mL试剂一浸提2 h,离心后取上清液,合并两次上清液,40℃减压蒸发至不含有机相(约剩0.5 mL水溶液),加入0.5 mL试剂二萃取脱色3次,弃去上层醚相,下层40℃减压蒸干,加入0.5 mL试剂三溶解,针头式过滤器过滤于带有内衬管的样品瓶内待测。
HPLC液相条件:Rigol L3000高效液相色谱仪,Kromasil C18反相色谱柱(250 mm ×4.6 mm,5μm)。流动相的配制:取200 mL甲醇和300 mL超纯水混合,加入3 mL试剂四,混匀。进样量10μL,流速0.8 mL/min,柱温35℃,走样时间40 min,检测波长254 nm。用流动相过柱子,待基线稳定后加样。
1.3 数据处理与分析
采用Microsoft Excel 2007、SPSS 17对数据进行处理、统计分析并作图。
2 结果与分析
2.1 转录组学分析
通过RNA-seq技术,对病原菌侵染的‘中烟100’和对照根系的转录组进行了测序,共获得30.71 Gb Clean Data,通过Trinity组装,共得到907 812条Transcript和686 933条Unigene(表1)。
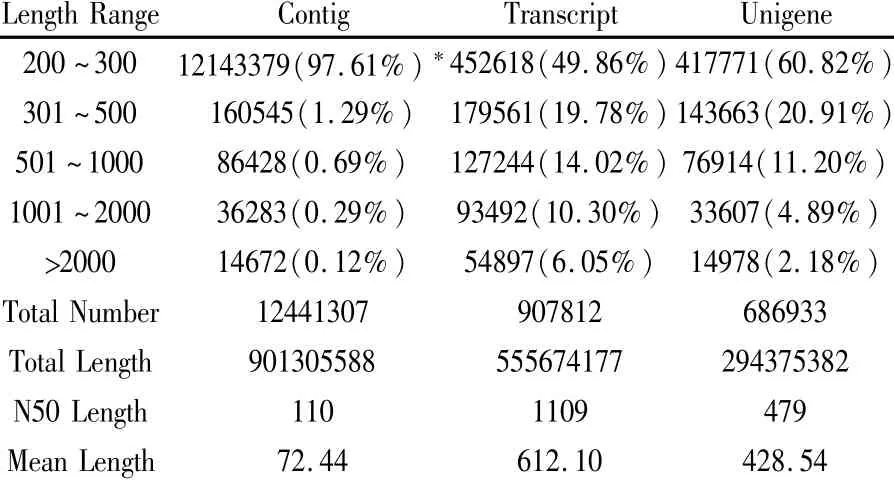
表1 组装结果统计表
将获得的Unigene序列与COG、KEGG等数据库比对,预测完Unigene的氨基酸序列之后与Pfam数据库比对,获得Unigene的注释信息。通过选择BLAST参数E-value不大于10-5和HMMER参数E-value不大于10-10,最终获得373 204个有注释信息的Unigene,基因注释的统计结果如表2所示。

表2 Unigene注释统计
采用DESeq进行样品组间的差异表达分析,获得差异表达基因集。通过NR库对Unigene进行基因注释,对所有的Unigene进行物种分类,将属于烟草的Unigene序列单独列出,进行差异基因表达分析,差异表达基因数如表3所示。

表3 烟草中差异表达基因数
对差异表达基因进行模式聚类、功能注释以及富集性分析,结果显示差异基因的功能主要涉及不同生物学过程、细胞组分和分子功能等几个方面。将Unigene与COG数据库进行比对,结果显示一般功能性基因的Unigene最多,其次为转录翻译、核糖体结构和生物学功能相关的Unigene,差异基因主要涉及核糖体的结构成分、序列特异性DNA结合转录活性因子、序列特异性DNA结合、ATP结合、过氧化还原酶活性、纤维素合酶(形成UDP)活性、rRNA结合等方面。对差异表达基因KEGG的注释结果按照KEGG中通路类型进行分类,其中新陈代谢相关的Unigene占比最高;遗传信息传递相关的差异表达基因中以蛋白质加工相关基因含量最高;代谢过程的差异表达基因以淀粉和蔗糖代谢相关的基因含量最高;信号传导过程相关的差异表达基因以植物激素信号转导相关基因含量最高;另外,植物病原体互作相关基因所占比例也较高。
2.2 侵染烟株形态
病原菌侵染前后,整个烟株及根系外观形态差异显著。与正常烟株相比,发病烟株矮小,叶片发黄枯萎;主根和侧根数量显著减少,呈腐渍状且变黑腐烂(图1)。

图1 病原菌侵染后烟株及根系形态
由表4可知,病原菌侵染后烟株根系长度、截面积、表面积、根系体积均显著低于对照株;侵染烟株平均直径为0.78 mm,显著高于对照株的0.47 mm。

表4 发病烟株根系形态指标
2.3 内源激素含量测定
与大田正常生长烟株相比,病原菌侵染后烟株根系和叶片吲哚乙酸(IAA)、赤霉素(GA3)、细胞分裂素(ZA)和脱落酸(ABA)含量均显著升高(图2)。病原菌侵染后烤烟根系IAA含量为对照的3.25倍,叶片IAA含量为对照的1.58倍;烤烟根系GA3含量为对照的5.68倍,叶片GA3含量为对照的1.65倍;烤烟根系ZA含量为对照的1.58倍,叶片ZA含量为对照的1.37倍;烤烟根系ABA含量为对照的1.57倍,叶片ABA含量为对照的2.45倍。
2.4 酶类活性及保护性物质含量变化
2.4.1 抗氧化相关酶类活性变化 如图3所示,病原菌侵染后烤烟根系SOD活性为14.73 U/mg prot,显著高于对照(11.81 U/mg prot);CAT活性为8.46 U/mg prot,极显著高于对照(1.16 U/mg prot);APX活性为0.015μmol/(min·mg prot),显著低于对照[0.032μmol/(min·mg prot)]。
2.4.2 酚类化合物次生代谢相关酶类活性变化病原菌侵染后烤烟根系PAL、POD和PPO活性变化如图4所示。侵染后根系PAL活性为3.91 U/mg prot,POD活性为4.28 U/mg prot,PPO活性为2.42 U/mg prot,均显著高于对照。

图2 病原菌侵染后烤烟根系和叶片内源激素含量
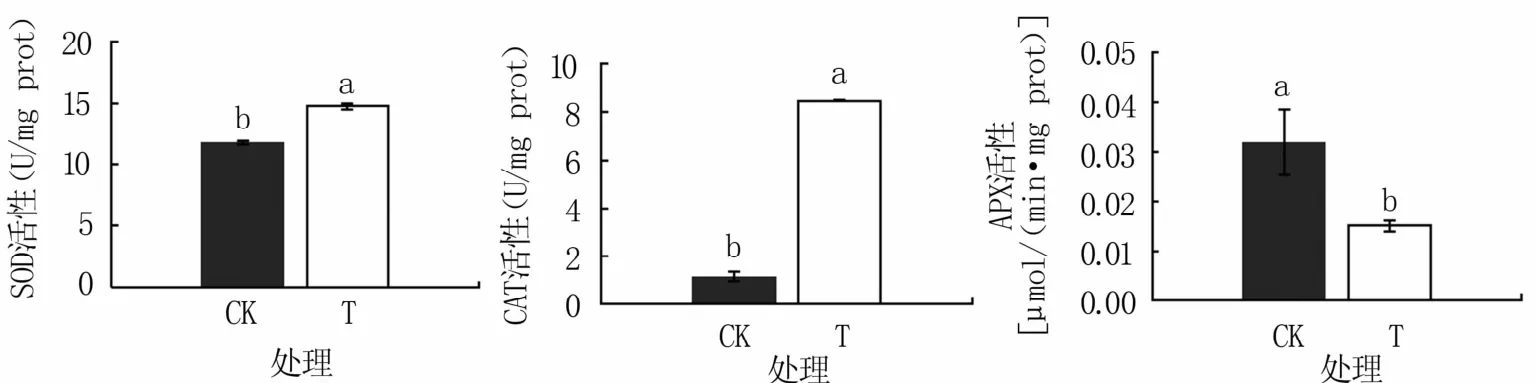
图3 病原菌侵染后烤烟根系抗氧化酶类活性

图4 酚类化合物次生代谢相关酶类活性
2.4.3 谷胱甘肽氧化还原反应相关酶类活性和物质含量 与谷胱甘肽氧化还原反应相关的酶类包括GSH-Px和GST。病原菌侵染后烤烟根系GSH-Px活性为313.91 nmol/(min·mg prot),极显著高于对照[90.48 nmol/(min·mg prot)];GST活性为1.46 nmol/(min·mg prot),显著高于对照[0.43 nmol/(min·mg prot)];氧化型谷胱甘肽(GSSG)含量为0.25 nmol/mg prot,极显著高于对照(0.03 nmol/mg prot)(图5)。

图5 谷胱甘肽氧化还原反应相关酶类活性和物质含量
2.4.4 其它指标含量变化 本研究检测了镰刀菌根腐病侵染后烤烟根系T-AOC、超氧阴离子清除能力、MDA以及PRO含量变化。结果(图6)显示,病原菌侵染后根系总抗氧化能力约为对照的12倍,超氧阴离子清除率、MDA和PRO含量均显著升高。

图6 烤烟根系T-AOC、MDA、PRO含量及超氧阴离子清除率等指标变化
3 讨论
病原菌侵染导致烤烟根系抗病相关基因表达量升高,根系和叶片内源激素含量发生显著变化,与转录组学研究中对差异表达基因的KEGG注释结果一致,即信号传导过程相关的差异表达基因以植物激素信号转导相关基因含量最高,另外,代谢相关基因和植物病原体互作相关基因所占比例也较高。
正常生长的植物体内,抗氧化酶类和非酶类活性氧清除系统可以清除植物体内产生的活性氧自由基,自由基的产生和清除系统是平衡的,植物不会受到伤害。在病原-寄主互作过程中,活性氧作为植物细胞的信号传导分子,在病原菌入侵后迸发[22],诱导抗氧化系统活性增强,从而引起植物对胁迫的响应。镰刀菌根腐病侵染烟株后,根系活性氧自由基大量产生,从而诱导了SOD、CAT等抗氧化酶类活性增强,与前人研究结果一致[23,24]。抗氧化酶类活性的增强是烟株对病原菌入侵的早期防卫反应,对于提高烟株自身抗病性具有重要意义。APX是植物体内清除H2O2的一种重要抗氧化酶类,烟株被镰刀菌根腐病病原菌侵染后根系APX活性与对照相比显著降低,与前述SOD和CAT等抗氧化酶类活性的变化趋势并不相同,可能原因在于H2O2诱导了烟株根系的程序性细胞坏死反应,防止病原菌进一步侵染,而APX活性降低,可以防止H2O2的降解,该变化趋势与Mittler等[25]对于烟株感染烟草花叶病毒的研究结果一致。
植物与病原菌互作过程中会发生代谢变化,而酚类化合物次生代谢是最为显著的变化之一,PAL、POD和PPO与酚类化合物的合成和氧化密切相关,对植物抗病性发挥重要作用。PAL是植物体苯丙烷类物质代谢的限速酶,是进行抗、感品种比较和证明抗病因子作用的重要指标之一。前人研究表明病原菌的侵染和病原菌毒素处理都能诱导苯丙氨酸解氨酶活性增强,且酶活增强与抗病性正相关[26]。本研究烟株根系被病原菌侵染后PAL活性显著高于对照,与前人在甘蔗等研究中的结果一致[27]。PAL活性升高可以促进苯丙烷类物质代谢,产生更多的代谢物,阻挡病原菌的入侵,从而降低病原菌造成的危害。POD可以催化H2O2或者氢过氧化物类似物反应,清除活性氧自由基,同时它还参与植物酚类的聚合和氧化,以及木质素和植保素的合成代谢,在植物抗病性中发挥重要作用。本研究中病原菌侵染后烤烟根系POD活性显著高于对照。PPO催化木质素和其他酚类氧化物的形成从而抵抗病原菌入侵,也与植物抗病性密切相关[28,29],本研究中烤烟感病后根系PPO活性明显升高,约为对照的2倍。
GSH-Px是谷胱甘肽氧化还原循环中催化还原型谷胱甘肽(GSH)氧化的主要酶之一,能够特异地催化GSH与活性氧反应,生成氧化型谷胱甘肽(GSSG),从而保护生物膜免受活性氧的损害,维持细胞的正常功能;GST具有GSH-Px活性,可以修复氧化破坏的DNA、蛋白质等大分子。本研究结果显示,病原菌侵染后GSH-Px和GST活性均显著升高。
在植物代谢过程中会产生超氧阴离子自由基,它可攻击生物大分子,如脂质、蛋白质、核酸和聚不饱和脂肪酸等,引起细胞结构和功能的破坏,超氧阴离子清除能力与机体衰老和病变有很密切的关系。本研究病原菌侵染后超氧阴离子清除能力显著上升,约为对照根系的2倍。T-AOC是各种大小分子抗氧化物质和抗氧化酶等构成的总抗氧化水平,体现了该体系的抗氧化能力总和,病原菌侵染后T-AOC含量极显著升高,约为对照的12倍。
PRO也与植物抗逆性密切相关,前人对于干旱和低温等非生物胁迫的研究表明,逆境条件下烟草游离PRO含量有所增加,可以增强其抗逆性[30,31]。本研究结果显示,病原菌侵染后烤烟根系游离PRO含量为对照根系的3倍,极显著高于对照。活性氧的大量产生如果超出了植物清除活性氧的能力,会造成氧化胁迫,进而造成蛋白质、膜脂、DNA及其他细胞组分受到损伤,造成氧化损伤。MDA是膜脂过氧化的产物之一,通过与细胞中多种成分发生化学反应,引起寄主防御反应的发生[32],其含量的多少直接体现了活性氧对膜脂的毒害和损伤程度[33,34]。本研究病原菌侵染后的烤烟根系MDA含量显著高于对照,表明病原菌对根系的细胞结构和功能造成了严重破坏,活性氧造成的损害较为严重,与梁郸娜等[32]在黄瓜、黄伟等[35]在苜蓿上的研究结果一致。
4 结论
烤烟根系被病原菌侵染后,基因表达发生变化,抗病相关基因、代谢以及内源激素合成相关基因表达量上升。同时根系发生了显著的生理生化变化,为了能够保持正常生长发育,激发了体内的一系列防御性酶类发挥作用,如SOD、POD、CAT、PPO、PAL等,同时PRO和MDA含量增加,抗氧化物质和渗透调节等物质含量的上升都在烤烟抵御病原菌侵染的过程中发挥着重要的保护和修复作用,这些酶类和物质的活性变化有效抑制了活性氧自由基的产生,并提高了植物对病原菌胁迫的抵抗能力。

