超声引导下连续胸椎旁神经阻滞对乳腺癌术后疼痛综合征的影响
袁炳林 黄焕森
1.广州医科大学研究生院,广东广州 511436;2.广东省中山市人民医院手术麻醉一科,广东中山 528403;3.广州医科大学附属第二医院,广东广州 510260
乳腺癌术后疼痛综合征为乳腺癌术后较为常见慢性神经病理性疼痛,继发手术急性疼痛后,肩部、腋窝、胸部及上部出现的3个月以上的慢性疼痛[1-2]。乳腺癌术后疼痛综合征为乳腺癌根治术常见并发症,发病率为20%~52%,疼痛可持续数年,直接影响患者生活质量,同时增加患者经济负担,严重影响患者正常生活[3]。研究显示,积极有效治疗乳腺癌术后急性疼痛可有效预防乳腺癌术后疼痛综合征发生[4]。近年来,随着医学进步,超声引导技术在麻醉时的不断应用,胸椎旁神经组织在乳腺癌根治术和术后镇痛中发挥重要作用[5]。本研究探讨超声引导下连续胸椎旁神经阻滞在乳腺癌术后疼痛综合征的意义,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年1月至2019年6月在中山市人民医院应用乳腺癌根治术治疗的乳腺癌根治术治疗患者120例,按数字法随机分为两组,每组各60例。试验组年龄32~77岁,平均(54.7±7.6)岁,体重指数(BMI)为(24.01±2.64)kg/m2,按照美国麻醉医师协会分级,Ⅰ级37例,Ⅱ级23例;对照组患者年龄30~76岁,平均(54.0±6.9)岁,BMI为(24.16±2.72)kg/m2,Ⅰ级35例,Ⅱ级25例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经中山市人民医院医学伦理委员会批准。
1.2 纳入及排除标准
纳入标准[6-7]:患者均自愿参与,并签署知情同意书,均行乳腺癌根治术治疗,女性,年龄18~80岁。排除标准[8]:局麻药过敏史、慢性疼痛史、精神系统疾病、神经系统疾病、长期镇痛药物服用史、穿刺部位感染、严重脊柱畸形、开胸手术史、术后感染、妊娠期、哺乳期、凝血功能障碍、严重肝肾及心肺功能不全等。
1.3 方法
所有患者术前禁食禁水,入室开放外周静脉通路,常规进行心电图、心率、脑电双频谱指数等监测。
对照组进行常规全麻诱导,咪达唑仑(宜昌人福药业,国药准字H20067041,生产批号:01G06021,2 ml∶ 10 mg)剂量 0.03 mg/kg,芬太尼(宜昌人福药业,国药准字H42022076,生产批号91D06141,2 ml∶ 0.1 mg)剂 量 3 μg/kg,丙泊 酚(北京费森尤斯卡比医药,国药准字J20160098,生产批号 16NE4409,50 ml∶ 0.5 g)剂量 1.5 mg/kg,顺式阿曲库铵[上药东英(江苏)药业,国药准字H20123332,生产批号 A21190501,10 mg/瓶 ]剂量0.15 mg/kg,静脉注射,成功置入喉罩后进行机械控制通气。
试验组给予连续胸椎旁神经阻滞联合全麻,经超声引导对术侧肋间T3椎旁神经进行阻滞,置管,患者取侧卧位,健侧在下,确定并标记穿刺节段棘突,确定T3椎间隙,常规消毒,探头于T3矢状面沿肋间进行探头扫查,探头置于两根肋骨间,超声可见胸膜、肋横突韧带、横突,确定胸椎旁间隙。应用穿刺针于探头外侧进针,经超声全程观察超声针进针过程,针尖至肋横突韧带,推注0.9%氯化钠注射液2 ml,判断针尖位置,缓慢进针进入肋横突韧带,回抽无血、无脑脊液,注射0.5%罗哌卡因(Astrazeneca AB,SE-151 85,Sweden,国药准字 H20140764,生 产 批 号 LBSG,75 mg ∶ 10 ml)20 ml,壁层胸膜由于注入药物向下受压,椎旁间隙扩张,判定针尖为理想位置。完成注药,将针芯退出,在胸椎旁间隙放置3 cm左右导管,固定导管。起效15 min进行全麻诱导,方法同对照组。两组患者均应用1%丙泊酚静脉把控输注,2~3 μg/ml。间断静脉注射芬太尼,手术过程中,麻醉深度监测(BIS)应保持在45~60。心率和平均动脉压水平显著增加,应追加芬太尼,保持波动不超过基础值上下20%。对照组应用自控静脉镇痛,舒芬太尼(宜昌人福药业,国药准字H20054171,生产批号 91A10331,1 ml∶ 50μg/kg )剂量 2 μg/kg,托烷司琼(北京华泰制药,国药准字H20020564,生产批号 1701222,2 ml:4.48 mg)剂量 30 mg,地佐辛(扬子江药业,国药准字H20080329,生产批号16120121,1 ml:5 mg)剂量 0.3 mg/kg,溶于生理盐水250 ml,背景输注剂量为5 ml/h,自控镇痛剂量3 ml,时间15 min。试验组应用连续胸椎旁神经自控镇痛,0.2%罗哌卡因250 ml,背景剂量、自控镇痛、锁定时间同对照组。术后疼痛管理应保证术后疼痛数字评分低于4分,若NRS评分4分及以上,应静脉注射地佐辛,剂量5 mg。
1.4 观察指标及评价标准
记录两组患者围术期指标,包括手术时间、术中出血量、芬太尼用量、丙泊酚用量。镇痛效果包括有效按压次数、补救镇痛率、镇痛满意率,其中术后疼痛数字评分评分低于3分表示术后镇痛满意。记录患者术后3、6、12个月乳腺癌术后疼痛综合征发生率,乳腺癌术后疼痛综合征判断根据国际疼痛学会和相关文献[9-10],从疼痛性质、疼痛部位和疼痛时间进行评估,疼痛性质包括麻木、灼烧痛、电击痛、针刺痛,同幻肢痛相似乳房幻觉痛;疼痛被包括前胸、手臂、腋窝;疼痛可在术后立即出现,应用NPS量表评价[11]包括蚁走感、相关症状、痛觉过敏、疼痛特征,共10个问题,满分10分,4分以上为乳腺癌术后疼痛综合征。记录患者术后白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平。
1.5 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料用()表示,组间比较采用t检验;计数资料用[(n%)]表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者围术期指标比较
两组的手术时间和术中出血量比较,差异无统计学意义(P>0.05),试验组的芬太尼用量、丙泊酚用量、住院时间少于对照组,差异有统计学意义(P< 0.05),见表 1。
表1 两组患者围术期指标比较()
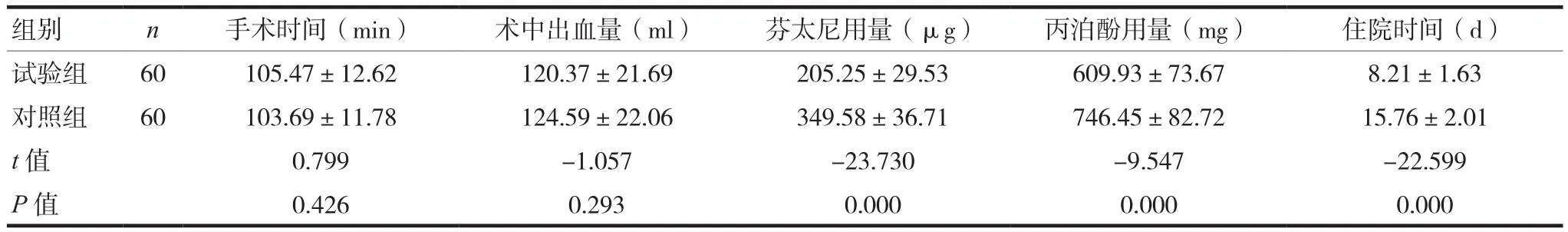
表1 两组患者围术期指标比较()
组别 n 手术时间(min) 术中出血量(ml) 芬太尼用量(μg) 丙泊酚用量(mg) 住院时间(d)试验组 60 105.47±12.62 120.37±21.69 205.25±29.53 609.93±73.67 8.21±1.63对照组 60 103.69±11.78 124.59±22.06 349.58±36.71 746.45±82.72 15.76±2.01 t值 0.799 -1.057 -23.730 -9.547 -22.599 P值 0.426 0.293 0.000 0.000 0.000
2.2 两组患者镇痛效果比较
试验组的有效按压次数少于对照组,补救镇痛率低于照组,镇痛满意率高于对照组,差异均有统计学意义(P<0.05),见表2。
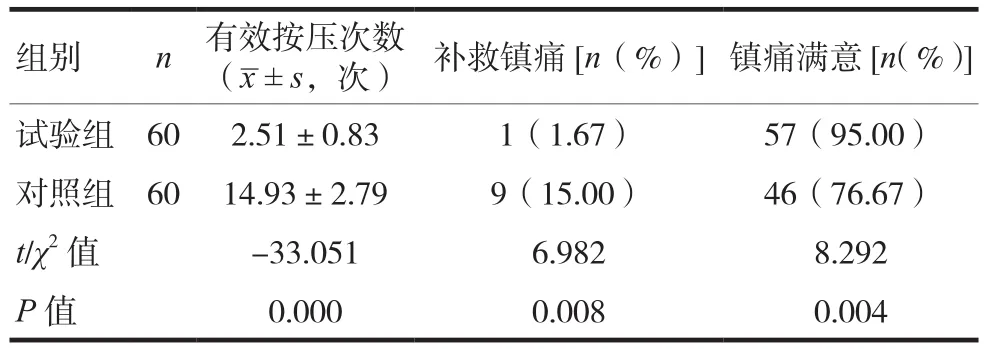
表2 两组患者镇痛效果比较
2.3 两组患者乳腺癌术后疼痛综合征发生率比较
试验组的术后3、6和12个月乳腺癌术后疼痛综合征发生率低于对照组,差异有统计学意义(P<0.05),见表3。
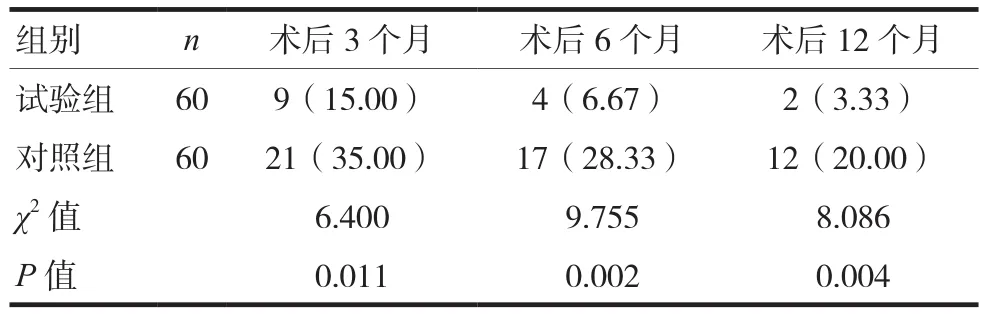
表3 两组患者乳腺癌术后疼痛综合征发生率比较[n(%)]
2.4 两组患者炎症因子水平比较
治疗后两组患者IL-6、TNF-α均较治疗前明显降低,差异有统计学意义(P<0.05),且治疗后试验组的IL-6、TNF-α低于照组,差异有统计学意义(P< 0.01),见表 4。
表4 两组患者炎症因子水平比较(,ng/L)

表4 两组患者炎症因子水平比较(,ng/L)
注:与同组内治疗前比较,*P<0.05
组别 n IL-6 TNF-α治疗前 治疗后 治疗前 治疗后试验组 60 97.25±15.62 53.24±11.62* 2.59±0.32 1.03±0.11*对照组 60 97.01±14.71 87.69±16.71* 2.61±0.24 2.07±0.19*t值 0.087 -13.111 -0.387 -36.396 P值 0.931 0.000 0.699 0.000
3 讨论
乳腺癌手术操作损伤乳腺周围组织、胸壁神经,痛觉信号经传导至脑皮质区导致乳腺癌术后患者常出现中度以上急性疼痛[12-15]。若术后急性疼痛未得到有效控制,可使外周伤害性感受器持续被刺激,促进致痛因子、炎症介质释放,外周敏化,脊髓背角神经元出现可塑性变化,发生乳腺癌术后疼痛综合征。乳腺癌术后疼痛综合征发生机制目前尚未完全明确,涉及多个阶段,多种因素,目前主要认为其同手术损伤肋间神经导致肋间神经痛、神经可塑性改变、下行传导通路、持续炎症反应等有关,同时放化疗、年龄、手术类型和术后急性疼痛管理均是导致乳腺癌术后疼痛综合征的危险因素,术后急性疼痛程度为引起术后疼痛慢性化重要风险因素[16-18]。
乳腺癌术后疼痛综合征为慢性神经病理性疼痛,其发生发展同急性期疼痛管理相关,多项研究显示,围术期有效控制疼痛可降低乳腺癌术后疼痛综合征发生率[19-21]。超声引导下连续胸椎旁神经阻滞,局麻药物直接作用在胸交感神经链、肋间神经、脊膜返支,阻滞运动、感觉、交感神经,单点局麻药可扩散使4~5个节段感觉阻滞[22-23]。
本研究显示,试验组芬太尼用量,丙泊酚用量,住院时间,有效按压次数,补救镇痛率,3、6和12个月乳腺癌术后疼痛综合征发生率,IL-6、TNF-α水平较对照组明显下降,镇痛满意率较对照组显著提高(P<0.05),与靳红绪等[24]的研究结果基本一致。超声引导下连续胸椎旁神经阻滞降低乳腺癌术后疼痛综合征发生率可能同预先镇痛,有效降低对外周神经感受器刺激,阻断信号传导通路,抑制炎症反应,避免外周、中枢敏化,抑制神经元可塑性变化,同时可减少术后炎症发生,有利于降低术后疼痛综合征[25-27]。
综上所述,乳腺癌根治术患者应用超声引导下连续胸椎旁神经阻滞,缩短住院时间,可降低乳腺癌术后疼痛综合征发生率,效果显著,但其发生机制还有待进一步研究和探索。

