消癌解毒方提取物对乳腺癌细胞增殖活力、细胞周期蛋白、PI3K/AKT通路的调节作用
李佳 杨晓丹 刘永叶


【摘要】 目的:研究消癌解毒方提取物对乳腺癌细胞增殖活力、细胞周期蛋白、PI3K/AKT通路的调节作用。方法:培养乳腺癌MDA-MB-231细胞并分为用不含血清及药物的DMEM处理的对照组、用含有不同浓度(0.375、0.75、1.5 mg/mL)消癌解毒方提取物DMEM处理的提取物组,测定细胞增殖活力、细胞周期及细胞周期蛋白、PI3K/AKT通路分子的表达水平。结果:不同浓度提取物组细胞增殖抑制率均显著高于对照组,且随着浓度的增加、时间的延长,细胞增殖抑制率明显升高;不同浓度提取物组G0/G1期比例及p53、p21的mRNA表达水平均显著高于对照组,G2/M期比例及CyclinD1、CyclinB1、PI3K、AKT、mTOR的mRNA表达水平均明显低于对照组,且随着浓度的增加,G0/G1期比例及p53、p21的mRNA表达水平明显升高,G2/M期比例及CyclinD1、CyclinB1、PI3K、AKT、mTOR的mRNA表达水平均明显降低。结论:消癌解毒方提取物对乳腺癌细胞增殖活力、细胞周期具有抑制作用,拮抗PI3K/AKT通路是潜在的分子机制。
【关键词】 乳腺癌 消癌解毒方 增殖 细胞周期 PI3K/AKT
[Abstract] Objective: To study the regulatory effects of extracts of Xiaoai Jiedu Decoration on proliferation activity, cell cycle protein and PI3K/AKT pathway of breast cancer cells. Method: Breast cancer MDA-MB-231 cells were cultured and divided into the control group treated with DMEM without serum and drugs and the extract group treated with DMEM containing different concentrations (0.375, 0.75, 1.5 mg/mL) of Xiaoai Jiedu Decoration. Then cell proliferation activity, cell cycle and the expression of cell cycle protein, PI3K-AKT pathway molecule were determined. Result: The inhibition rate of cell proliferation in different concentration extract group were significantly higher than that in the control group, and the inhibition rate of cell proliferation significantly increased with the increase of concentration and time. The ratio of G0/G1 phase and the mRNA expression levels of p53, p21 in different concentration extract group were significantly higher than those in the control group, and the ratio of G2/M phase and he mRNA expression levels of CyclinD1, CyclinB1, PI3K, AKT and mTOR were significantly lower than those of the control group. The ratio of G0/G1 phase and the mRNA expression levels of p53, p21 significantly increased with the increase of concentration and he ratio of G2/M phase and he mRNA expression levels of CyclinD1, CyclinB1, PI3K, AKT and mTOR significantly decreased with the increase of concentration. Conclusion: The extract of Xiaoai Jiedu Decoration has inhibitory effect on proliferation and cell cycle of breast cancer cells, antagonism of PI3K/AKT pathway is a potential molecular mechanism.
[Key words] Breast cancer Xiaoai Jiedu Decoration Proliferation Cell cycle PI3K/AKT
First-authors address: General Hospital of the Northern Theater of the Chinese Peoples Liberation Army, Shenyang 110016, China
doi:10.3969/j.issn.1674-4985.2021.06.006
乳腺癌是女性最常見的恶性肿瘤,近年来的发病率呈升高趋势,临床上治疗乳腺癌的常用方法包括手术切除、放化疗、内分泌治疗等,在手术切除后进行放化疗、内分泌治疗能有效提高患者生存率、延长生存时间[1-2]。尽管如此,乳腺癌患者在放化疗、内分泌治疗过程中所出现的耐药、毒副反应等会影响疗效,因而研发更加高效低毒的抗肿瘤药物是乳腺癌研究的热点。消癌解毒方是重要抗药方剂,由白花蛇舌草、半枝莲、山慈菇、莪术、太子参和麦冬组成,其中药功效是驱邪扶正,相关细胞学研究则证实消癌解毒方中的多种药材能在体外发挥抗结肠癌、抗肝癌的作用[3-4],但关于消癌解毒方的抗卵巢癌作用尚不明确。PI3K/AKT通路活化所介导的细胞增殖活力增强、细胞周期加速是卵巢癌发病的重要分子机制之一。为了明确消癌解毒方用于卵巢癌治疗的价值,本研究具体分析了消癌解毒方提取物对乳腺癌细胞增殖活力、细胞周期蛋白、PI3K/AKT通路的调节作用。现报道如下。
1 材料与方法
1.1 材料 MDA-MB-231细胞购自ATCC公司,DMEM、胎牛血清(FBS)、胰蛋白酶购自Gibco公司,四甲基偶氮唑盐(MTT)、碘化丙啶(PI)、二甲基亚砜(DMSO)购自Sigma公司,超纯RNA提取试剂盒、SuperRT cDNA第一链合成试剂盒、UltraSYBR Mixture试剂盒购自北京康为世纪公司。
1.2 方法
1.2.1 消癌解毒方提取物的制备 白花蛇舌草154 g,莪术77 g,半枝莲39 g,山慈菇77 g,太子参77 g,麦冬77 g,加10倍量水煎煮2 h后收集滤液,再加入8倍量水煎煮1.5 h后收集滤液,合并两次滤液并浓缩为生药含量为2 g/mL的药液,加入乙醇至乙醇含量为70%,静置过夜后抽滤得到滤液,浓缩、低温干燥后得到浸膏粉,取0.3 g浸膏粉溶解在1 mL DMSO中备用。
1.2.2 细胞培养与分组 MDA-MB-231细胞用含有10%FBS的DMEM进行培养,细胞数量大85%融合后用胰蛋白酶消化,将消化后得到细胞悬液的密度调节至2×108/L,接种在培养板中并分为对照组和不同浓度消癌解毒方提取物处理的提取物组,对照组用不含血清及药物的DMEM处理,提取物组用含有0.375、0.75、1.5 mg/mL消癌解毒方提取物的DMEM处理。
1.2.3 细胞增殖检测 细胞接種在96孔板中,每孔100 μL,不同条件处理24、48、72 h后,采用MTT法测定细胞增殖活力,向每孔内加入5 mg/mL的MTT溶液10 μL,培养箱中孵育4 h后弃培养基并向每孔加入DMSO 150 μL,震荡15 min后在酶标仪上测定570 nm处的吸光值(OD),按照公式(OD对照组-OD提取物组)/OD对照组计算增殖抑制率。
1.2.4 细胞周期检测 细胞接种在12孔板中,每孔500 μL,不同条件处理72 h后,采用胰蛋白酶消化并收集细胞,磷酸盐缓冲液洗涤后加入70%乙醇0.5 mL、4 ℃固定过夜,第2天用磷酸盐缓冲液洗去乙醇后加入400 μL PI染色液后混匀,避光染色30 min后在流式细胞仪上测定细胞周期。
1.2.5 基因表达检测 细胞接种在6孔板中,每孔1.5 mL,不同条件处理72 h后,采用超纯RNA提取试剂盒提细胞中的RNA,采用SuperRT cDNA第一链合成试剂盒将RNA反转录为cDNA,采用UltraSYBR Mixture试剂盒对cDNA进行PCR扩增,根据扩增曲线计算CyclinD1、CyclinB1、p53、p21、PI3K、AKT、mTOR的mRNA相对表达水平。
1.3 统计学处理 采用SPSS 21.0软件对所得数据进行统计分析,计量资料用(x±s)表示,多组间比较采用方差分析,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度消癌解毒方提取物对MDA-MB-231细胞增殖的抑制作用 与对照组比较,不同浓度消癌解毒方提取物组均可明显抑制MDA-MB-231细胞的增殖,随着时间延长、浓度增加,细胞增殖抑制率明显升高,具有明显的浓度依赖性和时间依赖性,见表1。
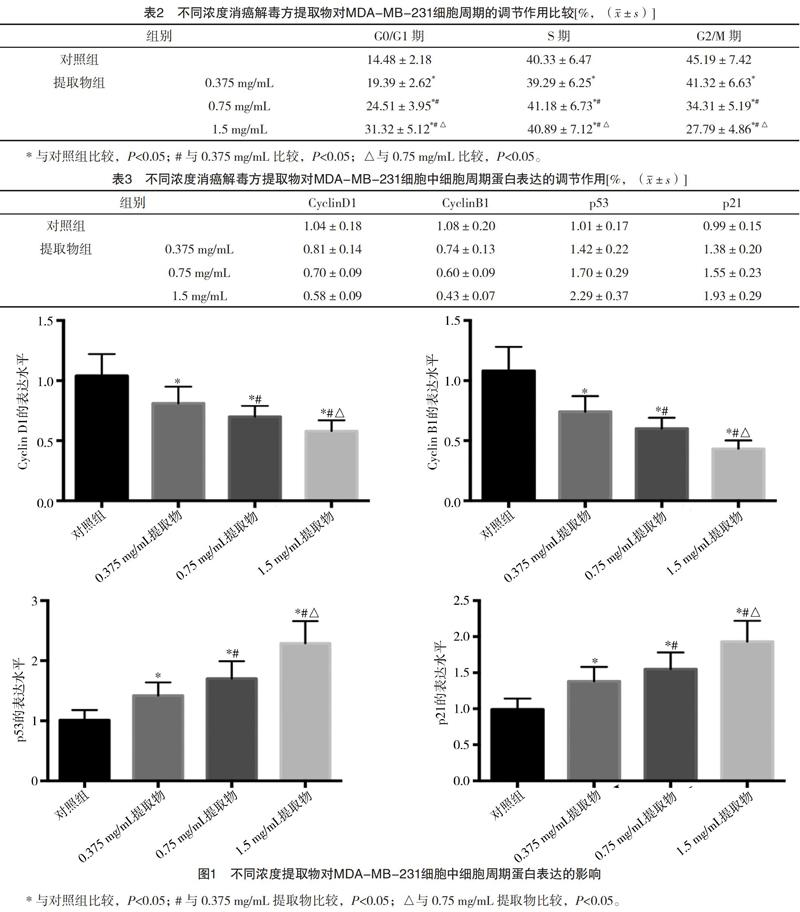
2.2 不同浓度消癌解毒方提取物对MDA-MB-231细胞周期的调节作用 与对照组比较,不同浓度消癌解毒方提取物组细胞G0/G1期比例显著升高,G2/M期比例明显降低,S期比例无显著变化,G0/G1期、G2/M期的变化具有明显的浓度依赖性,见表2。
2.3 不同浓度消癌解毒方提取物对MDA-MB-231细胞中细胞周期蛋白表达的调节作用 与对照组比较,不同浓度消癌解毒方提取物组中CyclinD1、CyclinB1的mRNA表达水平显著降低,p53、p21的mRNA表达水平显著增加,具有明显的浓度依赖性,见表3和图1。
2.4 不同浓度消癌解毒方提取物对MDA-MB-231细胞中PI3K/AKT通路分子表达的调节作用 与对照组比较,不同浓度消癌解毒方提取物组PI3K、AKT、mTOR的mRNA表达水平显著降低,具有明显的浓度依赖性,见表4和图2。
3 讨论
我国乳腺癌的发病率逐年升高且呈现年轻化趋势,同时该病也是造成我国45岁以下女性死亡的主要病因之一[5-6]。虽然近年来化疗药物、内分泌治疗药物、靶向治疗药物在乳腺癌治疗中的应用不断推广,患者的预后得到了较大改善,但仍有部分患者会在治疗过程中出现耐药及毒副反应,疗效仍有较大提升空间。中药材的抗肿瘤作用日益受到关注,消癌解毒方是具有广泛抗癌作用的中药方剂,该方剂中的白花蛇舌草、半枝莲、山慈菇、莪术、太子参和麦冬已被多项离体细胞实验证实具有抑癌作用,能使乳腺癌、肺癌、肝癌等多种恶性肿瘤细胞的增殖、侵袭、血管新生等恶性生物学行为受到抑制[7-11],但关于该方剂用于乳腺癌治疗的价值仍缺乏研究支持。
本研究以离体培养的乳腺癌MDA-MB-231细胞为实验对象,制备消癌解毒方提取物后在离体水平分析了消癌解毒方的抗乳腺癌作用。在乳腺癌的病理进程中,病灶内癌细胞增殖活力增强、细胞周期加速是造成肿瘤生长最关键的生物学行为,通过对细胞增殖活力及细胞周期的分析分别发现:不同浓度消癌解毒方提取物能够增加细胞增殖的抑制率且浓度越大、时间越长,细胞增殖抑制率的增加越明显,提示消癌解毒方对乳腺癌的增殖具有抑制作用;不同浓度的消癌解毒方提取物能够增加细胞周期G0/G1期比例、降低G2/M期比例且浓度越大,G0/G1期比例的增加、G2/M期比例的降低越明显,提示消癌解毒方对乳腺癌的细胞周期具有阻碍作用,能够使细胞周期大量停滞于G0/G1期、无法顺利进入G2/M期并完成有丝分裂。结合细胞增殖及细胞周期的分析结果表明,消癌解毒方能够在离体水平发挥抗乳腺癌作用。
乳腺癌细胞周期的进程受到多种细胞周期蛋白的调控,而细胞周期蛋白表达又受到上游PI3K/AKT通路的影响。CyclinB1、CyclinD1是两种重要的细胞周期蛋白,与各自的CDK结合形成复合体后能够加速细胞周期通过G0/G1期、S期、G2/M期的检查点,迅速进入有丝分裂阶段[12-14];上游PI3K/AKT通路发生活化后能够通过级联反应使mTOR的表达增加,mTOR进入细胞核后能够启动CyclinB1、CyclinD1的表达并参与细胞周期的调控[15-17]。p53和p21是两种细胞周期的负性调控基因,能够阻碍细胞周期蛋白与其激酶的结合及活化,进而阻碍细胞周期的进程[18-20]。本研究对上述细胞周期蛋白及PI3K/AKT通路的分析发现:不同浓度消癌解毒方提取物能够降低细胞中CyclinD1、CyclinB1、PI3K、AKT、mTOR的mRNA表达水平,增加p53、p21的mRNA表达水平且浓度越大,CyclinD1、CyclinB1、PI3K、AKT、mTOR表达的降低及p53、p21表达的增加越明显。这一结果表明消癌解毒方对乳腺癌细胞中细胞周期蛋白及PI3K/AKT均具有负性调控作用。
综上所述,消癌解毒方提取物对乳腺癌细胞增殖活力、细胞周期具有抑制作用,拮抗PI3K/AKT通路是消癌解毒方发挥抗乳腺癌作用的潜在分子机制。
参考文献
[1]李霓,郑荣寿,张思维,等.中国城乡女性乳腺癌发病趋势分析和预测[J].中华预防医学杂志,2012,46(8):703-707.
[2]陈万青,郑荣寿.中国女性乳腺癌发病死亡和生存状况[J].中国肿瘤临床,2015,42(13):668-674.
[3]谭佳妮,石文静,沈卫星,等.消癌解毒方对结肠癌的抑制作用及对Treg细胞的影响[J].南京中医药大学学报,2017,33(5):515-518.
[4]李文婷,赵凤鸣,周红光,等.消癌解毒方對人肝癌SMMC-7721细胞相关趋化因子蛋白表达的影响[J].中药新药与临床药理,2015,26(4):464-467.
[5]陈万青,郑荣寿,曾红梅,等.2011年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2015,24(1):1-10.
[6]陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-8.
[7]曾永长,梁少瑜,吴俊洪,等.白花蛇舌草化学成分及其抗肿瘤活性[J].中成药,2018,40(8):1768-1772.
[8]李玉凤,李静,王晴,等.半枝莲多糖对Lewis肺癌小鼠VEGF、EGFR、nm23表达的影响[J].光明中医,2017,32(1):46-48.
[9]杨雪威,王思源,赵佳,等.山慈菇提取液对乳腺癌大鼠肿瘤组织血管内皮生长因子和基质金属蛋白酶-9表达的影响[J].中国临床药理学杂志,2018,34(7):838-840,856.
[10]李慧乐,莫传伟,赵春辉,等.莪术提取物榄香烯对肝癌H22荷瘤小鼠的抑瘤作用[J].中国临床药理学杂志,2018,34(11):1345-1348.
[11]胡澄,蒋日磊,郭园园,等.麦冬皂苷B通过Myt/Cdc2信号通路抑制H460细胞有丝分裂[J].中国药理学通报,2017,33(12):1736-1739.
[12] Sabbaghi M,Gil-Gómez G,Guardia C,et al.Defective Cyclin B1 Induction in Trastuzumab-emtansine(T-DM1) Acquired Resistance in HER2-positive Breast Cancer[J].Clin Cancer Res,2017,23(22):7006-7019.
[13] Gennaro V J,Stanek T J,Peck A R,et al.Control of CCND1 ubiquitylation by the catalytic SAGA subunit USP22 is essential for cell cycle progression through G1 in cancer cells[J].Proc Natl Acad Sci,2018,115(40):9298-9307.
[14] Gwon D H,Lee W Y,Shin N,et al.BMAL1 Suppresses Proliferation, Migration, and Invasion of U87MG Cells by Downregulating Cyclin B1,Phospho-AKT,and Metalloproteinase-9[J].Int J Mol Sci,2020,21(7):2352.
[15] Kenna M M,McGarrigle S,Pidgeon G P.The next generation of PI3K-Akt-mTOR pathway inhibitors in breast cancer cohorts[J].Biochim Biophys Acta Rev Cancer,2018,1870(2):185-197.
[16] Hamadneh L,Abuarqoub R,Alhusban A,et al.Upregulation of PI3K/AKT/PTEN pathway is correlated with glucose and glutamine metabolic dysfunction during tamoxifen resistance development in MCF-7 cells[J].Sci Rep,2020,10(1):21933.
[17] Fujimoto Y,Morita T Y,Ohashi A,et al.Combination treatment with a PI3K/Akt/mTOR pathway inhibitor overcomes resistance to anti-HER2 therapy in PIK3CA-mutant HER2-positive breast cancer cells[J].Sci Rep,2020,10(1):21762.
[18] Tonnessen-Murray C,Ungerleider N A,Rao S G,et al.p53 Mediates Vast Gene Expression Changes That Contribute to Poor Chemotherapeutic Response in a Mouse Model of Breast Cancer[J].Transl Oncol,2018,11(4):930-940.
[19] Li K,Xu X,He Y,et al.P21-activated kinase 7(PAK7) interacts with and activates Wnt/β-catenin signaling pathway in breast cancer[J].J Cancer,2018,9(10):1821-1835.
[20] Borges B C,Uehara I A,Dos Santos M A,et al.The Recombinant Protein Based on Trypanosoma cruzi P21 Interacts with CXCR4 Receptor and Abrogates the Invasive Phenotype of Human Breast Cancer Cells[J].Front Cell Dev Biol,2020,19(8):569729.
(收稿日期:2020-12-03) (本文编辑:程旭然)

