一株西藏牦牛源多杀性巴氏杆菌基因分型及rpoE基因生物信息学分析
周赛赛 李天娇 武 琦 朱家平 罗 宗 吕 然 赵晓慧 王一飞 罗润波 贡 嘎 王保宁,2 索朗斯珠*
(1.西藏农牧学院 动物科学学院,西藏 林芝 860000; 2.四川大学 华西基础医学与法医学院,成都 610041)
多杀性巴氏杆菌(Pasteurellamultocida,Pm)归属巴氏杆菌目、巴氏杆菌科、巴氏杆菌属,革兰阴性两极浓染、无芽孢的兼性厌氧短小杆菌,因巴斯德在1880年首次从家禽霍乱爆发病例中分离而得名[1-2]。多杀性巴氏杆菌不仅引起多种畜禽发病[3-8],也是人多种疾病的病原体[9-11]。多杀性巴氏杆菌不仅影响我国的多种动物[12-16],亚洲、欧洲、非洲的多个国家均有报道[17-23]。近些年,荚膜A型和B型多杀性巴氏杆菌一直影响着我国牛产业体系的发展,且病死率高,有区域流行性。
近些年本课题组通过对西藏地区牦牛源多杀性巴氏杆菌流行病学调查发现,牦牛Pm感染率较高,严重影响了我国牦牛产业的发展[4,13]。目前国内尚无专用于防控牦牛多杀性巴氏杆菌的商品化疫苗,商品化牛源多杀性巴氏杆菌疫苗主要以灭活苗为主,临床试验发现因不了解牦牛源多杀性巴氏杆菌基因型,盲目用商品化牛源多杀性巴氏杆菌灭活疫苗免疫西藏牦牛,导致不能有效的防控该病,所以了解西藏地区牦牛源多杀性巴氏杆菌的基因型是选择和制备疫苗的前提,也将有利于防控西藏牦牛出血性败血症。Carter[24]于1952年根据细菌荚膜抗原性、特异性,利用血凝试验将多杀性巴氏杆菌进行了A、B、D和E荚膜分型;Rimler等[25]于1987年从火鸡中分离出了多杀性巴氏杆菌,随后根据Carter的分型方法鉴定出其荚膜F型。Harper等[26]基于脂多糖外核编码基因簇建立了多重PCR方法,将Pm分为L1~L8基因型,8种基因型和传统Heddleston等[27]血清分型间有一定的对应关系,但比传统Heddleston血清分型方法有较高的精确度。Maiden等[28]于1998年利用PCR扩增了多个管家基因内部片段(约7个管家基因),建立了多位点序列分型(Multilocus sequence typing,MLST)方法,该方法已经被用于细菌、真菌的分型研究中。目前利用MLST分型鉴定多杀性巴氏杆菌,ST型已有142种,因多杀性巴氏杆菌基因型众多,若不能了解西藏地区牦牛源多杀性巴氏杆菌的基因型,将严重影响该地区的疫病防控。
rpoE是一种控制基因转录和翻译的 σ 因子,基因编码的RpoE蛋白是 σ 70蛋白家族成员,在维持细菌内环境稳定、毒力、非致死性环境胁迫的过程中有调节作用[29-31]。王林柏[32]已经验证rpoE为兔巴氏杆菌的一种毒力因子,是良好的减毒疫苗候选蛋白。据报道rpoEσ 因子在沙门氏菌[33]、溶藻性弧菌[34]、大肠杆菌[35]和放线杆菌[36]等细菌中具有调节生物膜合成和适应外界应激能力的重要作用。虽有A型多杀性巴氏杆菌关于RpoE蛋白在免疫保护效力方面的研究[37],但缺少对多杀性巴氏杆菌rpoE基因的生物信息学分析,西藏牦牛源多杀性巴氏杆菌rpoE基因的研究更是空白。
本研究通过分子学方法对本实验室分离保存的一株西藏牦牛源多杀性巴氏杆菌进行荚膜分型、脂多糖分型、多位点序列分型鉴定,利用生物信息学方法对rpoE基因及其编码蛋白进行理化性质、亲水和疏水性、跨膜结构域、基因信号肽、亚细胞定位预测、蛋白保守结构域、潜在氨基酸磷酸化位点、二级结构和三级结构、B细胞线性抗原表位、蛋白互作分析,旨在了解西藏牦牛源Pm的基因型,为后期疫苗研究提供理论依据。
1 材料和方法
1.1 菌株及质粒
本株牦牛源B型Pm、DH5α 感受态细胞由本实验室分离、冷冻保存;pMD -TM18T购自大连宝生物工程有限公司。
1.2 试剂及仪器
PCR扩增的所有引物(表1)由生工生物工程(上海)股份有限公司合成;细菌全基因组提取试剂盒购自天根生化科技(北京)有限公司;Premix TaqTM(Code No.RR901A)、Agarose gel DNA extraction kit(Code No.9762)和Plasmid purification kit(Code No.9760)均购自大连宝生物工程有限公司;微量分光光度计(Thermo NanoDrop 2000,美国);凝胶成像仪(Bio-rad,美国);PCR仪器(Applied Biosystems,美国)。
1.3 全基因组提取及PCR扩增
将平板单菌落挑到含有10% FBS的TSB培养基中培养12 h,细菌基因组提取试剂盒提取DNA,NanoDrop 2000分析DNA浓度和纯度,-20 ℃保存备用;分别用多杀性巴氏杆菌特异性引物(Kmt)、荚膜基因分型引物(PmA、PmB、PmD、PmE和PmF)、脂多糖基因分型引物(L1-L8)、MLST分型扩增引物(adk、aroA、deoD、gdhA、g6pd、mdh和pgi)、σ 因子基因(rpoE)引物PCR扩增,总体系均为50 μL,分别将PCR产物用1.0%琼脂糖凝胶电泳,利用凝胶成像仪拍照保存。
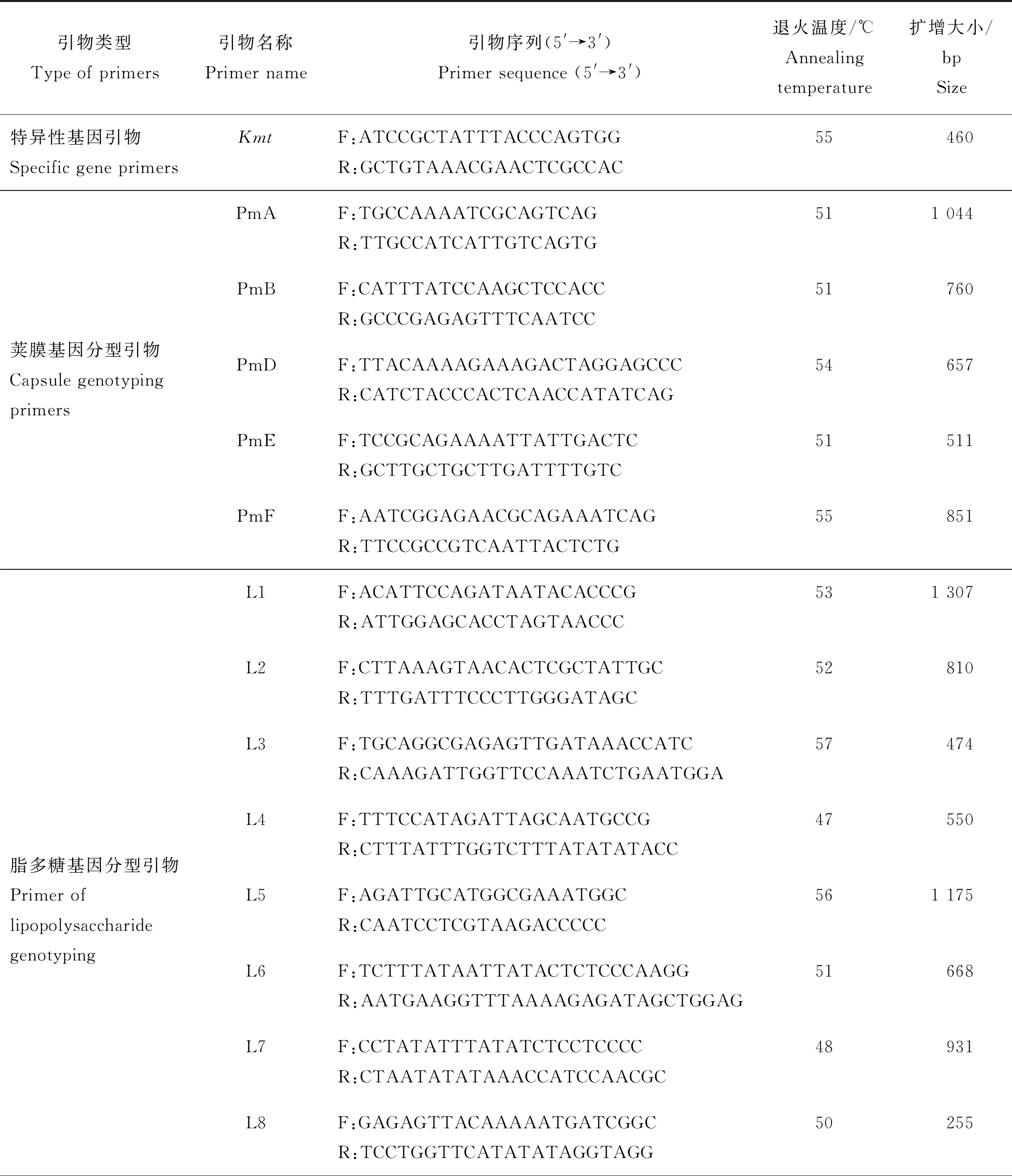
表1 多杀性巴氏杆菌基因扩增相关引物信息Table 1 Related primer information of P. multocida
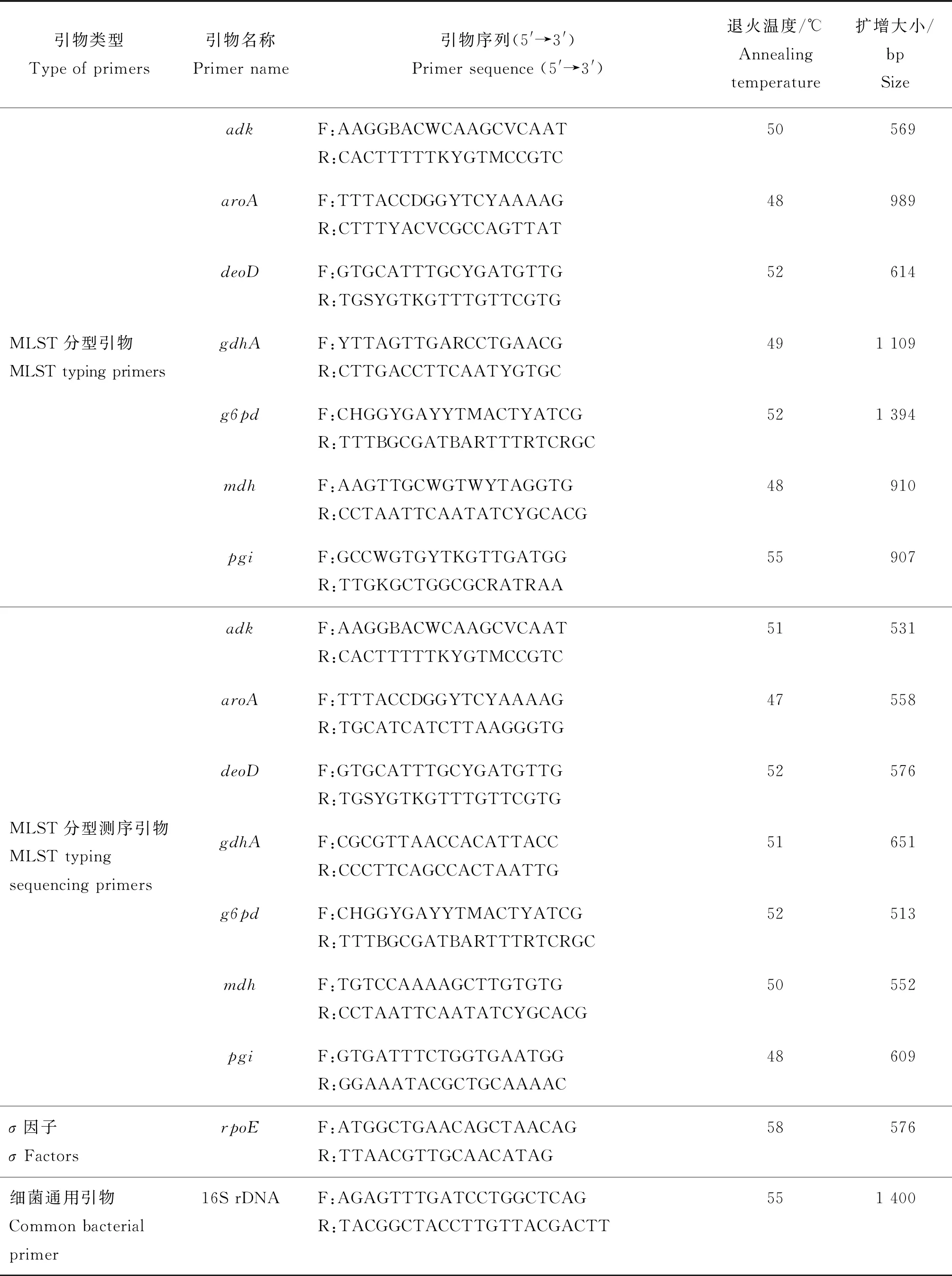
表1(续)
1.4 基因克隆及测序
将阳性产物进行胶回收,过夜连接载体pMDTM-18T,转化至DH5α 感受态细胞,在含100 μg/mL Amp+LB固体培养基过夜培养,挑取单菌落于100 μg/mL Amp+LB液体培养基过夜培养,PCR鉴定,将阳性送生工生物工程(上海)股份有限公司测序。
1.5 测序结果分析
将所有测序结果在NCBI中比对,并下载参考序列;将测序完成的管家基因的序列提交至专门的MLST在线数据库(PasteurellamultocidaMLST Databases:http:∥pubmlst.org/pmultocida/)进行比对明确每个基因T型,并确定牦牛源多杀性巴氏杆菌的ST型;利用MEGA 7.0 对rpoE基因序列进行分析,并构建系统发育进化树。
1.6 rpoE基因生物信息学分析
利用蛋白质在线工具Prot-Param(https:∥web.expasy.org/protparam/)分析RpoE蛋白质的理化性质(分子质量、氨基酸组成、等电点和不稳定系数等);
利用ProtScale(https:∥web.expasy.org/protscale/)分析RpoE蛋白的亲水和疏水性;
利用TMHMM Server(http:∥www.cbs.dtu.dk/services/TMHMM/)预测rpoE基因的跨膜结构域分析;
利用SignalP 4.0 Server(http:∥www.cbs.dtu.dk/services/SignalP-4.0/)对rpoE基因信号肽分析;
通过在线分析工具PSORT Prediction(http:∥psort1.hgc.jp/form.html)可对rpoE基因进行亚细胞定位预测分析;
利用SMART(http:∥smart.embl-heidelberg.de/smart/set_mode.cgi?NORMAL=1)和NCBIConserved Domains(https:∥www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线程序预测RpoE蛋白保守结构域分析;
利用NetPhos 3.1 Server(http:∥www.cbs.dtu.dk/services/NetPhos/)预测RpoE潜在氨基酸磷酸化位点;
利用在线软件SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测RpoE蛋白的二级结构;
利用在线软件SWISS-MODEL(https:∥swissmodel.expasy.org/)预测RpoE蛋白的三级结构;
利用IEDB(http:∥tools.iedb.org/bcell/)和BCPREDS(http:∥ailab-projects1.ist.psu.edu:8080/bcpred/predict.html)在线程序预测RpoE蛋白B细胞线性抗原表位;
利用STRING Version:11.0(https:∥string-db.org/)分析RpoE蛋白与其他蛋白互作关系。
2 结果与分析
2.1 牦牛源多杀性巴氏杆菌荚膜、脂多糖和管家基因扩增
经过对细菌引物PCR扩增,结果见图1~3。

M:DL 2 000 DNA分子量标准;N:阴性对照;1: 16S rDNA 片段;2: Kmt基因;3~7:荚膜分型(A、B、D、E和F);8~15:脂多糖分型(L1~L8) M: DL 2 000 DNA Marker; N: Negative controls; 1: 16S rDNA fragment; 2: Kmt gene; 3-7: Classification of capsule (A、B、D、E and F); 8-15: Classification of lipopolysaccharide (L1-L8)图1 牦牛源多杀性巴氏杆菌荚膜和脂多糖分型Fig.1 Classifications of Pasteurella multocida capsule and lipopolysaccharide from yak
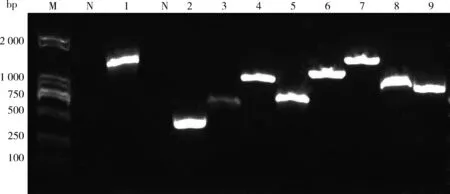
M:DL 2 000 DNA分子量标准;N:阴性对照;1: 16S rDNA 片段;2: Kmt gene;3~9:管家基因(adk、aroA、deoD、gdhA、g6pd、mdh和pgi) M: DL 2 000 DNA Marker; N: Negative controls;1: 16S rDNA fragment; 2: Kmt gene; 3-9: Housekeeping gene (adk、aroA、deoD、gdhA、g6pd、mdh and pgi)图2 牦牛源多杀性巴氏杆菌管家基因扩增Fig.2 Gene amplification of P. multocida house from yak
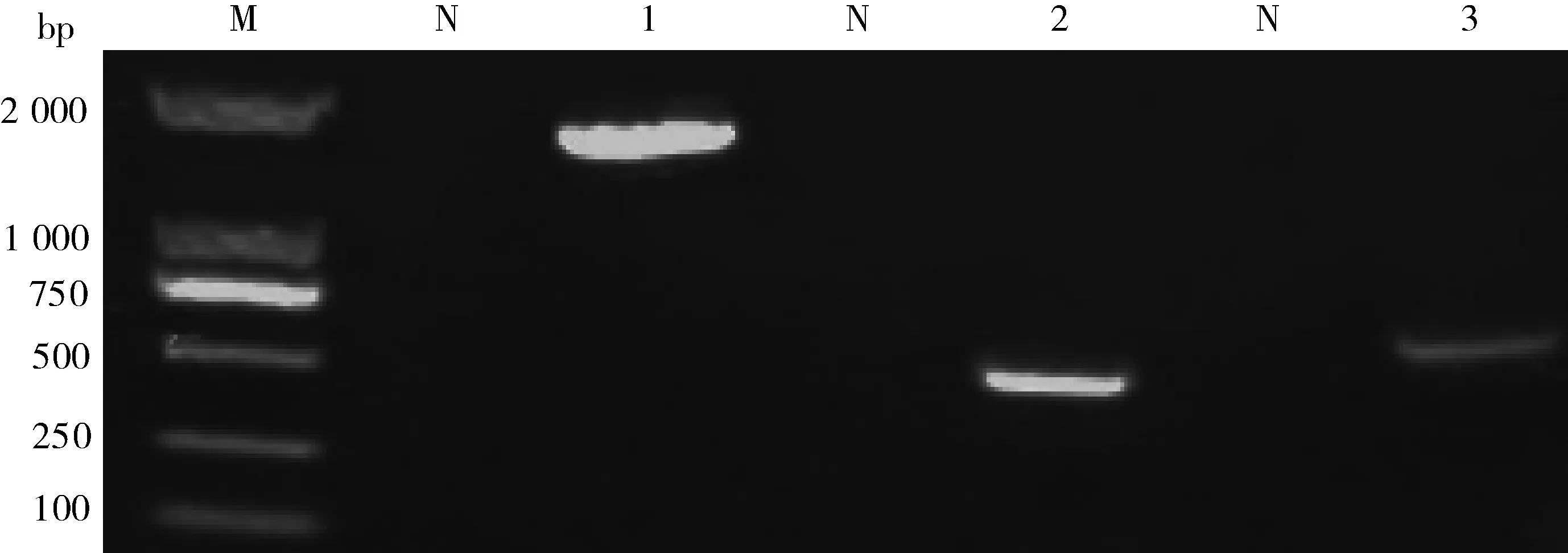
M:DL 2 000 DNA分子量标准;N:阴性对照;1: 16S rDNA 片段;2: Kmt gene;3:rpoE基因 M: DL 2 000 DNA Marker; N: Negative controls; 1: 16S rDNA fragment; 2: Kmt gene; 3: rpoE gene图3 牦牛源多杀性巴氏杆菌rpoE基因扩增Fig.3 Gene amplification of P. multocida rpoE from yak
细菌通用引物16S rDNA扩增出了长约1 400 bp条带;B型引物扩增出了长约760 bp条带,其他荚膜分型引物均未扩增出;L2型引物扩增出了约810 bp条带,其他脂多糖分型均无条带;7对管家基因均能扩增出条带,且符合预期条带大小。rpoE基因引物进行PCR扩增,条带大小约460 bp。结果表明:该株牦牛源多杀性巴氏杆菌为荚膜B型和脂多糖L2型。
2.2 牦牛源多杀性巴氏杆菌MLST分型鉴定
将测序结果在PasteurellamultocidaMLST数据库中比对7个管家基因的等位基因,结果如表2,表明该株牦牛源多杀性巴氏杆菌MLST分型为ST44型。

表2 管家基因在线比对分析Table 2 Online comparison of housekeeping gene
2.3 牦牛源多杀性巴氏杆菌rpoE基因进化树分析
将测序序列比对后,该西藏牦牛源多杀性巴氏杆菌rpoE基因和印度牛源多杀性巴氏杆菌(CP023305.1)的rpoE基因相似性100%,和其他多杀性巴氏杆菌rpoE基因序列存在10处碱基差异,但仅有第27位氨基酸发生了S→F突变;另外,第471位氨基酸(E)仅与法国兔源多杀性巴氏杆菌(CP020347.1)RpoE蛋白的氨基酸(K)有差异。通过和19株参考序列比对做基因发育进化树(图4),西藏牦牛源多杀性巴氏杆菌rpoE基因,与荷兰(CP026744.1)、美国(CP044077.1)人源,韩国(CP049756.1)猫源多杀性巴氏杆菌差异性较大,相似性分别为38.7%、38.4%和38.7%,位于不同分支,除牛源以外的其他源多杀性巴氏杆菌rpoE基因差异性较小。
2.4 rpoE基因编码蛋白特性分析
通过Port-Param在线分析RpoE蛋白的一级结构,结果表明rpoE基因序列长576 bp,编码191个氨基酸,分子式为C967H1 544N268O304S6,分子量为22.0 ku,理论等电点4.86,20种氨基酸中无组氨酸(H),谷氨酸(E)占比最多9.9%(表3),负电荷(Asp+Glu)的残基总数31个,正电荷(Arg+Lys)的残基总数24个,脂肪指数90.37,总平均亲水性(GRAVY)为-0.440,在哺乳动物体外网织红细胞内半衰期约为30 h,大肠杆菌属和酵母内半衰期分别大于10和20 h,消光系数为17 420,不稳定性指数为46.14,属不稳定性蛋白。
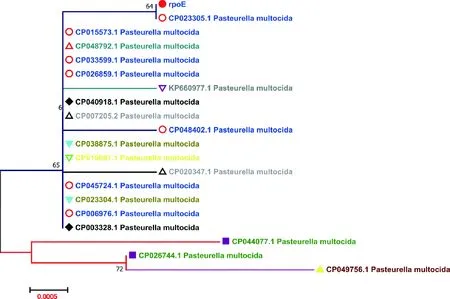
标尺表示遗传距离,指每个位点有0.000 5个氨基酸替换。 Scale bar indicates genetic distance. Number 0.000 5 represents 0.000 5 aa substitutions per site.图4 rpoE基因进化树分析Fig.4 rpoE gene evolution tree analysis
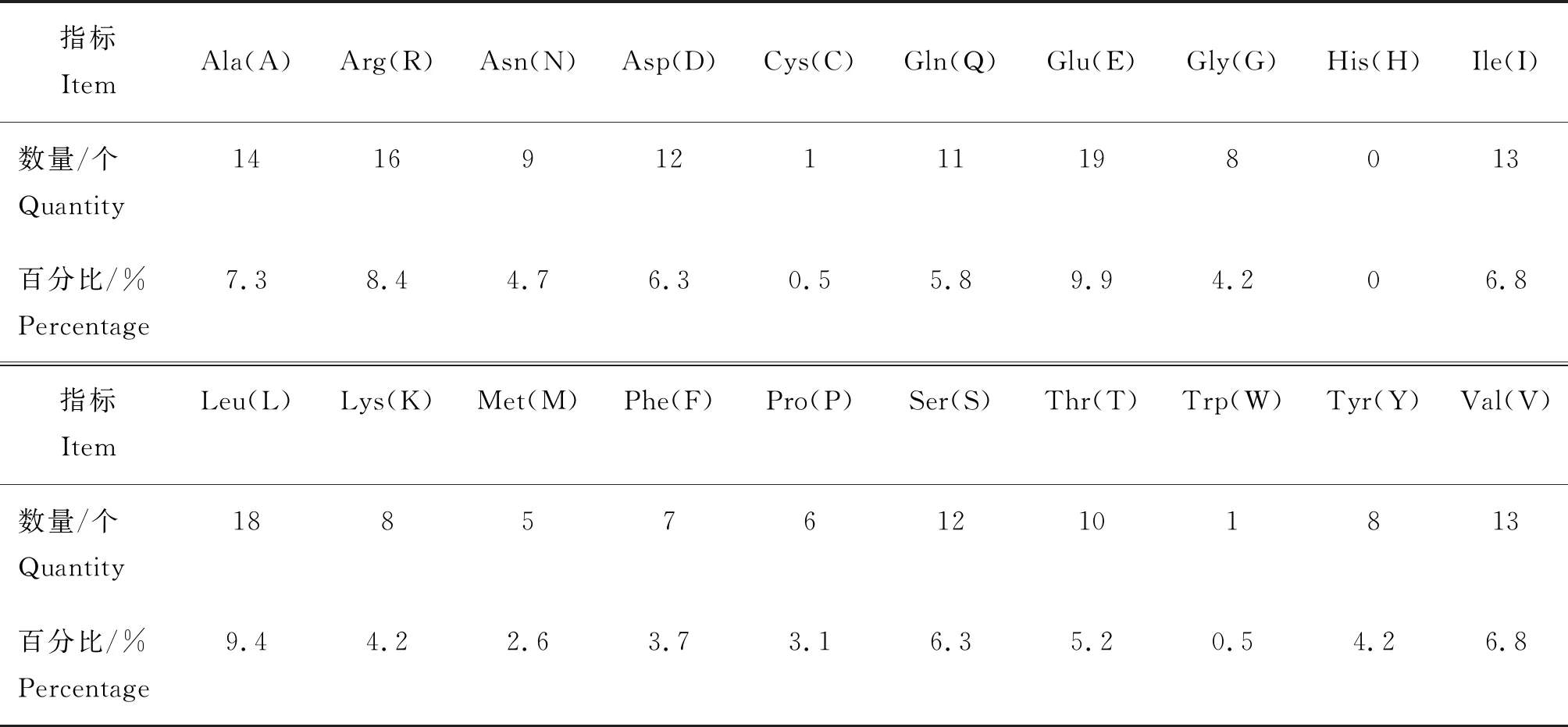
表3 RpoE蛋白氨基酸含量Table 3 RpoE protein amino acid content
2.5 RpoE蛋白亲疏水性和跨膜结构分析
通过Prot-Param在线分析,已知本分离株RpoE蛋白的GRAVY为负值,表示具有亲水性;利用在线分析工具Protscale可对蛋白亲疏水性进行分析,多肽链第93位的Pro(P)具有最低的分值-2.956,第134位的Thr(T)具有最高的分值1.300;从整体看,亲水性氨基酸多于疏水氨基酸,表明了RpoE为亲水性蛋白。通过TMHMM Server在线程序,对RpoE蛋白跨膜结构域进行分析,结果氨基酸残基在螺旋中、内部或外部的总概率求和概率无波峰,表明预测该蛋白无跨膜区域,见图5。
2.6 RpoE蛋白激酶磷酸化位点、信号肽和细胞定位分析
通过NetPhos3.1 Server服务器进行激酶特异性磷酸化位点预测,结果Ser(S)、Thr(T)、Tyr(Y)预测得分高于0.5的个数分别为10、5和2,表明该蛋白氨基酸潜在的磷酸化位点有17个。通过SignalP 4.0 Server服务器分析RpoE蛋白信号肽,S平均值<0.5,表明该蛋白无信号肽,不能向其他通路转移或进入其他膜结构的亚细胞内。rpoE基因定位的亚细胞结构,在很大程度上与该基因编码蛋白的功能密切相关,通过PSORT Prediction在线分析,结果显示该基因定位在细胞质、线粒体基质、溶酶体(腔)、内质网(膜)的得分分别为0.650、0.100、0.100和0.000,表明该基因在细胞质中表达的可能性极大(图6)。
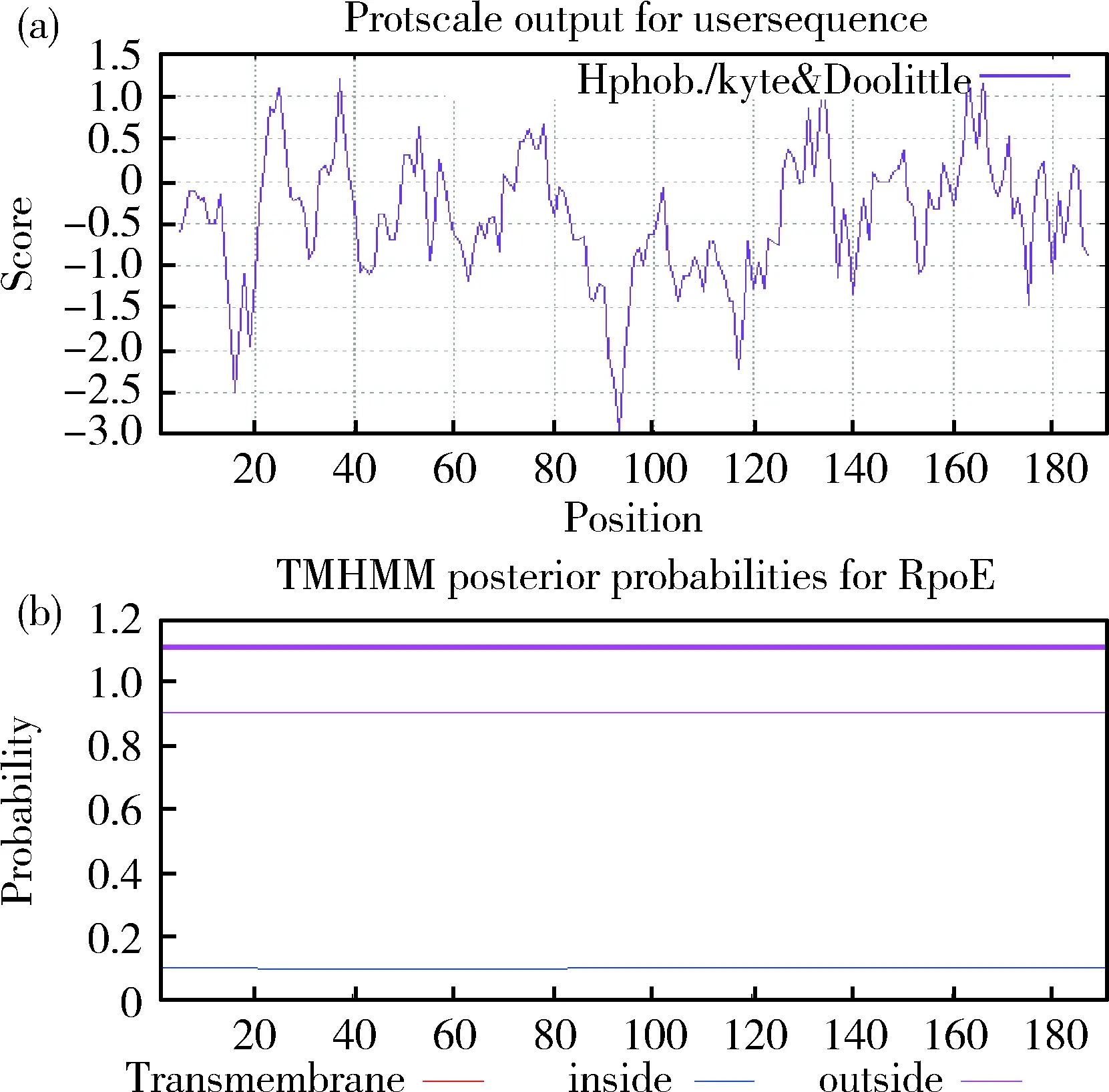
(a)RpoE蛋白亲疏水性分析;(b)RpoE蛋白跨膜结构分析(a) Analysis of RpoE protein hydrophobicity; (b) Analysis of RpoE protein transmembrane structure图5 RpoE蛋白亲疏水性和跨膜结构分析Fig.5 RpoE analysis of protein hydrophobicityand transmembrane structure
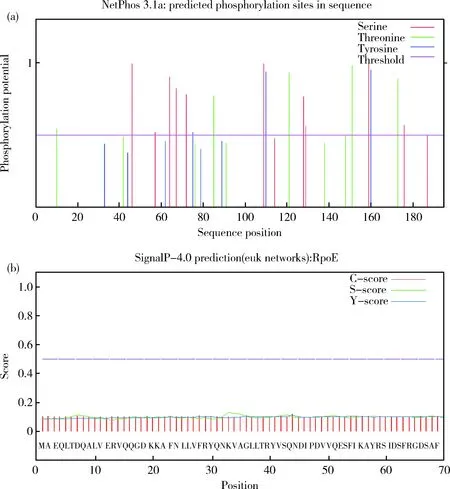
(a)RpoE蛋白激酶磷酸化位点分析; (b)RpoE蛋白信号肽分析(a) RpoE protein kinase phosphorylation site analysis; (b) RpoE protein signal peptide analysis图6 RpoE蛋白激酶磷酸化位点和信号肽分析Fig.6 RpoE protein kinase phosphorylation site and signal peptide analysis
2.7 RpoE蛋白结构域分析
通过SMART在线分析RpoE蛋白保守结构域,RpoE蛋白在PFAM数据库中有Sigma70_r2、Sigma70_r4_2个结构域,氨基酸位点分别在25~92、128~181,均为RNA聚合酶Sigma因子;利用NCBI CD Search在线分析,结果有3种类型的匹配:特定匹配(specific hits)和超家族(superfamily)蛋白PRK09652、RpoE superfamily,非特定匹配(non-specific hits)和超家族(superfamily)蛋白RpoE Sigma70 superfamily,均为Sigma-70家族RNA聚合酶sigma因子;保守位点氨基酸有13个,均为DNA结合残基位点。2次分析结果一致,利用NCBI分析RpoE蛋白保守结构域结果相对更丰富(图7)。
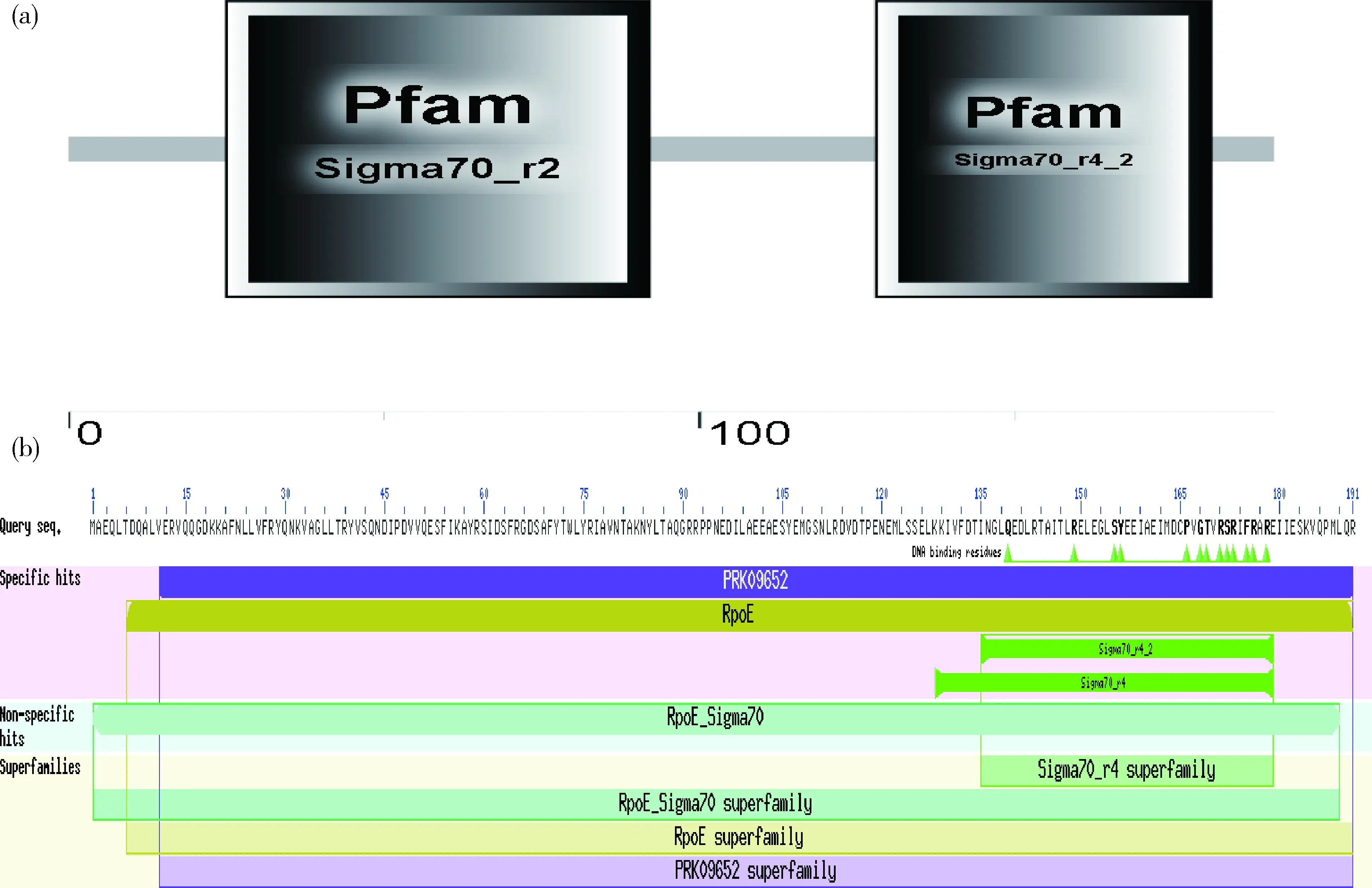
(a)SMART在线分析;(b)NCBI CD search在线分析(a) SMART online analysis; (b) NCBI CD search online analysis图7 RpoE蛋白结构域分析Fig.7 RpoE protein domain analysis
2.8 RpoE蛋白二级和三级结构预测
通过在线软件SOPMA在线分析显示,由图8可知,RpoE蛋白有4种结构存在,分别是:α-螺旋(h)、无规则卷曲(c)、延伸链(e)和β-转角(t)。α-螺旋占比67.02%,β-转角占比4.71%。通过SWISS-MODEL在线数据库对牦牛源多杀性巴氏杆菌RpoE蛋白进行同源建模,分析表明与大肠杆菌RNA聚合酶sigma E模型相似度最高为74.35%,GMQE为0.87,QMEAN为-0.52,基本可以认为模型完全代表了真实结构,并可用它进行虚拟筛选、分子对接等功能结构研究,选择该蛋白进行同源性建模(图9)。
2.9 RpoE蛋白B细胞线性抗原表位预测
通过IEDB在线分析RpoE蛋白B细胞线性抗原表位预测,最高分1.146,平均得分1.019,共预测到6个线性抗原表位;利用BCPREDS在线分析,线性表位预测长度为20个氨基酸,特异性为75%,结果共预测到4个线性抗原表位(图10)。2种分析方法均表明该蛋白表面存在线性抗原表位,但2种方法预测存在差异。
2.10 RpoE与其他蛋白之间的互作预测
通过STRING Version11.0分析多杀性巴氏杆菌RpoE蛋白与其他蛋白之间的关系,在10个蛋白中有24条相互作用线,蛋白之间连线颜色差异表示不同的相互作用途径,颜色越多,表明2种蛋白之间有更为密切的互作关系。经分析发现:RpoE蛋白和替代 σ 因子RpoH、RseB、RNA聚合酶σ因子RpoD、arcB、sodC、RNA结合蛋白hfq、DR93_94、DR93_141、抗RpoE RseA N-端结构域蛋白DR93_149和DR93_151蛋白的编码基因中存在基因邻域、基因组间协同、基因共表达和基因融合等现象,与抗RpoE RseA N端结构域蛋白DR93_149相互作用的综合得分最高为0.999,其主要功能为参与脂多糖的合成和调节外界环境胁迫的耐受能力等(图11)。
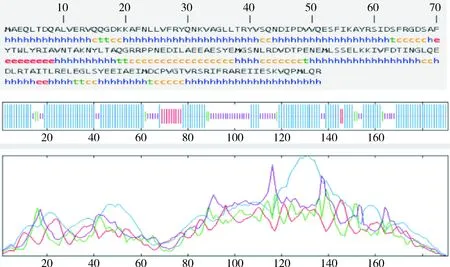
h:α-螺旋;c:无规则卷曲;e:延伸链;t:β-转角 h: Alpha helix; c: Random coil; e: Extended strand; t: Beta bridge图8 RpoE蛋白二级结构预测Fig.8 RpoE protein secondary structure prediction
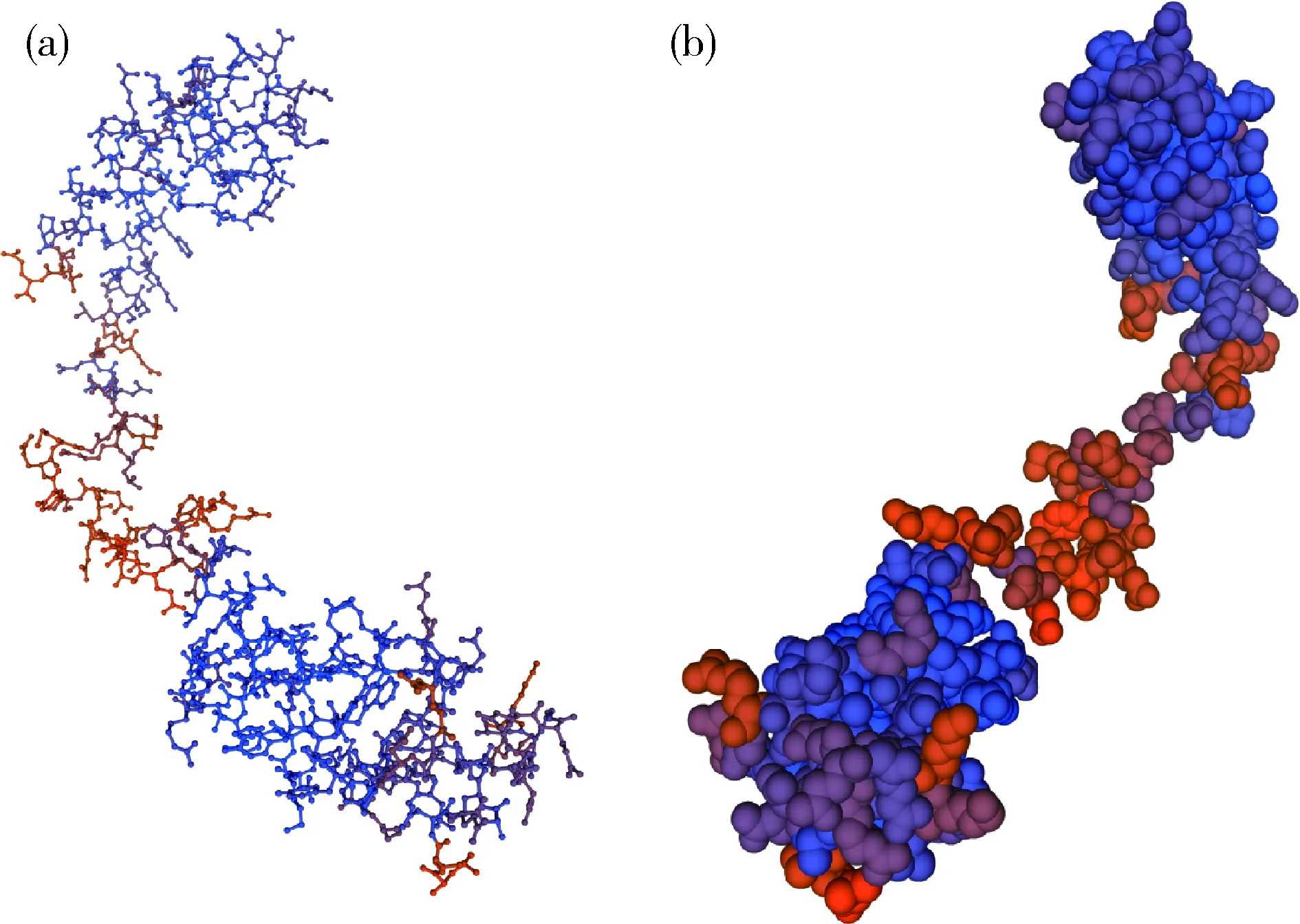
(a)Ball+Stick模型; (b) Spacefill模型(a) Ball+Stick model; (b) Spacefill model图9 RpoE蛋白三级结构预测Fig.9 RpoE protein tertiary structure prediction
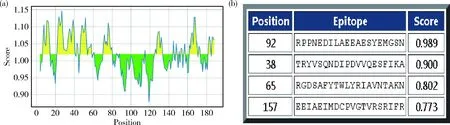
(a)IEDB在线分析;(b)BCPREDS在线分析(a) IEDB online analysis; (b) BCPREDS online analysis图10 RpoE蛋白B细胞线性抗原表位预测Fig.10 Prediction of B cell linear antigen epitope of RpoE protein
3 讨 论
目前,我国虽有商品化的牛多杀性巴氏杆菌灭活疫苗,但疫苗株和西藏牦牛源多杀性巴氏杆菌存在一定差异,迫切需要鉴定西藏牦牛源Pm的基因型,并利用西藏牦牛源多杀性巴氏杆菌研发高效、可靠的疫苗。通过分子学方法鉴定西藏地区牦牛源Pm为荚膜B型、脂多糖L2型、管家基因ST44型,与邬琴等[38]对新疆牦牛源Pm对比分型一致,表明新疆牦牛源Pm与西藏地区牦牛源Pm有较高的相似性。Sarangi等[39]、Alex等[40]和Peng等[15,41]在Pm基因分型中的研究表明,不同地理区域、不同宿主动物Pm的基因型有一定差异,但同一宿主的Pm具有“基因型偏好”现象。也有报道青海牦牛源多杀性巴氏杆菌存在荚膜A型,但并未进行多方面基因分型。牦牛源Pm基因分型是否具有一定的“基因型偏好”,还需要大量基因分型鉴定验证。
RpoE蛋白是细菌在应对外界环境变化的内部调节 σ 因子,在兔源和牛源Pm中编码的RpoE蛋白有着较强的毒力作用和免疫原性[32,37]。通过分子生物学分析rpoE基因及其编码蛋白发现,西藏牦牛源rpoE基因全长576 bp,其基因序列和印度牛源Pm的rpoE基因完全一致,相似度100%。本课题组曾将Pm特异性基因Kmt进行测序比对,和印度牛源Pm的特异性基因同源性较高[4],结合本次rpoE基因比对结果,进一步证明了西藏牦牛源Pm与印度牛源Pm存在很近的亲缘关系,应加强进出口检疫防控。利用生物信息学方法对牦牛源PmrpoE基因及其编码蛋白RpoE分析,预测出该蛋白分子量为22.0 ku,理论等电点4.86,为不稳定、无跨膜结构、无信号肽、有潜在磷酸化的胞内亲水性蛋白,这表明该蛋白可能在胞内进行表达,通过抗原和抗体结合进行信号的传导。RpoE蛋白有多个抗原表位,可能和二级结构中α-螺旋、自由卷曲的存在有关[42],三级结构模型为棒状微弯曲,可较大面积与B细胞抗原结合,可能为良好的候选疫苗抗原[37]。由于BCPREDS在线分析中抗原决定簇氨基酸数量限制较大,与IEDB在线分析相比抗原表位预测少2个,但均表明RpoE蛋白存在抗原表位。在预测RpoE蛋白互作中,发现与10个蛋白存在共表达、基因共现、基因融合等相互作用,将为深入了解RpoE蛋白作用机制提供参考。Collinet等[43]发现RseB-RiseA相互作用,可调节rpoE基因RNA聚合酶的组装和热休克反应,Kloska等[44]研究表明通过诱导RpoE和抑制RpoD σ 因子来介导冷应激反应。本研究通过生物信息学分析发现rpoE基因在西藏牦牛源Pm中可能是潜在的毒力基因,在环境胁迫的过程中有潜在的调节作用,若要明确RpoE蛋白的具体作用,还需要进一步研究该蛋白在牦牛源Pm中的作用机制。
4 结 论
本研究成功鉴定了一株实验室保存的西藏牦牛源Pm为B∶L2∶ST44型,对RpoE蛋白结构分析发现,蛋白质无信号肽和跨膜结构,二级结构α-螺旋占比最高,三级结构模型为棒状微弯曲,是存在至少4个抗原表位的胞内亲水性蛋白。推测RpoE蛋白有望成为Pm的疫苗候选抗原,将为后续深入研究RpoE蛋白的相关疫苗和疫病防控提供数据参考。

