伽玛刀放射外科治疗术后残留或复发无功能型垂体腺瘤的多中心临床分析
孙时斌,刘晓民,刘东,孙君昭,童鹰
(1. 北京市神经外科研究所 首都医科大学附属北京天坛医院 伽玛刀室,北京 100070; 2.天津市环湖医院 神经外科伽玛刀中心 南开大学医学院,天津 300350; 3.天津医科大学第二医院 伽玛刀中心,天津 300211; 4.中国人民解放军总医院第一医学中心 神经外科医学部,北京 100142; 5.浙江大学医学院附属第一医院 神经外科,浙江 杭州 310003)
无功能型垂体腺瘤(nonfunctioning pituitary adenoma,NFPA)是成人垂体大腺瘤中最常见的类型,约占垂体肿瘤的15%~30%[1-2]。目前垂体腺瘤的首选治疗是经蝶显微镜切除或内镜切除手术[3],但是对于向鞍旁或鞍上侵袭的大型腺瘤手术全切还是困难的,术后残留或复发的肿瘤需要进一步的治疗,然而进一步的治疗策略有颇多争议。2次手术风险大,全切率也比第1次手术明显降低,因此从二十世纪80年代以后,放射治疗在垂体瘤的综合治疗中一直有着重要的地位,放射治疗实施的方式也随着现代影像和计算机技术的发展而日新月异,从传统分次放疗到单次大剂量的精准放射外科治疗,概念和设备不断推陈出新,在提高肿瘤控制率的同时尽量降低垂体功能减退率和脑神经损伤率。从上世纪90年代以后,国外发表的单中心及多中心文献[4-18]已证实了伽玛刀放射外科(gamma knife radiosurgery,GKS)治疗NFPA的安全性、有效性,并肯定GKS是术后残留或复发垂体腺瘤重要的补充治疗。
积极开展高质量的多中心临床研究,可以为临床指南的制定和临床策略的抉择提供高级别的循证医学证据,也是当前临床医学的一个发展趋势。但是目前国内还没有多中心的长期随访研究,缺乏我们国内自己的循证医学依据,本研究弥补了这一空白。为了进一步研究我国GKS治疗外科术后残留或复发NFPA的长期临床疗效、并发症发生率及影响因素,以及在现代微侵袭神经外科时代GKS在NFPA综合治疗中的地位和作用,本文进行了国人的多中心临床随访研究。
1 资料与方法
1.1 病例来源
收集2000年1月—2015年1月行GKS治疗并符合纳入标准NFPA患者451例,其中北京市神经外科研究所首都医科大学附属北京天坛医院伽玛刀室诊治293例,天津医科大学第二医院伽玛刀中心诊治105例,解放军总医院第一医学中心神经外科诊治23例,浙江大学医学院附属第一医院神经外科诊治30例。纳入标准:多中心NFPA外科术后再接受GKS治疗的长期临床随访研究纳入标准如下:①GKS前至少接受过1次外科手术,且病理证实为NFPA;②GKS前的内分泌化验及临床症状符合NFPA诊断;③GKS前及最后1次随访的内分泌化验齐全;④GKS及最后1次随访的视力视野检查齐全;⑤有最后1次随访的MRI;⑥随访时间 ≥6个月。
1.2 临床资料
451例患者中,男219例,女232例;年龄13~79岁,中位年龄50岁。伽玛刀治疗前有368例患者曾行1次手术,其中269例行经蝶手术、99例行开颅手术;71例曾行2次手术;10例曾行3次手术;2例曾行4次手术。伽玛刀治疗前29例患者有放疗史。436例患者接受了1次伽玛刀治疗,13例患者接受了2次伽玛刀治疗,2例患者接受了3次伽玛刀治疗。本组中421例患者有明确的Knosp分级[19],侵袭鞍旁海绵窦的Knosp 3~4级患者281例;鞍上侵袭并靠近视路的患者208例。本组451例患者分为外科术后GKS早期治疗组(手术与GKS时间间隔≤6个月)和延迟治疗组(手术与GKS时间>6个月),其中早期治疗组218例,延迟治疗组233例。
1.3 治疗方法
4家伽玛刀中心的伽玛刀治疗设备使用为Leksell伽玛刀(Leksell Gamma Unit),其中天坛医院2002年5月前为B型,2002年6月—2011年9月为C型,2011年10月以后升级为Perfexion型。中国人民解放军总医院第六医学中心2015年以前使用OUR-XGD旋转式伽玛刀,2015年后使用Perfexion型。中位肿瘤体积为4.0 cm3(平均6.2 cm3,0.79~55.3 cm3),中位周边处方剂量14Gy(平均14Gy,8~21Gy),中位中心处方剂量30Gy(平均30Gy,16~42Gy)。视神经及视交叉受照射剂量≤9Gy,海绵窦外侧壁受照射剂量≤15Gy,正常垂体<15Gy,海绵窦内颈内动脉受照射剂量尽量避开在20Gy外,每个靶点的热区都尽量避开重要的组织结构。
1.4 随访标准
垂体腺瘤患者在伽玛刀治疗前后,均需要进行完整的神经病学、眼科学、内分泌学评估,眼科学检查主要包括视力、视野的检查,内分泌学评估包括下丘脑—垂体—甲状腺轴系、下丘脑—垂体—肾上腺轴系和下丘脑—垂体—性腺轴系激素水平的测定。患者接受伽玛刀治疗后,被建议半年、1年及逐年随诊。随诊形式包括患者来诊、信访及电话等。详细记录临床症状体征的改善,神经影像学的复查和可能相关的副作用进行比较、分析。本研究以肿瘤平均直径改变2 mm(体积改变10%)作为肿瘤体积明显改变的判定标准。GKS后新出现的垂体功能减退的定义为[20]:GKS后至少3个月出现新的激素轴缺损。
1.5 统计学方法
采用统计学软件SPSS 19.0版进行统计学分析伽玛刀放射外科治疗NFPA后肿瘤控制率、垂体功能减退及视力下降的影响因素,以Kaplan-Meier法(KM法)分析GKS治疗NFPA的临床疗效及并发症发生的影响因素,P<0.05为差异具有统计学意义。
2 临床结果
2.1 患者免疫组化的检测
早期垂体瘤手术后的大部分病理并不提供免疫组化染色结果,天坛医院提供的NFPA外科术后再接受GKS治疗组中,有60例患者随访到免疫组化结果。36例裸细胞垂体腺瘤中3例GKS后肿瘤复发,10例静默型FSH阳性垂体腺瘤中1例GKS后肿瘤复发,7例皮质醇静默型垂体腺瘤(silent corticotroph adenoma,SCA)中2例GKS后肿瘤复发(图1),5例静默型混合性垂体腺瘤和2例静默型GH阳性垂体腺瘤中,无肿瘤复发。
2.2 肿瘤控制率
随访6~213个月(平均50个月)。本组451例患者中,MRI证实259例(57%)患者的肿瘤有明显萎缩,165例(37%)患者的肿瘤体积无明显改变,27例(6%)患者的肿瘤有明显增大,肿瘤总控制率94%(424/451)。有明显鞍旁侵袭的Knosp 3~4级患者见图2,有明显鞍上侵袭的患者见图3,随访结果显示接受GKS治疗后肿瘤亦可得到有效的控制。3、5、8、10年和15年的累积肿瘤控制率分别为95%、93%、92%、88%和80%(图4)。
2.3 患者内分泌功能的随访
97例(22%)患者GKS治疗后发生了垂体功能减退,其中30例(7%)患者发生下丘脑-垂体-甲状腺轴功能减退,27例(6%)患者发生下丘脑-垂体-性腺功能减退,25例(6%)患者发生下丘脑-垂体-肾上腺功能减退。
2.4 患者脑神经功能受损的随访
35例(8%)患者GKS治疗后发生不同程度的视力下降,其中6例患者出现双目失明情况。6例(1.3%)出现外展神经功能障碍,4例(1%)出现动眼神经功能障碍。
2.5 临床疗效及并发症的影响因素
采用KM法分析肿瘤控制率的影响因素发现患者性别、年龄、手术与GKS相隔时间、有无放疗史、周边剂量大小、肿瘤体积≥10 cm3、有否鞍旁侵袭及有否鞍上侵袭与患者GKS治疗后肿瘤控制率无明显相关性,而肿瘤体积≥5 cm3为肿瘤控制率的显著影响因素(P=0.041)。具体数据见表1。
采用KM法分析垂体功能减退率的影响因素发现患者性别、年龄、手术与GKS相隔时间、有无放疗史、周边剂量大小、肿瘤体积≥5 cm3及有否鞍旁侵袭与患者GKS治疗后垂体功能减退率无明显相关性,而肿瘤体积≥10 cm3、有否鞍上侵袭及GKS前有否垂体功能减退均为垂体功能减退率的显著影响因素(P<0.05)。具体数据见表1。
采用KM法分析视神经受损率的影响因素发现患者性别、年龄、手术与GKS相隔时间、有无放疗史、周边剂量大小及有否鞍旁侵袭与患者GKS治疗后视神经受损率无明显相关性,而肿瘤体积≥5 cm3、肿瘤体积≥10 cm3及有否鞍上侵袭均为视神经受损率的显著影响因素(P<0.05)。具体数据见表1。
3 讨论
3.1 长期肿瘤控制率及影响因素
文献报道,GKS治疗NFPA 的肿瘤控制率一般为 89.6%~100%,3、5年及10年的累积肿瘤控制率分别为93%~100%,88.2%~97% 和 76%~91%[4-18]。本临床多中心研究对象为术后残留或复发的NFPA,肿瘤控制率达到94%,3、5、8、10年和15年的累积肿瘤控制率分别为95%、93%、92%、88%和80%。因此GKS治疗外科术后残留或复发的NFPA可以起到长期的肿瘤控制作用。
从本组患者资料看,肿瘤体积大小无疑是影响肿瘤控制率的最重要因素,肿瘤体积越大肿瘤控制率越低。Knosp 3~4级垂体腺瘤大部分都是大体积
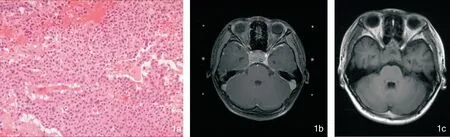
图1 患者,男,16岁,SCA经蝶术后放疗后复发,GKS治疗后30个月复查MRI示肿瘤增大,周边剂量15Gy,中心剂量30Gy,无垂体功能减退,视力略有下降 1a:病理结果示ACTH偶见(+),余激素阴性,细胞异型性 (HE ×100); 1b:GKS定位; 1c:GKS后30个月增大
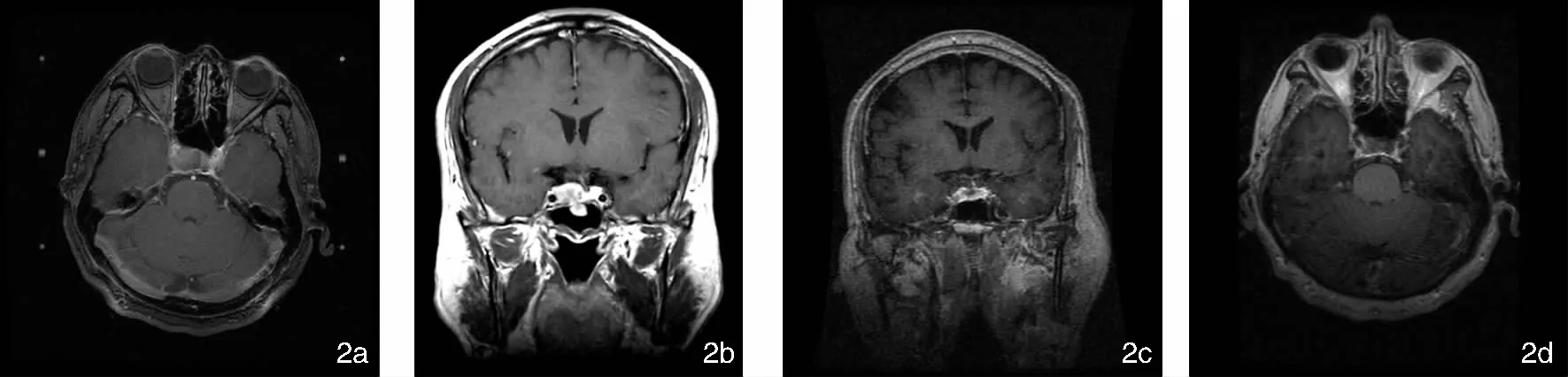
图2 患者,男,58岁,鞍旁侵袭NFPA经蝶术后再行GKS治疗后14年复查MRI示肿瘤明显缩小,周边剂量15Gy,中心剂量33Gy,无垂体功能减退,无脑神经功能障碍 2a:GKS定位; 2b:GKS前CT冠位; 2c:GKS后14年复查CT冠位; 2d:GKS后14年复查CT水平位
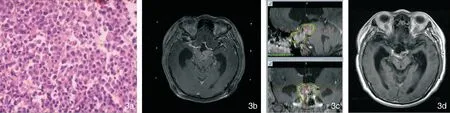
图3 患者,男,52岁,鞍上侵袭NFPA经蝶术后再行GKS治疗后69个月复查MRI示肿瘤明显缩小,周边剂量12Gy,中心剂量27Gy,无垂体功能减退,无脑神经功能障碍 3a:病理结果示PRL及LH阳性,余阴性,细胞异型性 (HE ×200); 3b:GKS定位; 3c:GKS治疗计划; 3d:GKS后69个月明显缩小
的侵袭性肿瘤,侵犯海绵窦、颈内动脉、脑神经及骨质,易发生囊变坏死和出血,Ki-67指数≥3%、核异型性、核分裂能力>2/10个高倍镜的肿瘤更易有复发倾向,无论对于外科还是放射治疗都还依然是一个挑战。
在天坛医院NFPA外科术后再行GKS治疗的病例组中,不同免疫组化分类的NFPA所表现的临床结果是不一致的。SCA是一类特殊的NFPA,较其他类型的NFPA更具有侵袭性和进展性,易复发,且个别病例可以转为ACTH型垂体腺瘤。2014年弗吉尼亚医学中心的Xu等[21]发表了第1篇GKS治疗SCA的临床报道,2017年该中心发表了1篇GKS治疗NFPA的多中心临床报道[22],建议给予SCA≥17 Gy的周边处方剂量以提高肿瘤控制率。在本组中病理证实7例SCA,其中2例GKS治疗后肿瘤复发,包括1例45岁男性患者在经历3次外科手术和1次GKS后5年发展为Cushing氏病。而本组中病理证实10例FSH静默型NFPA,其中只有1例患者在GKS后肿瘤复发。本组病历资料中GKS治疗SCA的肿瘤控制率为71%(5/7),低于GKS治疗FSH静默型NFPA的肿瘤控制率90%(9/10)和总的肿瘤控制率94%(424/451)。免疫组化分类对疗效的影响,需要更多的临床资料支持。
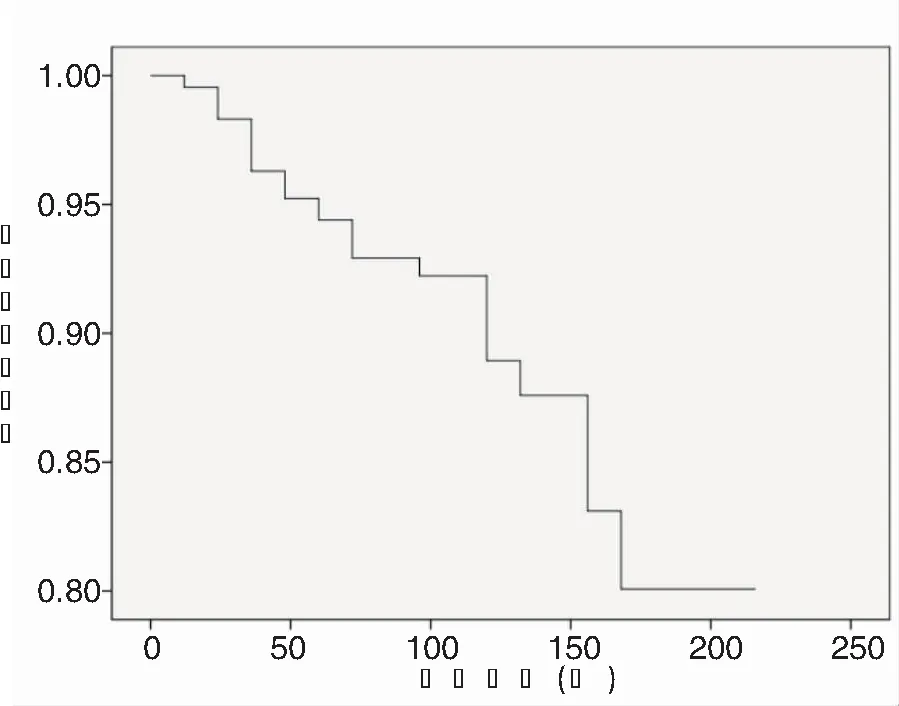
图4 多中心NFPA外科术后再接受GKS治疗累积肿瘤控制率
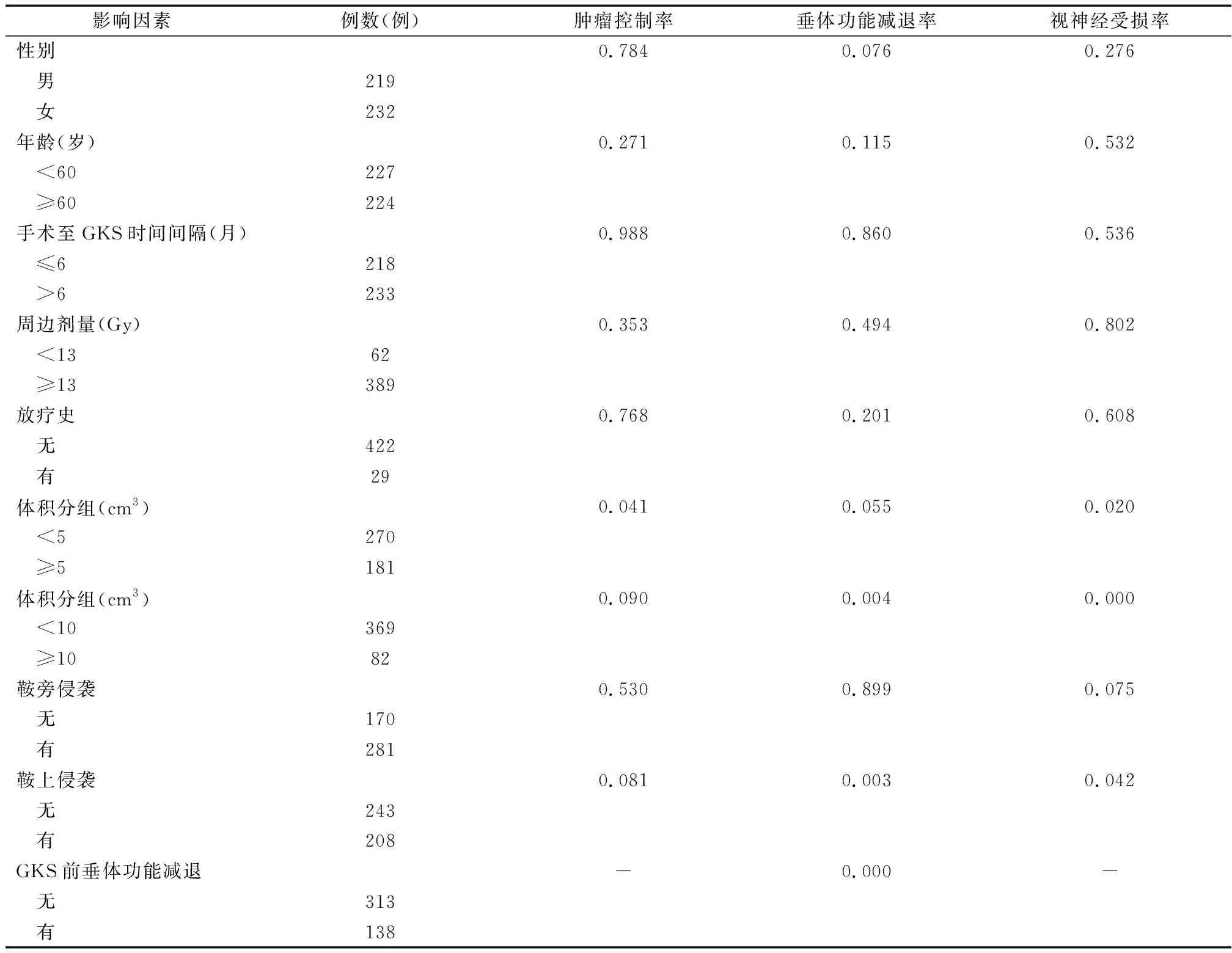
表1 KM法分析GKS治疗NFPA后影响患者肿瘤控制率、垂体功能减退率及视神经受损率的P值
3.2 垂体功能减退的影响因素
NFPA接受GKS治疗后的长期垂体功能减退发生率一般为9.3%~30.3%[4-18]。侵袭性无功能垂体腺瘤由于体积较大及其侵袭性,对正常垂体产生的压迫作用使许多患者在进行手术前就已经发生了垂体功能低下。可能影响垂体功能减退的因素很多,包括周边剂量、中心剂量、垂体瘤与正常垂体是否有正常边界、正常垂体受照射剂量、垂体柄受照射剂量、有否手术史、有否放疗史等。
从本组病例资料看,大体积瘤灶和鞍上侵袭都是显著的影响因素,因为两者的瘤灶离下丘脑及垂体柄的距离更近,行GKS治疗可能会增加下丘脑及垂体柄功能受损伤的几率。有否外科术后垂体功能减退在本组患者也为一个显著的影响因素,说明垂体功能在外科手术后受到损伤后可能会对射线的反应更加敏感,更容易增加受损伤的概率。
Xu等[23]对262例患者进行回顾性分析,认为肿瘤周边剂量、肿瘤是否向鞍上生长是垂体功能减退发生的两个独立因素,而与肿瘤体积、有否外科手术史或者放射治疗无关。从本课题影响因素分析看,如果肿瘤体积较大,向鞍上侵袭,正常垂体及垂体柄的受照射剂量明显增大,GKS肿瘤对垂体功能的损伤概率就会增加,与Xu的结论一致。
垂体腺瘤周边对射线较敏感的、与内分泌激素水平相关的重要结构包括下丘脑、垂体柄和正常垂体,但在外科术后肿瘤与正常垂体的边界经常难以分辨,有时甚至垂体柄也难以辨认。因此在实际的临床治疗中,由于解剖结构混乱导致正常垂体和垂体柄接受到较高的照射剂量,鞍上侵袭的NFPA在GKS后更容易发生垂体功能减退。一般建议垂体柄根部受照射最大剂量不超过12Gy,正常垂体受照射剂量不超过14Gy。
本组中,GKS后新发生垂体功能减退按激素轴减退类别排列如下:甲状腺功能减退(7%)>性腺功能减退(6%) 、 肾上腺皮质功能减退(6%),从本组看GKS后甲状腺功能减退出现的患者是最多的。下丘脑-垂体-甲状腺激素轴相较其他两个激素轴对射线损伤是最敏感的,GKS后出现损伤的时间最早,出现损伤的比例也是最高的。
3.3 视神经受损伤的影响因素
视神经是对射线最敏感的颅内组织,有文献认为小部分视路接受10~12Gy的照射剂量,不会增加视力损伤的概率,一般视神经及视交叉的受照射剂量被严格限制≤9Gy。由于长期的肿瘤压迫,侵袭性无功能型垂体腺瘤患者的视神经及海绵窦内的颅神经要比一般的患者更加脆弱。
综上所述,肿瘤体积越大、鞍上侵袭度越高发生视力下降的概率就越大。但从本组病例看,GKS治疗NFPA的周边剂量范围12~16Gy是比较安全的,发生脑神经损伤的概率很低。肿瘤复发或卒中导致肿瘤体积增大压迫视路才是视力下降的主要原因,而非过量的射线照射引起眼底病变或损伤视觉通路。
3.4 外科术后GKS的时间窗
Pomeraniec等[24]2017年发表了1篇多中心临床研究报道,9家国际伽玛刀研究协会的中心1987—2015年496例无功能型垂体大腺瘤经蝶术后再行GKS治疗的患者中,符合入组标准的222例,分为经蝶术后早期治疗(术后6个月内)和延迟治疗(术后6个月以上)两组。Pomeraniec等分析结果认为外科术后GKS早期干预治疗较延迟干预治疗的肿瘤控制率更高,延迟的放射外科治疗会增加GKS后肿瘤复发的几率且内分泌功能更易受影响。
2017年Sadik等[25]报道了1组50例NFAP外科术后再行GKS治疗的病例回顾,13例外科术后6个月内行GKS治疗为早期辅助治疗组,37例术后MRI发现肿瘤复发再行GKS治疗为延迟治疗组。Sadik等认为两组的肿瘤控制率无明显差异,但早期辅助治疗组较延迟治疗组的垂体功能减退率的发生率更低。
如上讨论,肿瘤体积是影响GKS治疗NFPA肿瘤控制率的最重要因素,如果外科术后一定观察到肿瘤复发再行延迟的放射外科治疗,确实增加了放射外科治疗的难度,其最终的临床结果也必然降低肿瘤控制率并增加发生并发症的可能,而GKS早期干预治疗已被证实不会增加远期垂体功能减退和颅神经受损概率。Pomeraniec和Sadik等也均认为GKS早期干预治疗确实更有利外科术后肿瘤残留的患者。当然GKS早期干预的时间不能过于提前,外科术后3~4个月内术区会发生较大的变化,术区的手术痕迹需要逐渐修复,鞍隔高度逐渐恢复,术后的炎症或少量出血逐渐吸收,紊乱的解剖结构逐渐清晰,且术后垂体功能的一过性减退也会逐渐恢复。
综上所述,我们建议对于外科术后肿瘤残留的患者要采取个体化治疗策略。外科术后3~4个月手术的痕迹才能逐渐消退,手术引起的一过性垂体功能减退也才能逐渐恢复至正常,因此术后GKS干预治疗的时间应在术后6个月左右。对于侵袭性垂体腺瘤、SCA、ki-67等分裂指数明显增高的易复发易进展的患者,术后GKS更应该提倡早期介入干预。术后有明显的残留肿瘤,即使建议不实施早期GKS治疗,也需要定期的动态随访,不要等到肿瘤明显复发生长后对患者造成进一步的损伤再考虑GKS治疗。残留的肿瘤体积越大,肿瘤侵袭度越高,越应该行早期的GKS治疗。
4 结论
由于现代神经外科技术的快速发展,显微镜及内镜技术的日臻成熟,外科术后残留肿瘤的体积往往更适合于GKS治疗。GKS治疗外科术后残留或复发的NFPA安全有效,可以被作为一线治疗考虑。外科术后残留肿瘤行GKS治疗的时间窗选择应该作个体化决策,最佳GKS介入干预时间为外科术后6个月左右。对于侵袭性垂体腺瘤、SCA、ki-67>3%等易复发易进展的患者,术后GKS更应该早期介入干预。

