ITO 平面微电极上P(VDF-TrFE)薄膜的制备及性能表征
沈淑娴,何旭昭,董灵庆,程 逵,翁文剑
(浙江大学材料科学与工程学院,浙江杭州 310027)
1 前 言
生物电广泛存在于人体之中,内源性电场在调节诸如胚胎发生、伤口愈合、组织修复与重塑等许多生物学过程中发挥着至关重要的作用[1-4]。受骨骼自然压电特性的启发[5],通过采用外源的电刺激并提供适当的生理环境来模仿内源性电场已被用于调节成骨类细胞和干细胞的成骨分化并促进骨骼生长。
McCullen等[6]使用叉指型金电极提供交变电场刺激,结果表明1 V/cm 强度的电场明显增强了h ASCs的成骨分化能力。Park等[7]用平行电极在限定的纳米管TiO2基底表面附近产生电场,并证明强度为200或400 m V/cm 的恒定电场诱导了MSCs的成骨分化。Thrivikraman 等[8]使用细胞外基质涂覆的导电聚苯胺模拟骨组织微环境,将细胞间歇性暴露在耦合产生的电场中,结果显示h MSCs的成骨分化潜能显著增强。Hu等[9]证明了导电的聚吡咯薄膜可支持350 m V/cm 的电场刺激,并且恒定电场促进了r BMSCs细胞外基质中的钙沉积。
在这些研究中,电场的产生主要通过平行电极、平面电极、电容耦合或电感耦合来施加电信号[10]。与其他传统的装置相比,具有叉指型陈列的平面微电极在电极上方、下方和垂直于电极方向均能产生电场;极小的电极间隔类似生理特征尺寸,仅需要较小的电压即可产生生理所需的电场强度,不易产生电化学效应;电场被定位在电极紧邻处且近似于平行,细胞所处的电场刺激是恒定的[6,11-13]。但是,平面电极在产生电场的同时必然伴随着微电流,而且由于叉指型的设计电极的表面成分必然不均匀,而表面覆膜的方式恰恰可以消除由此带来的影响。
聚偏氟乙烯三氟乙烯P(VDF-Tr FE)作为一种重要的铁电聚合物,具有优良的生物相容性、耐腐蚀性等特性,P(VDF-Tr FE)基材料被广泛应用于骨组织修复[14-15]。Tang等[16]在Ti表面制备了一层P(VDFTr FE)薄膜,证明极化后的P(VDF-Tr FE)显著提高了MC3T3-E1细胞的成骨分化能力。Lopes等[17]发现BTO/P(VDF-Tr FE)复合膜能够显著促进骨缺陷中的新骨形成,同时骨组织与P(VDF-Tr FE)之间形成了一层连接组织,这表明P(VDF-Tr FE)与骨组织之间的界面结合十分紧密。另外,P(VDF-Tr FE)具有独特的电响应活性,包括铁电性、压电性、热释电性,是一种非常具有研发潜力的材料[18-21]。
因此,本研究采用平面微电极覆膜的方式,通过旋涂法在ITO 电极上涂覆P(VDF-Tr FE)薄膜。通过改变不同的工艺参数来调控薄膜的致密度、厚度和绝缘性能,进而筛选出在电刺激时只显示纯电场作用的样品。然后对纯电场刺激影响MSCs生长行为进行简单的生物学评价。
2 实 验
2.1 原材料
P(VDF-Tr FE)(70/30)粉末,纯度≥99.0%;ITO基板,尺寸为10 mm×10 mm×1mm,电极宽度和间隔为500μm;N,N-二甲基-甲酰胺(DMF),纯度≥99.5%;丙酮,纯度≥99.7%;无水乙醇,纯度≥99.7%。
2.2 仪器设备
分析天平,TG-382-A;磁力搅拌器,C-MAG HS4;鼓风干燥箱,DHG-9070AS;匀胶机,KW-4A;马弗炉,KSL-1200X-J;超净台,HCW-HS;三气培养箱,HF100;离心机,TDZ5-WS;灭菌锅,GI54T;高速离心机,Neofuge 13R。
2.3 ITO 上涂覆P(VDF-Tr FE)薄膜的制备
按照图1所示的流程,先称取一定量的P(VDFTr FE)粉末溶于DMF 中,磁力搅拌2 h 直至完全溶解。再用移液枪量取100μL 溶液滴于清洗干净的ITO 基板中心,以4000 rpm 的转速高速旋转60 s使其分散均匀。然后将基板置于烘箱干燥2 h 直至DMF完全蒸发,最后经过退火处理即可。
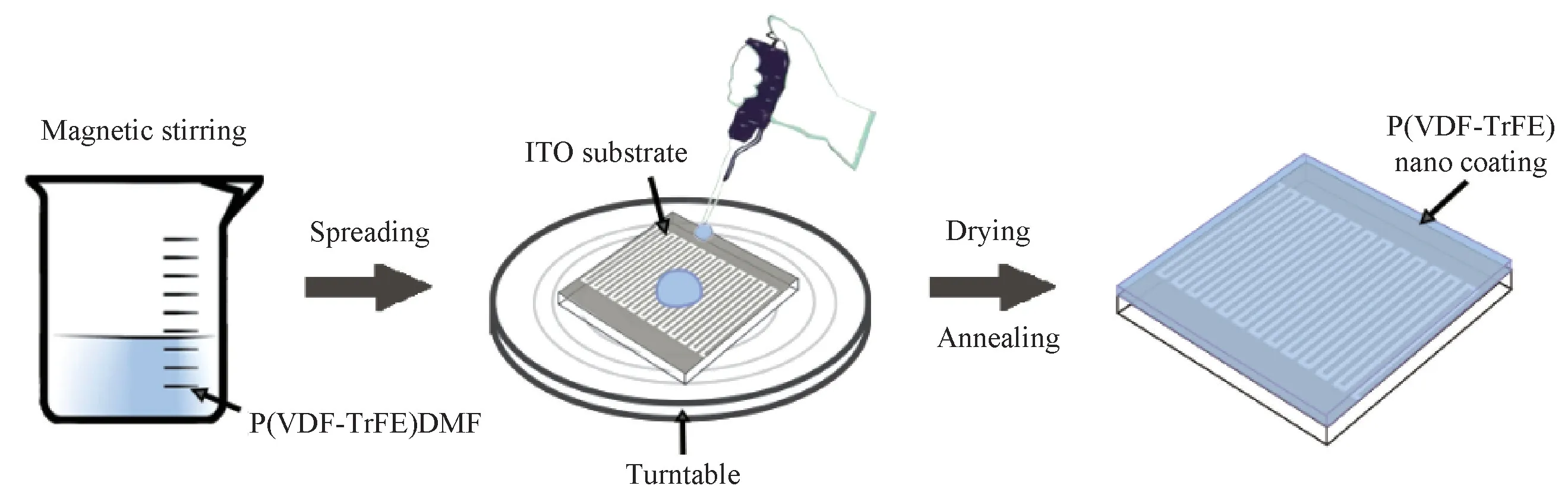
图1 旋涂法制备P(VDF-Tr FE)薄膜的流程图Fig.1 Illustration for preparation of P(VDF-Tr FE)films on ITO by spin-coating
2.4 薄膜的材料学表征
将洁净的样品进行喷金预处理。通过场发射扫描电子显微镜(SEM,SU-70)观察薄膜的表面形貌。测试电压为3 k V。
将ITO 基板上的薄膜刮净一部分,自制一个台阶,均匀选取若干个点,通过表面轮廓仪(DEKTAKXT)对涂膜进行接触式测量,测得台阶的高度差即为薄膜的厚度。
采用由计算机控制的电化学工作站(CHI660D),将ITO 基板的一侧用作工作电极,另一侧用作参比电极,在电解液中进行电化学分析。在不同电压的双相脉冲信号下收集充放电曲线。在施加某一电压时,曲线的某一充电周期内电流对时间的积分即为在该脉冲信号下通过薄膜的电荷量。
通过扫描开尔文探针显微镜(NTEGRA Spectra C)测量正负电极在薄膜表面处的电压差。使用的探针是市售的涂Pt的硅悬臂(HA_FM/Pt),频率为49 k Hz,振幅为0.5 V(峰值峰)。
2.5 电刺激流程
将覆膜的ITO 电极置于由聚四氟乙烯(PTFE)制成的细胞培养装置中,如图2所示。将带有Pt丝的两个压块用塑料螺钉分别固定在电极导带两端,使Pt线与导电条带紧密接触,然后将两端的铂丝分别引出连接到信号发生器(DG1022),对被测样品施加不同电压的电刺激。
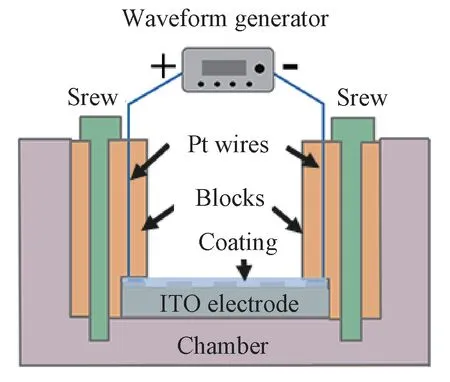
图2 电刺激细胞培养装置示意图Fig.2 Device for electrical stimulation and culturing of cells
2.6 细胞行为评价
2.6.1 细胞培养 本研究使用的是大鼠股骨和胫骨中的第3~4 代间充质干细胞(MSCs)。将MSCs培养在温度为37 ℃、CO2含量为5%的湿润气氛中,使用的培养基含有α-改性的MEM 必需培养基和10%胎牛血清,并添加1%丙酮酸钠、1%MEM 非必需氨基酸和含有1×104单位/m L 青霉素和10 mg/m L链霉素的1%抗生素溶液。在细胞培养期间,每两天更换培养基。在进行电刺激前,细胞均需预先培养1天,使细胞在电极上充分粘附和铺展[22]。
2.6.2 细胞粘附与增殖 将MSCs以2×104个/cm2的密度接种在PTFE 培养装置中的样品上。分别在培养1天和3 天后,使用细胞计数试剂盒(CCK-8)测定样品上细胞的粘附和增殖。先将样品转移到新的24孔板中,然后将500μL 新鲜的培养基和50μL CCK-8溶液添加到每个孔中。在37℃下孵育3 h后,将溶液分配到新的96孔板中,并用酶标仪(MK3)测量在450 nm处的吸光度。
2.6.3 细胞ALP活性 碱性磷酸酶(ALP)活性代表了细胞的初始成骨分化程度。将MSCs 以2×104个/cm2的密度接种在PTFE 培养装置中的样品上。培养7天后,先将样品转移至新的24孔板中,并用PBS洗涤3次。再用Cel Lytic缓冲液将样品上的细胞裂解,并把获得的细胞裂解液在4 ℃下高速离心15 min。然后收集上清液,用ALP试剂盒进行反应测试。最后用酶标仪测量在405 nm 处的吸光度。单位细胞的ALP活性表示为总ALP 活性除以在BCA 蛋白质分析中测试的总蛋白质含量。
2.6.4 细胞的形态 将MSCs以2×103个/cm2的密度接种在PTFE培养装置中的样品上。分别在培养1天和3天后,将样品转移至新的24孔板中,并用PBS洗涤3次。然后加入用PBS稀释的4μM Calcein-AM。在37℃下孵育30 min后,用倒置荧光显微镜(NIB900)在绿色荧光下观察细胞的形态,并摄像。
3 结果与讨论
3.1 ITO 电极上P(VDF-Tr FE)薄膜的制备
采用旋涂法在ITO 平面电极上制备P(VDFTr FE)薄膜,通过调节P(VDF-Tr FE)溶液浓度(质量分数)和旋涂层数来探究不同制备条件下薄膜的表面形貌、厚度和电化学特性,通过优选得到致密绝缘且厚度足够小的P(VDF-Tr FE)薄膜。
3.1.1 薄膜的表面形貌 图3是在不同溶液浓度和旋涂层数条件下制备的P(VDF-Tr FE)薄膜的SEM照片。当溶液浓度为3%,旋涂1 层时,P(VDFTr FE)在基板上仍大范围空缺并未成膜;随着旋涂层数的增加,空缺逐渐被填补;但即使增加至5层,表面仍存在着大量的不规则孔洞而难以成膜。当溶液浓度为5%,旋涂1层时,孔洞与P(VDF-Tr FE)面积相当;随着旋涂层数的增加,孔洞面积逐渐减小,形状趋于圆形,P(VDF-Tr FE)逐渐成膜;旋涂5层时薄膜基本致密。同样的,当溶液浓度为7%、旋涂至3层时微孔消失,薄膜基本致密;溶液浓度为9%的样品旋涂1层即无明显孔洞而显示致密。P(VDF-Tr FE)薄膜中的晶须也均随着孔洞的减少而逐渐增多加长。
由此可见,旋涂法制备P(VDF-Tr FE)薄膜的合适成膜浓度在3%以上。当溶液浓度相同时,薄膜的孔洞数量和面积会随着旋涂层数的增加而减少;当旋涂层数相同时,溶液浓度增加会明显改善薄膜的孔隙率,因此溶液浓度的提高和旋涂层数的叠加均是消除微孔、提高薄膜致密度的有效手段。
3.1.2 薄膜的厚度 图4是不同溶液浓度和旋涂层数条件下制备的P(VDF-Tr FE)薄膜的厚度图。薄膜的厚度随溶液浓度和旋涂层数的增加而增加,但它们对薄膜厚度的贡献明显不同。溶液浓度对于薄膜厚度的大小起主要决定作用,而旋涂层数则仅使薄膜厚度产生小范围波动,旋涂层数对厚度的影响程度也随着浓度的增加而加大。这是由于当浓度较小时,薄膜孔洞较多,旋涂时溶液会优先去填补空缺处,所以层数的增加对厚度的影响较小;当浓度较大时,薄膜趋于致密,旋涂层数的增加自然就促进了厚度的增长。

图3 不同浓度和旋涂层数制备的P(VDF-Tr FE)薄膜的表面形貌照片Fig.3 Surface morphologies of P(VDF-Tr FE)films prepared with different concentrations and spin coating layers
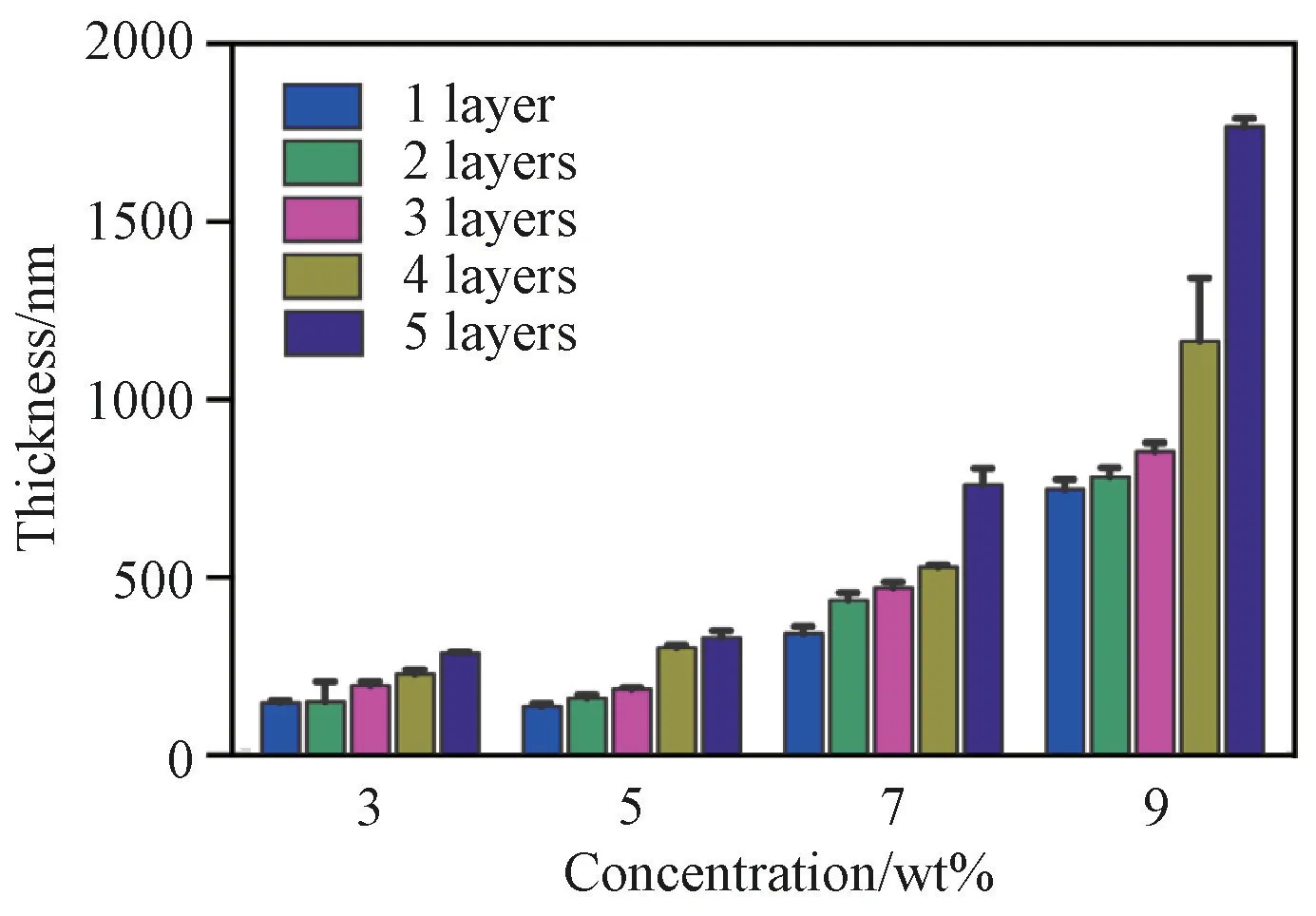
图4 不同浓度和旋涂层数条件下制备的P(VDF-Tr FE)薄膜的厚度Fig.4 Thickness of P(VDF-Tr FE)films prepared with different concentrations and spin coating layers
值得注意的是,由旋涂法制得的P(VDF-Tr FE)薄膜的厚度大多都不超过1μm。因此,旋涂法可以获得纳米级薄膜,通过对溶液浓度和旋涂层数的控制可实现对薄膜厚度“粗+细”的双重调控。
3.1.3 覆有薄膜的ITO 电极的电化学响应分析 如图5所示,对覆有不同工艺条件下制备的P(VDFTr FE)薄膜的ITO 电极,施加不同电压的双脉冲信号,积分得到相应电压下周期内通过的电荷量。可以看到,与未覆膜的ITO 电极相比,所有覆膜的ITO 电极上通过的电荷量均明显减少。当溶液浓度为3%时,旋涂层数即使增加至5层也明显有电荷通过;当浓度为5%时,旋涂层数增加至5层时通过的电荷量骤然减少,预计6层可达完全绝缘;当浓度为7%和9%时,旋涂层数增加至3层时已基本无电荷通过,达到绝缘。
从图5可见,平面微电极上的P(VDF-Tr FE)薄膜确实起到了一定的电流阻挡作用,其效果可由制备工艺调节,提高溶液浓度和增加旋涂层数都能有效增强薄膜的绝缘能力。然而,P(VDF-Tr FE)薄膜的绝缘能力并不与薄膜的厚度直接相关,其中可实现完全绝缘的薄膜的最小厚度为470 nm。
综合考察薄膜的致密度、厚度和绝缘性三者的关联性,由溶液浓度7%、旋涂3 层制备的P(VDFTr FE)薄膜即能均匀致密地覆盖整个ITO 基板,并可消除因电极图案化造成的对材料不均匀性的影响;该薄膜绝缘性好,可以完全阻挡电刺激时产生的微电流和可能存在的电化学产物;而且它在致密绝缘薄膜中厚度最小,仅为470 nm,不会过多阻隔电刺激时两极间产生的电场。因此选取470 nm 薄膜作为本研究后续实验的样品。
3.2 电极电场作用时薄膜表面的电场测试
给P(VDF-Tr FE)薄膜下面的ITO 电极施加一定的电信号,以在薄膜表面处产生电场。通过SKPM 分别测量正极、玻璃、负极的平均表面电势,计算出不同脉冲电压下相邻电极之间的平均电势差,结果见图6所示。250、500、1000和1500 m V 的刺激电压下薄膜表面处相邻电极间的电势差分别为87、205、453 和677 m V,证明电刺激时ITO电极上的P(VDF-Tr FE)薄膜表面确实有电场存在,且电场强度受刺激电压调控。
3.3 覆有薄膜的电极对MSCs生长行为的电刺激影响
将样品置于自制的电刺激装置中,灭菌后在上面接种MSCs,粘附24 h后,每天施加持续时间为1 h的双脉冲电信号,探究不同强度的电场刺激对MSCs的增殖和成骨分化行为的影响。

图5 不同浓度和旋涂层数条件下制备的P(VDF-Tr FE)薄膜的电荷-电压曲线Fig.5 Charge-Voltage curves of P(VDF-TrFE)films prepared with different concentrations and spin coating layers

图6 电刺激下ITO 正负电极在薄膜表面处的电压差Fig.6 Voltage difference of ITO positive and negative electrodes at the film surface under electrical stimulation
如图7A 所示,随着培养时间从1天增加至3天,细胞数量明显增多,说明P(VDF-Tr FE)薄膜具有良好的生物相容性。在细胞培养3天时,经电场刺激的细胞均比未刺激的增殖得多,且随着刺激电压的增加,MSCs的增殖数量呈先升高后下降的趋势,在电压为250 m V 时的细胞增殖效果最好。图7C 是相应时间的细胞染色图,可以直观地看到,与未刺激组相比,250 m V刺激的MSCs显示出更大的铺展面积和更多的细胞数量。随着培养时间延长至7天,如图7B 所示,MSCs的ALP活性也呈现相同的类抛物线趋势,在电压为250 m V 时达到了最高值。

图7 电场刺激对MSCs的生长行为的影响 (A)细胞增殖;(B)细胞ALP活性;(C)活细胞染色图。Fig.7 Effects of electric field stimulation on the growth behaviors of MSCs(A)Proliferation;(B)ALP activity;(C)Cell staining images
综上所述,电场刺激有利于MSCs的增殖和成骨分化。其中,250 m V 的刺激电压是促进MSCs增殖和成骨分化能力的最佳刺激条件。
4 结 论
采用旋涂法在ITO 平面微电极上制备了P(VDF-Tr FE)纳米级薄膜,通过改变P(VDF-Tr FE)溶液浓度和旋涂层数来调控薄膜的致密度、厚度和绝缘能力,其中致密且绝缘的P(VDF-Tr FE)薄膜的最小厚度为470 nm。该薄膜可以有效地隔绝电刺激时电极上的微电流和可能存在的电化学产物,并消除因电极图案化造成的材料不均匀性的影响。电刺激能使ITO 上的薄膜表面处产生电场,电场强度受刺激电压调控。初步验证电场刺激能够促进MSCs的增殖和成骨分化,最佳刺激电压为250 m V。

