荒漠草原区不同植被恢复模式土壤微生物菌落分布特征及其与土壤理化性质的相关性
卞莹莹, 张志敏, 付 镇, 刘文娟
(宁夏大学农学院, 宁夏 银川 750021)
荒漠草原是宁夏面积最大的天然草地类型,占宁夏草原面积的55%[1]。宁夏实施退耕还(林)草、草地围封禁牧和休牧将近20年,为了恢复天然植被,在退化草地上采取草地围封和补播、灌丛引入等措施[2],逐渐形成了以天然草地、天然柠条(CaraganaIntermedia)林地、人工柠条林地为主的植被恢复土地利用类型。为了有效防止人工柠条林木质化,在该区域也形成了大面积的平茬人工柠条林地[3]。微生物是连接植物与土壤环境之间的纽带,其菌落组成和结构受植物和土壤因子的直接影响[4-8]。高肥力土壤具有良好的理化性状,土壤中细菌、放线菌、微生物量碳、微生物量氮以及土壤酶活性数量均较高,而真菌数量较低,低肥力土壤则相反[9]。当土地利用方式发生改变时,土壤微生物数量及活性也相应的发生变化。柠条灌丛的形成过程使水分和养分较多地聚集在灌丛内形成“沃岛”[10],加剧了由于土壤有机碳含量增加和氮素有效性增强而导致的土壤资源空间异质性和斑块化[11-15]。与自然恢复植物群落相比,人工柠条林地有较丰富的植物群落层次,盖度大,多样性和丰富度高,可以形成良好的草本植被,且在短时间内就可以达到良好的水土保持效果[16]。
宁夏荒漠草原区不同植被恢复模式下土壤微生物的研究目前主要集中在土壤基础呼吸量对土壤的生物活性和物质代谢强度的影响[2]、柠条根际土壤微生物多样性[4,17]、不同密度人工柠条林对土壤微生物的影响[18]、不同植物菌落微斑块内土壤微生物区系特征[19]等,鲜有针对荒漠草原区不同植被恢复模式下土壤微生物菌落分布特征及其与土壤理化性质之间相关性的研究。
本文以宁夏荒漠草原区立地条件基本相似的人工柠条林地、平茬人工柠条林地、天然柠条林地为研究对象,以天然草地为对照,采用平板划线法对不同植被恢复模式下土壤微生物菌落数量特征进行分析,探究其与土壤理化性质的相关性,对比不同植被恢复方式下土壤肥力的好坏。目的是从微生物菌落变化的角度出发,探究荒漠草原区植被恢复对土壤肥力的影响,筛选出最适合荒漠草原区的植被恢复方式,为退化草地的恢复管理提供理论参考。
1 材料与方法
1.1 研究区概况
研究区宁夏回族自治区盐池县花马池镇四墩子行政村(37°04′~ 38°10′ N,106°30′~ 107°47′ E)位于盐池县中部城乡过渡带,海拔1 380~1 600 m,年均气温(7.7±1.3)℃,10℃以上年积温(2 947.1±2.8)℃,无霜期(152±10) d,年均降水量(289.4±16.4) mm,主要集中在7—9月,年均蒸发量(2 131.8±10.4) mm,是典型的大陆性气候。区域内主要以灰钙土和风沙土为主,土壤矿化程度较高,以碱性土壤为主,部分区域土壤pH值超过9.0。该区域主要为荒漠草原,植被类型以草本和小灌木为主,植物菌落结构相对简单,主要植物有冰草(Agropyroncristatum)、白草(Pennisetumcentrasiaticum)、猪毛蒿(Artemisiascoparia)、锦鸡儿属(Caragana)植物等。
1.2 试验设计
在研究区围封的草原内选择立地条件基本相似且相邻的,林龄为6 a、带间距为6 m的平茬人工柠条林地(样地代号PACI,2011年种植,2014年平茬)、人工柠条林地(样地代号ACI,2011年种植)、天然草地(样地代号NG)及天然柠条林地(样地代号NCI)设置样地,各类样地分别设置样地3块,样地面积为150 m×150 m。
样地基本特征见表1,各样地内植被株高差异显著(P<0.01),植被盖度、土壤容重、土壤粘粒含量、pH值均无显著差异。林下主要草本种类为针茅(Stipacapillata)、大戟(Euphorbiapekinensis)、米口袋(Gueldenstaedtiaverna)、糙叶黄耆(Astragalusscaberrimus)、长芒草(Stipa.bungeana)。

表1 样地基本信息
1.3 研究方法
1.3.1样品采集 2020年9月在天然草地样地中,用土钻法按“S”形分别在0~5 cm,5~10 cm,10~20 cm和20~40 cm土层取土,各层3次重复,同层土样均匀混合,共取土样12个。将平茬柠条林样地、未平茬柠条林样地和天然柠条林样地按30 m×30 m划分成网格,在每一网格内选取柠条灌丛1丛,每个样地选择柠条灌丛25丛,共75丛;以灌丛根颈为中心,在20 cm半径范围内用土钻法按东、南、西、北4个方向分别在0~5,5~10,10~20和20~40 cm土层取土,各层3次重复,同层土样均匀混合,共取土样300个。将土样置于塑封袋密封后迅速称重,放置于冰盒内带回实验室,去除其中可见的植物残体及土壤动物后过100目筛,一部分放置于冰箱内—20℃冷冻保存,用于测定土壤微生物量碳氮、可溶性氮组分、微生物菌落数量等;另一部分在样品盘上铺开自然风干,用于测定土壤pH、全氮、有机质等理化指标。降水数据来自安装在试验区内的小型自动气象站。
1.3.2相关指标测定方法 土壤质量含水率(Moisture content,MC)测定采用烘干法[20]。蒸馏水(土水比1∶2.5,W/V)浸提15 min,用Mettler-To ledo 320 pH计测定土壤pH值。重铬酸钾容量法-外加热法测定土壤有机碳(Organic carbon,OC)含量[20]。元素分析仪(Vario-MAX C/N)测定土壤全氮(Total nitrogen,TN)含量。氯仿熏蒸-K2SO4浸提法[21-22]测定土壤微生物量碳(Microbial biomass carbon,MBC)和土壤微生物量氮(Microbial biomass nitrogen,MBN)。K2SO4浸提,凯氏定氮仪测定可溶性全氮(Soluble total nitrogen,STN)含量;KCl浸提,流动分析仪测定土壤铵态氮(Ammonium nitrogen,AN)、硝态氮(Nitrate nitrogen,NN)含量。每个指标重复测定3次,结果取平均值。可溶性有机氮(Dissolved organic nitrogen,DON)为可溶性全氮减去铵态氮、硝态氮的差。
1.3.3土壤微生物菌落数量测定 采用稀释平板法[23]估算土壤微生物菌落数量。根据预试验结果,按10倍法依次稀释土悬液,土壤溶液稀释到10—5。细菌、真菌、放线菌菌落培养分别用牛肉膏蛋白胨培养基、‘高氏1号’培养基、马丁氏斯孟加拉红培养基。土悬液接种采用平板涂布法,接种的培养基在恒温培养箱中25℃培养3~5 d,各培养基重复4次。
1.4 数据处理与方法
Microsoft Excel 2007软件用于数据整理、作图。用SPSS 22.0软件进行不同植被恢复方式样地不同土层内微生物菌落数量间方差齐性检验(Levene’s test)、单因素方差分析(One-way ANOVA)及相关性分析。
2 结果与分析
2.1 不同植被恢复模式下微生物菌落数量变化特征
2.1.1不同植被恢复模式下0~40 cm土层微生物菌落数量变化特征 如图1所示,各样地0~40 cm土层中细菌、放线菌、真菌菌落数量差异显著(P<0.01)。NG样地土壤中细菌、真菌菌落数量最高。ACI样地中放线菌菌落数量最高。

图1 不同植被恢复模式下0~40 cm土层细菌、放线菌、真菌菌落数量
2.1.2不同植被恢复模式下不同土层细菌、放线菌、真菌菌落数量变化特征 各样地0~5,5~10,10~20,20~40 cm土层中细菌菌落数量差异显著(P<0.01)。ACI,NG样地土壤中细菌群落数量随土层加深呈现波动变化。PACI样地土壤中细菌菌落数量随土层加深先增加后逐渐减少。NCI样地土壤中细菌群落数量随土层加深而逐渐减少(趋势线斜率=-7 144.3)(图2)。
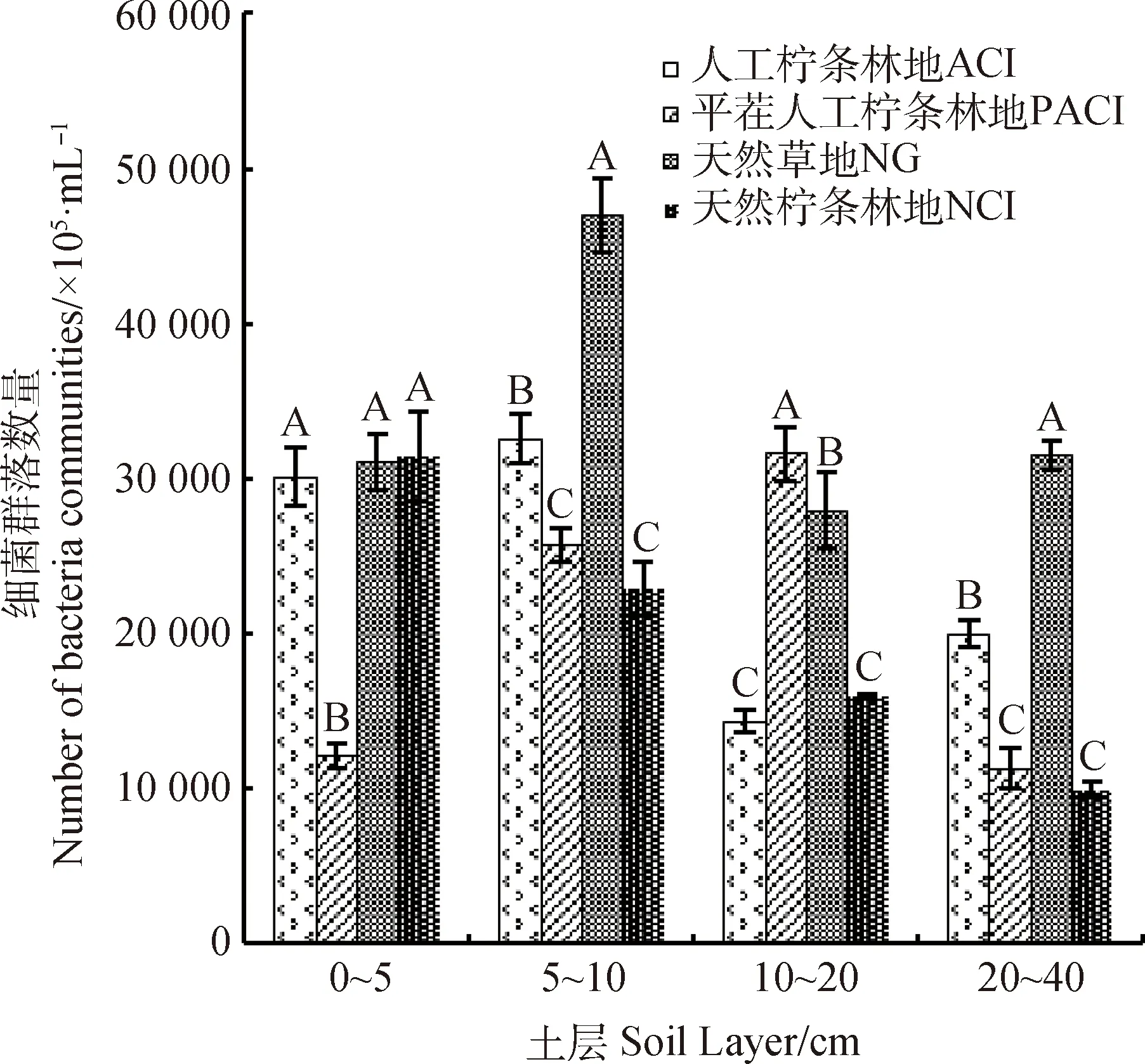
图2 不同植被恢复模式下不同土层细菌群落数量变化特征
各样地0~5,5~10,10~20,20~40 cm土层中放线菌菌落数量差异显著(P<0.01)。ACI,NCI,NG样地土壤中放线菌群落数量随土层加深而波动变化。PACI样地土壤中放线菌数量随土层加深先增加后减少(趋势线斜率=—3083.8)(图3)。

图3 不同植被恢复模式下不同土层放线菌群落数量变化特征
各样地0~5,10~20,20~40 cm土层中真菌菌落数量差异显著(P<0.01)。ACI,PACI,NCI样地土壤中真菌群落数量随土层加深而波动变化。NG样地土壤中真菌菌落数量随土层加深先增加后逐渐减少(图4)。

图4 不同植被恢复模式下不同土层真菌群落数量变化特征
2.2 不同植被恢复模式下土壤微生物菌落数量与土壤理化指标之间的相关性
2.2.1不同植被恢复模式下0~40 cm土层微生物菌落数量与土壤理化指标之间的相关性 ACI样地0~40 cm土层中菌群数量与土层中微生物量碳含量显著正相关(P<0.01),细菌菌落数量与土壤容重显著正相关(P<0.05);放线菌菌落数量与土层中微生物量碳含量显著正相关(P<0.01);真菌菌落数量与土壤理化指标无显著相关性。PACI样地0~40 cm土层中菌落数量与土层中微生物量氮显著负相关(P<0.05),细菌菌落数量与土壤理化指标间无显著相关性;放线菌菌落数量与土层中铵态氮含量显著正相关(P<0.01);真菌菌落数量与土层中可溶性有机氮含量显著负相关(P<0.05)。NG样地0~40 cm土层中菌落数量与土壤理化指标无显著相关性,细菌菌落数量与土壤容重显著负相关(P<0.05);放线菌菌落数量与土壤质量含水率显著正相关(P<0.05);真菌菌落数量与土壤中有机碳含量显著负相关(P<0.05)。NCI样地0~40 cm土层中菌落数量与土壤质量含水率显著正相关,细菌、放线菌和真菌菌落数量与土壤理化指标间无显著相关性(表2)。
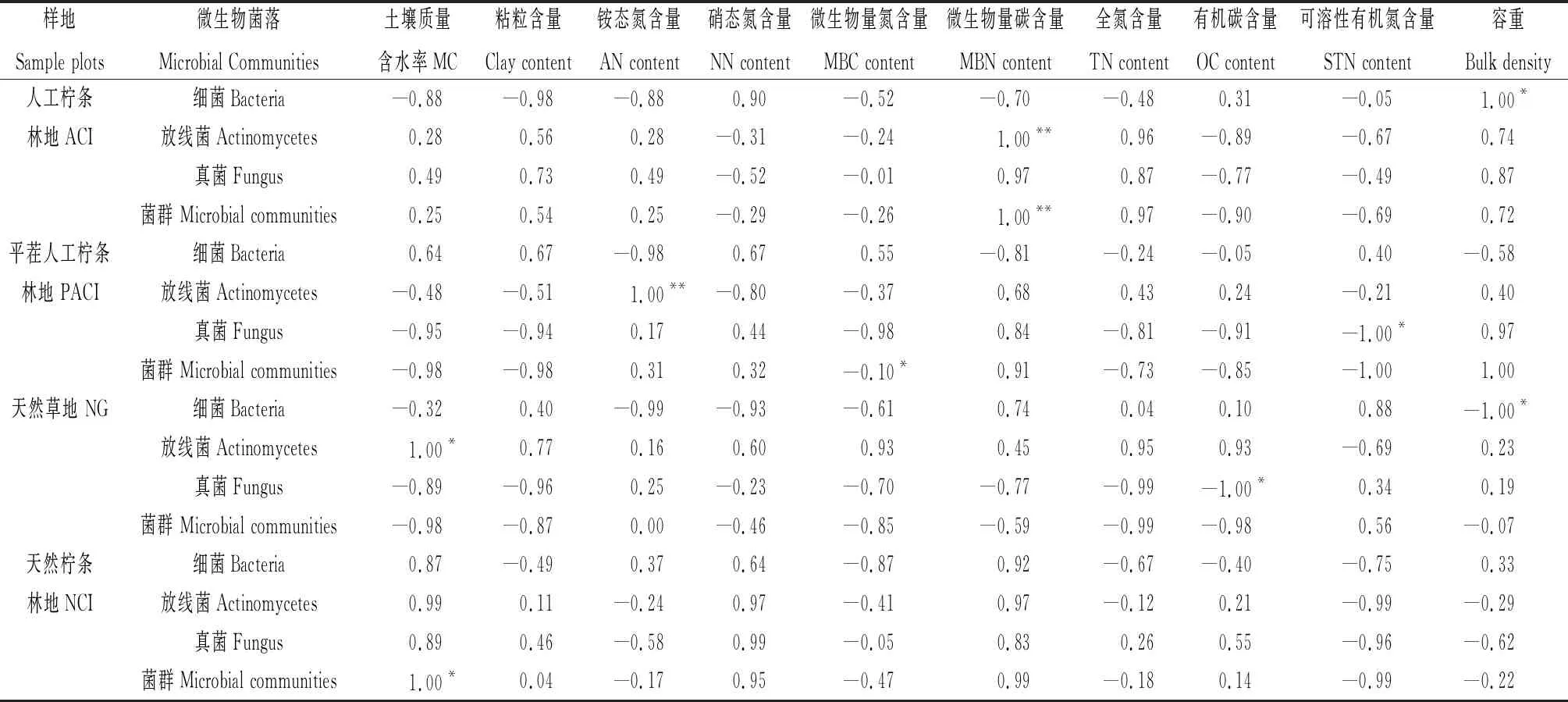
表2 不同植被恢复模式下微生物菌落数量与土壤理化指标的相关性
2.2.2不同植被恢复模式下不同土层微生物菌落数量与土壤理化指标之间的相关性 如表3所示,ACI样地0~5 cm土层中,细菌菌落数量与土壤质量含水率显著负相关(P<0.01);放线菌菌落数量与土壤粘粒含量显著正相关(P<0.05);真菌菌落数量与硝态氮含量显著负相关(P<0.05)。5~10 cm土层中,细菌菌落数量与微生物量碳含量显著负相关(P<0.05);放线菌菌落数量与土壤有机碳含量显著负相关(P<0.05);真菌菌落数量与土壤可溶性有机氮含量显著负相关(P<0.05)。10~20 cm土层中细菌菌落数量土壤质量含水率显著负相关(P<0.05),放线菌和真菌数量与土壤理化指标无显著相关性。20~40 cm土层中细菌、真菌和放线菌群落数量与土壤理化指标无显著相关性。
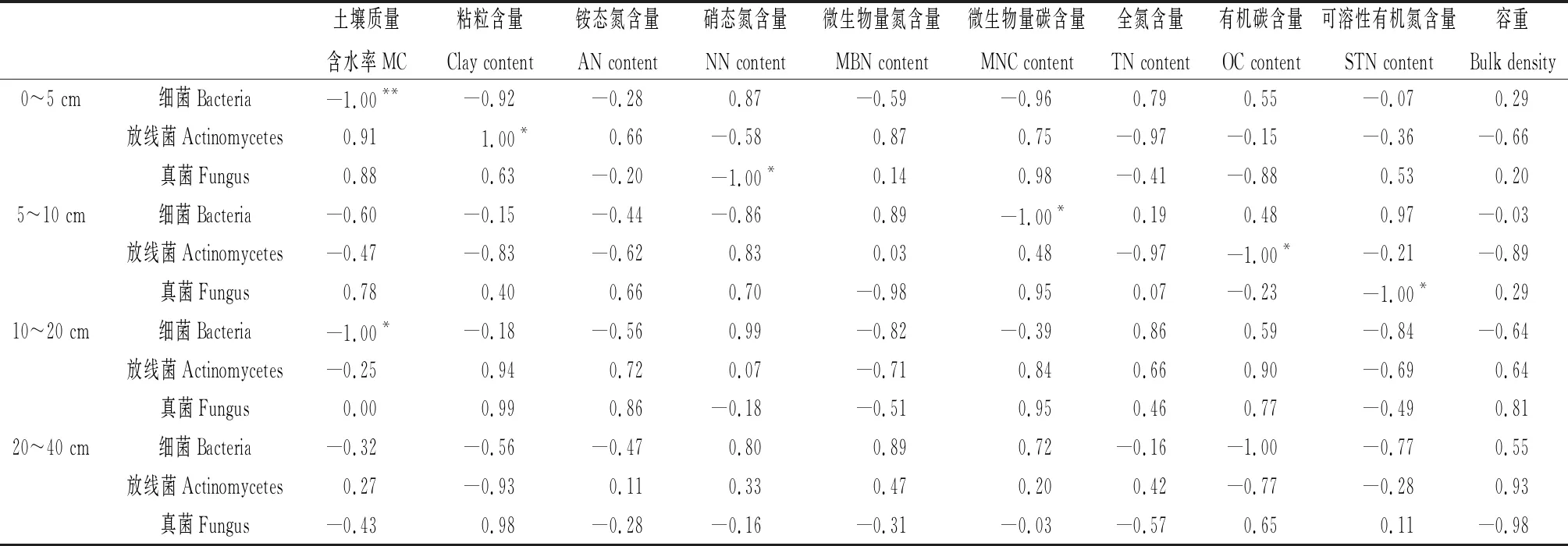
表3 人工柠条林地不同土层微生物菌落数量与土壤理化指标的相关性
如表4所示,PACI样地0~5 cm土层中放线菌菌落数量与土壤微生物量氮含量显著负相关(P<0.01),细菌和真菌菌落数量与土壤理化指标无显著相关性。5~10 cm土层中放线菌菌落数量与土壤质量含水率显著正相关(P<0.05),真菌菌落数量与土壤碱解氮含量显著负相关(P<0.05),细菌菌落数量与土壤理化指标无显著相关性。10~20 cm土层中细菌菌落数量与硝态氮含量显著正相关(P<0.01),放线菌和真菌菌落数量土壤理化指标无显著相关性。20~40 cm土层中细菌菌落数量与土壤质量含水率显著正相关(P<0.05),放线菌和真菌菌落数量与土壤理化指标无显著相关性。

表4 平茬人工柠条林地不同土层微生物菌落数量与土壤理化指标之间的相关性
如表5所示,NG样地中0~5 cm土层真菌菌落数量与微生物量碳含量显著负相关(P<0.01),细菌和放线菌菌落数量与土壤理化指标无显著相关性。5~10 cm土层放线菌菌落数量与土壤硝态氮含量显著正相关(P<0.05),细菌和真菌菌落数量与土壤理化指标无显著相关性。10~20 cm土层中细菌菌落数量与土壤容重显著负相关(P<0.05);真菌菌落数量与土壤铵态氮含量显著负相关(P<0.05),放线菌菌落数量与土壤理化指标无显著相关性。20~40 cm土层中,细菌菌落数量与硝态氮含量显著负相关(P<0.05),放线菌和真菌菌落数量与土壤理化指标无显著相关性。

表5 天然草地不同土层微生物菌落数量与土壤理化指标之间的相关性
如表6所示,NCI样地0~5 cm土层中细菌菌落数量与土壤粘粒含量、微生物量氮含量显著负相关(P<0.01),放线菌菌落数量与土壤质量含水率显著负相关(P<0.05),与土壤容重显著负相关(P<0.01)。5~10 cm土层细菌菌落数量与土壤可溶性有机氮含量显著负相关(P<0.05),放线菌菌落数量与土壤粘粒含量显著正相关(P<0.05),真菌菌落数量与土壤理化指标无显著相关性。10~20 cm土层真菌菌落数量与土壤可溶性有机氮含量显著负相关(P<0.05),细菌和放线菌菌落数量与土壤理化指标无显著相关性。20~40 cm土层细菌、真菌和放线菌菌落数量与土壤理化指标无显著相关性。
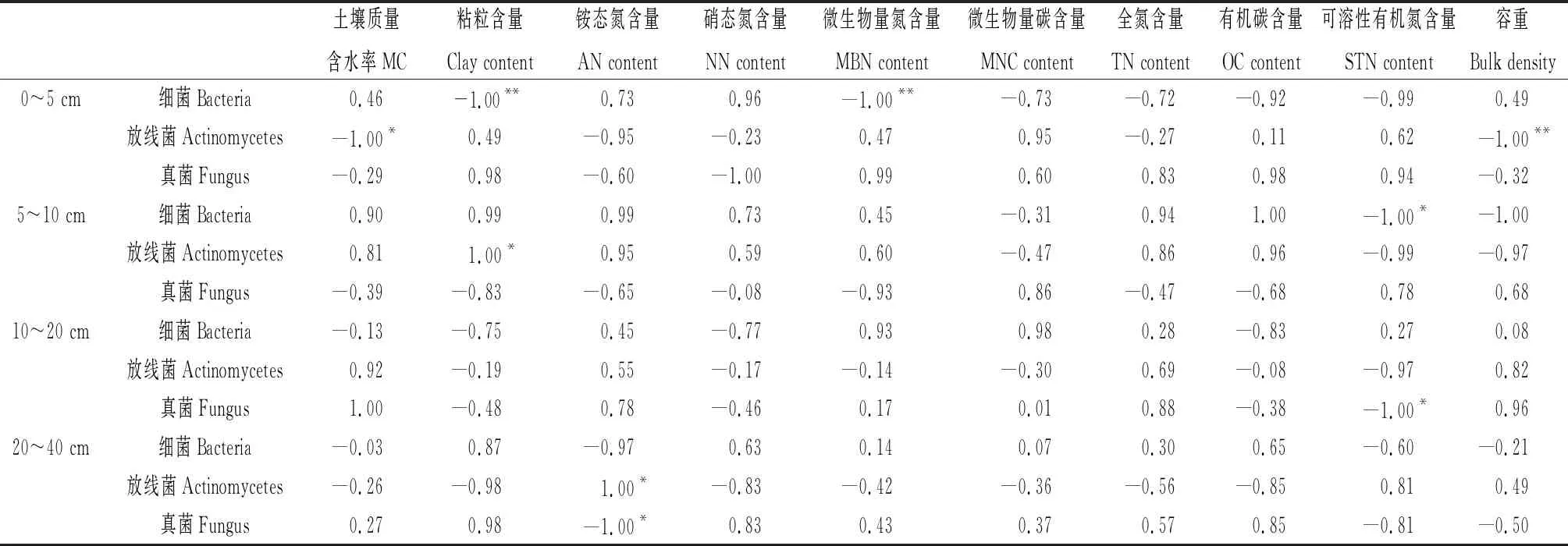
表6 天然柠条林地不同土层微生物菌落数量与土壤理化指标的相关性
3 讨论
3.1 不同植被恢复模式对土壤微生物菌落分布特征的影响
人工植被恢复过程对退化草地植被恢复有积极的作用[24],人工种植柠条林加速土壤微生物菌落结构变化[25],对土壤理化性质的改变产生积极的影响。植被生长改善了表土层水热和通气状况,为微生物的繁殖和生长提供有利条件[26],在植被、土壤微生物和植被凋落物输入的共同作用下,加速土壤有机质转化分解与固存过程,在土壤表层产生“聚表效应”[27-28]。柠条冠层下的“沃岛效应”有效增加了人工柠条灌丛下土壤全氮、有机质、土壤微生物量碳氮、可溶性氮组分含量[15,29],进而加速氮素循环[30],提高了土壤中氮素的可利用性[31]。本研究中,4种植被恢复模式下土壤中细菌、真菌、放线菌数量随土层加深分别与土壤理化指标表现出一定的显著相关性,这表明植被恢复可以通过改变土壤的理化性质,进而影响土壤中微生物菌落的数量和分布。人工柠条林地和天然柠条林地土壤中真菌数量低于天然草地,表明柠条林的生长可以调整土壤真菌群落的数量。
土壤微生物的垂直分布状况在一定程度上反映了不同植被恢复模式下土壤的营养状况,随着土层加深,土壤环境条件改变,微生物菌落数量、分布及结构也相应发生改变[32]。受地上植被的影响,本研究中人工柠条林地5~10 cm土层中细菌菌落数量最多,之后随着土层的加深细菌菌落数量逐渐减少,真菌菌落数量的变化趋势与细菌菌落数量的变化趋势相反,表明随着土层加深土壤中有机质含量的减少。平茬人工柠条林地中细菌菌落数量随土层加深而增加,在10~20 cm土层最多,之后又迅速减少,而真菌菌落数量变化趋势与之相反,此现象可能是由于人工柠条林平茬后,土壤有机碳、全氮有效提高,改善了土壤养分状况[29],进而改善了微生物群落组成和结构。
3.2 不同植被恢复模式下土壤微生物群落特征与土壤理化性质之间的相关性
林草地生态系统中的能量流动和物质转化主要依靠微生物作用[33],微生物活性及菌落活动受制于土壤温度、湿度、有机碳含量等[34],不同微生物对土壤性质的变化响应不同[35]。自然植被恢复有利于土壤微生物菌落物种数量的增加,其中以细菌菌落数量对土壤养分含量变化的响应最为显著[36];本研究中4种植被恢复样地中土壤微生物菌落数量随土壤容重的增加而减小,其中人工柠条林地中细菌菌落数量与土壤容重显著正相关(P<0.05),表明土壤容重通过影响土壤通气性和孔隙度、根系穿透阻力以及根系的生长和发育,间接影响土壤的生物活性,表现为微生物数量的降低[37]。天然草地微生物菌落数量高于人工柠条林地和天然柠条林地,天然草地中土壤有机碳含量高于人工柠条林地和天然柠条林地,此结果可能是由于天然草地中植物归还土壤凋落物的数量和质量以及根系分泌物的不同引起的微生物提供能源的差异,从而导致土壤微生物菌落数量的不同[38-40]。天然草地样地中真菌菌落数量高于其他植被恢复方式,且真菌菌落数量与土微生物量碳含量显著负相关(P<0.05),其原因可能是由于真菌菌落需要从土壤环境中摄取更多有机物作为碳源的营养来源,使土壤有机质含量减少,进而使土壤肥力下降[41-42]。
不同的学者在研究草原土壤微生物菌落变化的过程中指出地表植物群落变化与土壤微生物菌落结构存在显著相关性[43],本研究主要研究了人工植被恢复过程中土壤微生物菌落数量的变化趋势,有关人工植被恢复过程中微生物菌落结构和酶活性的研究将是今后继续探索的一个主要方向。
4 结论
4种不同植被恢复模式下,土壤表层(0~5,5~10 cm)微生物菌落数量与土壤理化指标显著相关(P<0.05)。天然植被恢复可增加土壤微生物菌落数量,人工种植柠条加速优化土壤微生物菌落结构,人工柠条林平茬可有效增加人工柠条林地土壤中微生物菌落数量并改善微生物菌落结构,但其微生物菌落总数仍低于平茬前。4种植被恢复模式下,人工柠条林地土壤微生物菌落结构优于天然草地,土壤中细菌、放线菌群落数量多,土壤肥力相对较好。人工种植柠条更有利于荒漠草原区植被恢复。

