基于形态特征和SSR标记的斑茅繁殖策略的研究
安金婵, 常 丹, 白史且, 陈智华, 鄢家俊, 张建波, 李达旭,游明鸿,毛德才, 王 艳, 杨金平, 李英主, 邱文静
(1.西南民族大学, 四川 成都 610041;2.四川省草原科学研究院, 四川 成都 611731)
繁育系统是指所有直接影响其后代遗传组成的有性特征,包括花的综合特性、花部各器官的寿命、传粉方式、自交亲和程度和交配系统等[1]。其中交配系统至关重要,它控制基因通过配子体传递了两代间遗传信息,决定了后代的基因型分布,对物种的遗传变异水平和自然种群的遗传组成产生深远的影响[2]。因此了解植物繁殖特性对于确定遗传育种和植物保护制定至关重要[3-4]。
人们研究植物繁殖性状主要是从物候学、形态特征和人工授粉试验中推断出来的[5-6]。如观测其物候期、传粉特性、杂交指数以及套袋试验等指标来推测植物的交配系统[7-9]。但是,这些指标的测量只能推测异交和自交的相对程度,不能反映植物自然群体的真实异交率。随着科技的发展,分子标记的使用克服了这些困难,分子标记不受外界环境和植物生长发育阶段的影响[10],被广泛用于研究和确定植物交配系统。简单重复序列(simple sequence repeats,SSR)标记因其重复性好、操作简便、高效和多态性,已成为一种应用广泛的分子标记工具[11]。根据遗传标记估计的交配系统参数有助于特定植物物种保护策略和育种选择方式的发展。
斑茅(Saccharumarundinaceum)是甘蔗属(Saccharum)密丛高大草本植物,适应性强,广泛种植在我国南方荒山荒坡、盐碱地、沿海滩涂等地。其种内变异丰富、抗旱抗虫耐贫瘠性强、分蘖多、生长快,有较强的生态竞争能力[12-13],在缓解能源供给紧张的同时,对改善我国生态环境具有重要意义。其优异性状特点也倍受甘蔗(Saccharumofficinarum)育种者的普遍关注,对高产高糖甘蔗品种的培育有重要意义。但是,由于斑茅花期普遍比甘蔗早3~6个月[14],使得斑茅优良特性的利用率低下,且斑茅-甘蔗杂交困难。目前国内外对斑茅植物的研究主要集中在种质资源的调查及评价、形态学、细胞学、蛋白质标记、遗传多样性及种质资源抗逆性的研究等方面[15],对斑茅植物生殖生物学方面试验性研究还未见报道。而植物学性状与分子标记两者相结合才能选出最佳育种材料,达到预期的育种目标[16]。故本研究以收集自我国7省的45份野生斑茅为研究对象,对斑茅表型特征和交配系统进行研究,以期阐明斑茅的繁殖特性及其有性繁殖力的情况,为斑茅资源的开发利用、保护、杂交育种及繁殖技术提供基础依据。
1 材料与方法
1.1 材料
试验材料来自四川省成都市大邑县韩场镇种质资源圃(30°25′ N,103°45′ E),该资源圃收集了来自我国陕西、四川、贵州、广西、云南、广东、海南7省的野生无性系斑茅种质资源(四川省草原科学研究院提供),于2012年移栽,植株高大健壮,平均株高 4.5 m。共有45个居群(如表1),每个居群种于一个长8 m宽5 m的地块中,每个地块包含12个无性系单株。
1.2 方法
1.2.1花粉量与花粉-胚珠比P/O 采用血球计数法[17]统计斑茅花粉量。从每个斑茅居群中随机选取3个单株进行标记,每株选择3个即将开放的小花,放入1.5 mL离心管中,带回实验室。将离心管中的花药捣碎,加入0.1 mL 1.0 mol·L-1的盐酸对花药进行水解一个小时,用移液枪吸取约0.01 mL 进行制片,在显微镜(10×)(OLYMPUS-BX53F,日本)下直接观察记录5个大方格的数值(血球计数板计数池长宽各3.0 mm,分为9个大方格,每个大方格容积为0.1 mm3),记录数值A,1朵花的花粉总数=0.1×A/(0.5×10-3×3)=200A/3。检测一朵小花的胚珠数,P/O=1朵小花花粉量/一朵小花的胚珠数。根据Cruden[18]标准(P/O为2.7~5.4时,其繁育系统为闭花受精;P/O为18.1~39.0时,繁育系统为专性自交;P/O为31.9~396.0时,繁育系统为兼性自交;P/O为244.7~2 588.0时,繁育系统为兼性异交;P/O为2 108.0~195 525.0时,繁育系统为专性异交)来判断斑茅的交配系统。
1.2.2花粉活力与花粉寿命 采用TTC法[19]测定花粉活性:选择即将开放的斑茅小花采集花药,将花药撒于载玻片上,滴加0.1%的TTC染液进行染色,后于显微镜下统计被染色和未被染色的花粉数目。计算花粉活力百分比。
随机选取17个居群,每个居群选取3个单株抽穗2/3但未盛开的斑茅花穗无性系材料,剪取单株穗茎(带叶片)带回室内进行自来水养茎,从正在开放的花上收集一定量的花粉,每隔0.5 h用TTC染色,染成红色的记为有活力的花粉,其余均记为无活力的花粉(由同一个人计数),并计算花粉活力百分比,求出花粉最长存活时间,得出花粉寿命。
1.2.3杂交指数OCI(outcrossingindex)测定 每个居群选择1个单株上的一条斑茅花穗进行花序直径、花朵大小以及对雌雄蕊开花时期形态的观测,按照Dafni[20]的标准进行OCI值的评估,并进行繁育系统评判。

表1 斑茅材料采集地及其海拔、经纬度
①采用游标卡尺测量花序直径,花序直径<1 mm记为0;1~2 mm记为1;2~6 mm记为2;>6 mm记为3。
②花药开裂时间与柱头可授期之间的时间间隔,采用联苯胺-过氧化氢法[18](V1%联苯胺∶V3%过氧化氢∶V水=4∶11∶22)对开花前的柱头进行可授性的鉴定,同时于显微镜下观测柱头周围是否有花粉粒,雌蕊先熟记为0;雄蕊先熟记为1。
③柱头与花药的空间位置,同一高度记为0;空间分离记为1。
三者之和为OCI值。之后依据OCI值进行繁育系统的判定。其标准为:OCI=0,闭花受精;OCI=1时,专性自交;OCI=2时,兼性自交;OCI=3时,自交亲和,有时需要传粉者;OCI=4时,部分自交亲和、异交、需要传粉者;OCI=5时为专性异交。
1.2.4柱头可授性检测 用联苯胺-过氧化氢法[21](V1%联苯胺∶V3%过氧化氢∶V水=4∶11∶22)对斑茅开花前一天、开花时刻、开花后几天进行柱头可授性测定。取斑茅柱头浸入含有联苯胺-过氧化氢溶液的凹面载玻片上,其周围溶液出现蓝色及有气泡产生,则证明柱头具有可授性。
1.2.5SSR分子标记研究交配系统 在45个居群中,对有30个子代以上的母株及其子代进行SSR比较分析。母株取野生无性系斑茅居群中的单株进行样本测定,子代由母株收集而来的种子经发芽育苗后进行测定。共采集15个居群39个半同胞家系材料(39个单株在开放授粉状态下每个单株上收获的种子形成的个体集合),每个家系30个子代,除去育苗及试验过程中的损耗,共获得1 158个子代苗。该15个居群均为6倍体无性系材料。
基因组DNA的提取:DNA采用Plant Gneomic DNA Kit方法提取。采用2%的琼脂糖凝胶测定其质量,紫外分光光度计测定浓度,用无菌水稀释浓度为20 ng·μL-1,存放至-80℃冰箱备用。
引物的筛选:参照Zhang等[22]发表的SSR引物,选取5个样本对引物进行筛选,筛选出如表2所示11对扩增条带清晰、多态性好、稳定性高的引物进行试验。

表2 用于斑茅DNA扩增的11对SSR引物及其退火温度
PCR扩增:PCR扩增采用20 μL体系,包括0.5 μL上游引物,0.5 μL下游引物,10 μL 2×Reaction Mix,1.5 μL 0.1 μg·μL-1模板DNA,最后用ddH2O补足。
扩增反应在PCR东胜(ETC811)扩增仪上进行,扩增程序为95℃预变形5 min,94℃变性30 S,退火45 S,72℃延伸45 S,33个循环;72℃延伸5 min,4℃保存。扩增产物以DL2000 Marker对照,用1.5%的琼脂糖凝胶电泳分离,150 V电压下电泳2 h,最后拍照。
SSR数据分析:本研究采用多位点混合交配系统模型估计多位点异交率和单位点异交率[23]。多位点异交率又称为异交率的多位点估计,在估计时它考虑到了确定性的异交,也考虑到了检测不到但确定已出现的异交。使用Excel对PCR扩增数据进行整理记录其基因型。MLTR3.4[24]统计软件对交配系统进行各参数的计算。在亲本基因型已知的情况下,采用最大期望值法,在95%的置信区间,选择家系内1 000次重复取样,估算多位点异交率(tm),单位点异交率(ts),双亲近交系数(tm—ts)和亲本近交系数(F)。
2 结果与分析
2.1 花粉量与胚珠比
随机对20个斑茅居群的花粉量进行了测定,发现斑茅1朵小花中的3个花药的总花粉量平均为5 897,1朵小花的胚珠数为1。因此,斑茅的花粉量与胚珠比为5 897,根据Cruden[15]的标准判断,斑茅属于专性异交。
2.2 花粉活力与花粉寿命
如表3所示,种群上斑茅花粉活力从开花时刻到开花后3小时,花粉活力逐渐减弱。从开花时刻的44.49%到开花后1小时35.61%再到开花后3小时的6.72%,结果表明斑茅花粉活力较低,且花粉寿命时间约为3个小时,大大限制了花粉的传粉效率。

表3 花药离体后花粉活性率
2.3 柱头可授性检测
用联苯胺-过氧化氢法对斑茅开花前一天,开花时刻、开花后几天进行柱头可授性测定。结果如图1所示,斑茅在开花前一天就具有可授性,到开花时刻柱头可授性最强,之后几天柱头可授性持续下降,到开花后第5天,斑茅柱头可授性趋近于无。表明斑茅柱头可授期不是限制斑茅有性生殖的影响因素。

图1 不同时期斑茅柱头可授性
2.4 杂交指数
如表4所示,斑茅开花后平均花序直径为1.18±0.08 mm。在开花前一天柱头就具有可授性,开花前一天在柱头周围观察到了少量的花粉粒,证明在开花前花药就有轻微的开裂,故雌雄蕊同时成熟。柱头与花药空间位置分离,所以杂交指数(OCI)为2,根据Dafni[17]的标准判断斑茅繁育系统属于兼性自交。

表4 斑茅杂交指数OCI
2.5 SSR分子标记研究交配系统
PCR扩增产物采用1.5%的琼脂糖凝胶电泳分离,部分电泳图如图2所示。对电泳条带进行数据读取,利用MLTR3.4软件对斑茅无性系随机抽取的15个居群中的39个半同胞家系母本单株和1 158个子代进行交配系统评估(表5),结果如下:11个位点估算出多位点异交率(tm)为0.864,单位点异交率(ts)为0.853,自交率(s)为0.136,表明斑茅种群具有较高的异交率水平,同时存在一部分的自交;多位点异交率相关系数(rt)为0.455,多位点父本相关性(rP(m))为0.132,有效花粉供体数目为7.6,也进一步表明斑茅种群具有一定比例的自交;亲本近交系数(F)为0.318,大于0,表明有过剩的纯合子,近交优势较大;近交衰退系数(δ)为-4.144,表明斑茅没有明显的近交衰退现象。
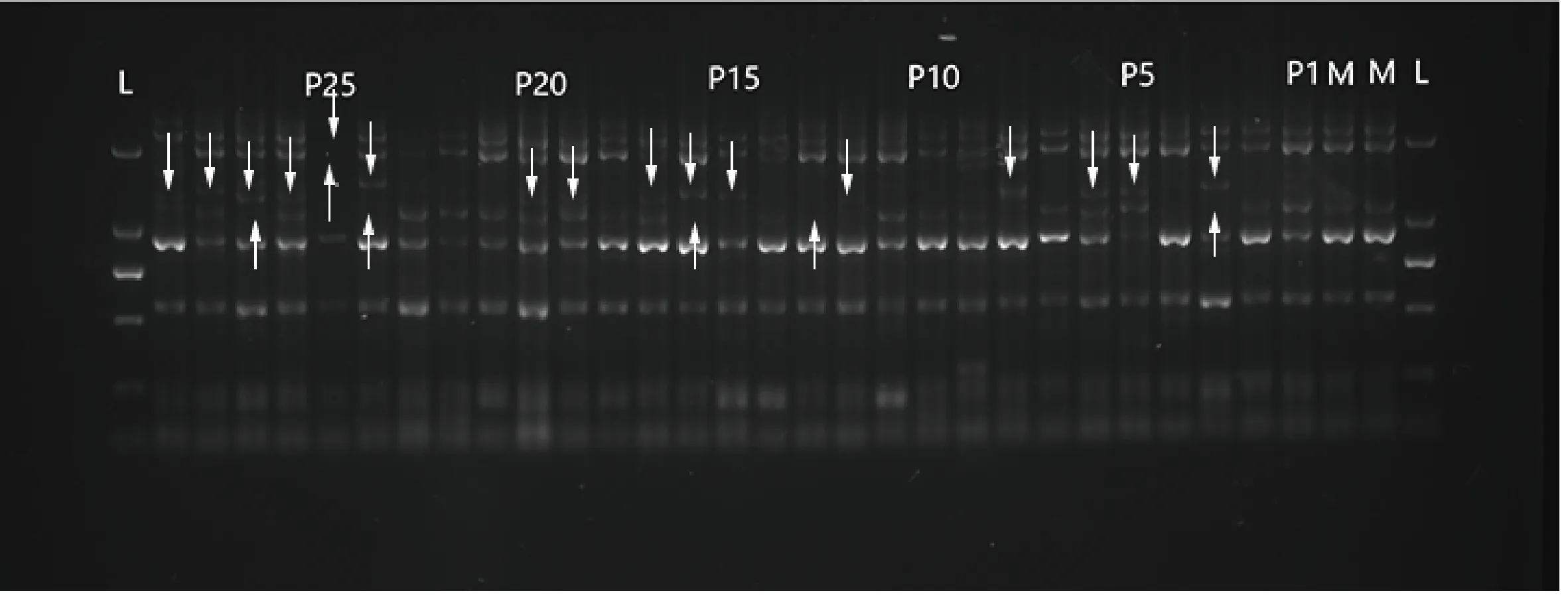
图2 引物L27在部分母本与其子代中的PCR扩增结果

表5 斑茅种群水平上的交配系统参数评估
利用MLTR3.4对斑茅家系进行交配系统分析发现(表6),与在斑茅种群水平上的结果不同,虽然都具有较高的异交率,但居群家系中斑茅多位点异交率变化差异较大(tm=0.601~1.200),单位点异交率同样表现出较大差异(ts=0.575~1.200)。1,13,25,27,48,54,57号家系双亲近交系数<0,说明居群家系间无近亲交配现象。其余居群家系间有较轻程度的近交现象,其中E26号居群双亲近交系数最大。
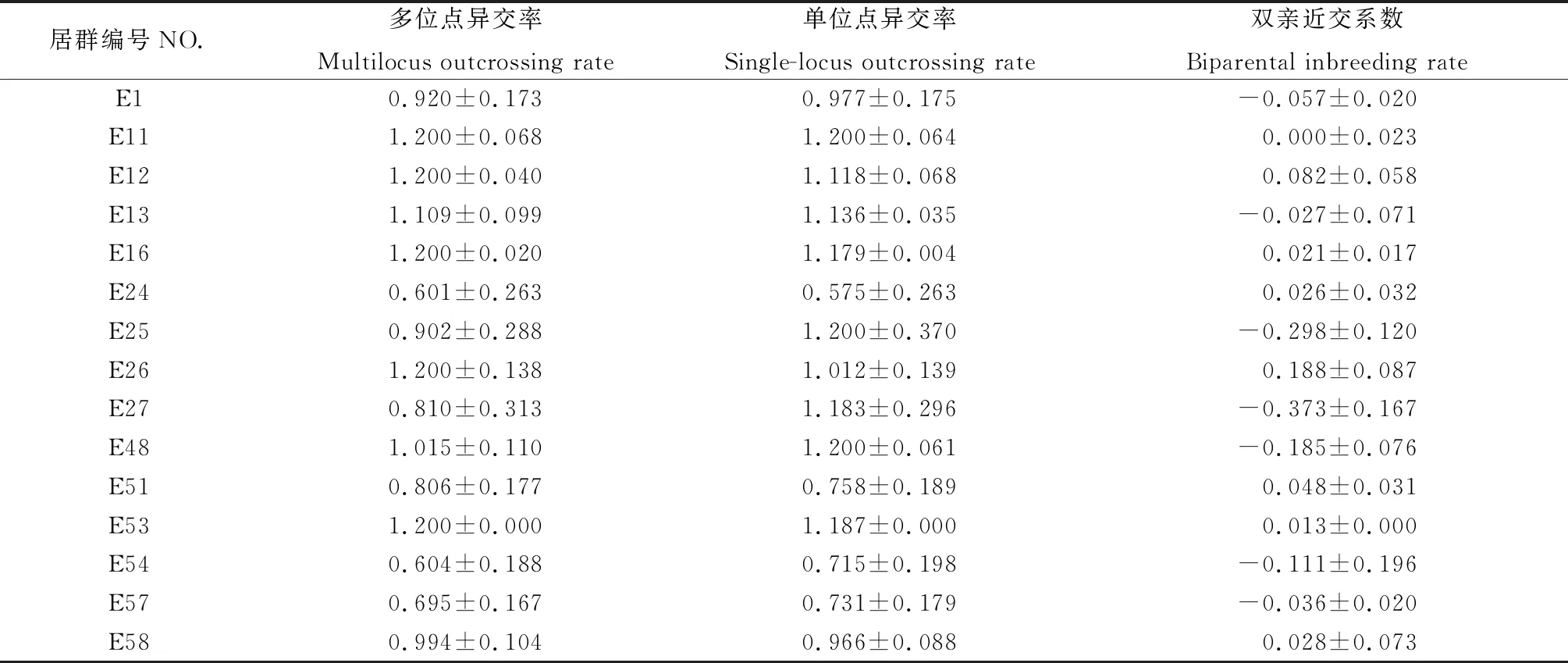
表6 斑茅15个居群交配系统参数
3 讨论和结论
杂交指数、花粉量与胚珠比在研究植物繁育系统中广泛使用。本研究中,P/O为5 897,根据Cruden的标准[24]进行归类分析,斑茅属于专性异交。斑茅的大花粉量符合其多年生禾本科风媒植物的特性[25],其结果也与杨等[14]统计斑茅花粉量大致相同。OCI指数为2,根据Dafni的标准[19],斑茅繁育系统为以自交为主的混合交配系统,与本研究P/O结果具有一定的重合性。
斑茅花粉活力低,平均花粉活性百分率仅为44.49%,该结果与雷敬超[26]连续7年对同一属的甘蔗花粉活力测定的结果相似。花粉离体后活力迅速下降,寿命约为3个小时,大大限制了花粉的传粉时间、距离和传粉效率,所以花粉的初始活力可能是影响斑茅自交结实率低的一个因素。花的寿命是植物繁殖的一个关键特征,它平衡了花粉的传播速度与花的维护成本。柱头可授性的时间长短对于植物花期来说是极为重要的,它对植物的授粉成功率和结果有一定的影响[27-28]。柱头可授性结果显示斑茅柱头在开花前就具有柱头可授性,且柱头可授性时间长,比同一属的甘蔗柱头可授性时间略短[29]。这一结果与赵元杰等[22]对芒的花粉寿命与柱头可授性结果相一致。它弥补了花粉离体后活力迅速下降这一劣势,对异花传粉植物的传粉成功率有一定的影响[30-31],不是影响斑茅有性生殖的限制因素。
本研究对斑茅居群的异交率进行了评估。统计交配系统参数时,Ritland和Jain[24]认为多数情况下采用3~6个共显性位点即可得到准确的结果,我们比较了采用6个位点和11个位点统计斑茅异交率,结果发现两种情况下异交率相差不大。这一结果与孙小涵等[32]采用3个位点与9个位点统计荆条的异交率结果相似。双亲近交系数(tm—ts)反映了双亲自交的程度,斑茅异交率处于较高水平(tm=0.853),tm—ts>0,表明斑茅居群存在自交。这一结果可能与斑茅的居群密度、风力和花期不完全同步,先开花的植株未能更多地接受异源的花粉有一定联系[33-34]。斑茅多位点异交率相关系数较大(rt=0.445),亲本近交系数F>0,说明在该斑茅居群中异交占较大优势,且和随机交配相比,近交会产生较多的纯合子[35]。Tm>(1—F)/(1+F)表明斑茅种群偏离哈迪-温伯格平衡,导致其偏离的原因可能与近交、气候、单株密度、营养繁殖等有关[36]。不同斑茅家系也都具有较高的异交率,但异交率水平存在较大差异(tm=0.601~1.200),这可能是亲本的自交可育程度,花粉的活性,资源圃中的位置以及其材料来源生境所致。
综合花粉与胚珠比P/O、杂交指数、斑茅传粉特征及交配系统结果,本研究初步认为斑茅的繁殖特性为异交为主,自交为辅的兼性异交模式。

