白藜芦醇对环磷酰胺诱导的人精子氧化损伤的保护作用
乜照燕,张亚楠,花 蕊,陈丽君,李 亮,吴海峰
(1.河北医科大学第四医院生殖医学科,河北石家庄 050011;2.河北医科大学组织胚胎学教研室,河北石家庄 050010;3.河北省胸科医院医学检验科,河北石家庄 050061)
环磷酰胺(Cyclophosphamide,Cy)是一种抗肿瘤药物,常用于治疗各种恶性肿瘤及自身免疫性疾病。Cy的生殖系统毒性越来越受到人们重视。已有研究显示Cy可以造成雄性生殖系统损害[1]。动物模型研究显示Cy可以导致大鼠睾丸和附睾组织发生病理学改变[2]。白藜芦醇(Resveratrol,RES)是一种天然多酚类物质,主要存在于虎杖、葡萄和红酒中[3]。RES具有多种生物学活性如抗肿瘤、抗炎、抗氧化等,成为目前体外和体内研究的热点[4]。有研究发现RES通过激活沉默调节蛋白1(Sirtuin1,Sirt1)保护造血细胞免受放疗诱导的损伤[5]。还有研究发现RES可以保护放疗诱导的肠道损伤[6]。鉴于此,RES对化疗药物诱导的生殖细胞损伤是否有保护作用尚待研究。此外,Cy属于前体药,需在体内完成代谢才能发挥作用,其活性代谢产物4-过氧化氢环磷酰胺(4-Hydro-peroxy Cyclophosphamide,4-HC)可直接作用于细胞[7]。鉴于此,本研究选用4-HC作为体外毒性药物,研究RES在改善化疗导致精子损伤的保护作用及可能机制。
1 材料与方法
1.1 研究对象收集2018年1月至2018年4月河北医科大学第四医院生殖医学中心就诊患者的正常精液标本。年龄25~34岁,健康状态良好,以女方输卵管因素就诊,无高血压、糖尿病等基础疾病,性功能状态正常,实验参与者均签署知情同意书。患者禁欲3~7 d,采用手淫法取精液,获取全部精液于干净容器,立即送精液检查室,在室温下精液完全液化后,依据世界卫生组织人类精液实验室检验手册第5版进行各项精液参数分析[8],收集正常精液标本用于后续实验。
1.2 方 法
1.2.14-HC诱导精子细胞毒性作用浓度和RES保护作用浓度的选择 取正常精液标本进行密度梯度离心后,调整精子浓度为20×106/mL,处理后精液每份取0.1 mL,加入终浓度(0、1.0、2.5、5.0、7.5 μmol/L) 4-HC (Cayman,19527)继续培养24 h,每组设5个标本,24 h后计数精子活力,伊红苯胺黑染色计数精子存活率,选择4-HC适合作用浓度。选用不同浓度(5、10、25、50、75 μmol/L)RES(VETEC,900386-5G)预处理2 h后,再加入按上述已确定的半抑制浓度(50% inhibiting concentration,IC50)4-HC,继续培养24 h,每组设5个标本,24 h后计数精子活力,伊红苯胺黑染色确定精子存活率,确定RES保护作用浓度。
1.2.2实验分组确立4-HC诱导的精子细胞的毒性作用浓度和RES保护作用浓度后,将本实验研究分为4组:①对照组(CON),精子不加任何药物在培养液中培养24 h;②单纯RES组,精子在含50 μmol/L RES(RES浓度按1.2.1确定)培养液中培养24 h;③4-HC组,精子在含2.5 μmol/L 4-HC(4-HC浓度按1.2.1确定)培养液培养24 h;④RES+4-HC组,50 μmol/L RES培养液预处理2 h后,加入2.5 μmol/L 4-HC继续培养24 h。分别取上述4组标本检测精子活力、精子活率、精子氧化应激水平和精子凋亡水平。
1.2.3精子活力、活率测定精子活力测定采用WHO 《人类精液及精子-宫颈黏液相互作用实验室检验手册》第5版要求。精子活率采用伊红-苯胺黑染色。使用移液器头吸取10 μL各组处理后精液于干净EP管内,吸取10 μL伊红-苯胺黑溶液在EP管内充分搅拌混匀,静置60 s。滴加上述混合液10 μL于载玻片上,制成涂片,室温自然干燥后于×100油镜下观察。用血细胞计数器来计数染色(膜不完整,淡红色)和不染色(膜完整,白色)细胞的数目。为了达到可接受的低样本误差,每张玻片评估200个精子。
1.2.4氧化应激指标测定精液微量丙二醛(Malondialdehyde,MDA)精子膜脂类过氧化反应的程度以反应产物MDA表示,MDA测定采用硫代巴比妥酸比色法,采用南京建成生物工程研究所生产的试剂盒测定。取待测精液0.1 mL为测定管,并设测定空白管、标准管及标准空白管,按照说明书操作,分别加入相应试剂,450 nm处BioTek酶标仪测定。超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)按试剂盒说明进行检测,取各组精子悬液,按照说明书操作,分别于550 nm和412 nm BioTek酶标仪测定。
1.2.5精子凋亡测定将上述处理后的精子悬液加入磷酸盐缓冲液(phosphate buffer saline,PBS)离心洗涤2次,离心后取精子沉淀100 μL放入试管中,加入FITC-AnnexinV 10 μL和PI 5 μL染色,室温下避光静置15 min后加400 μL孵育缓冲液,1 h内流式细胞仪测定结果。每次检测至少5 000个精子。采用前向散射/侧向散射设门来排除细胞碎片和细胞聚集的干扰。先通过散射光信号分选精子与细胞碎片,然后再在双变量荧光信号散点图上区分出活细胞、死亡细胞与凋亡细胞。激发波长为488 nm,绿色荧光(480~530 nm)采用FL1通道检测,红色荧光(580~630 nm)采用FL2通道检测,阳性细胞比率和平均荧光强度采用CellQuest软件进行分析。
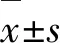
2 结 果
2.1 4-HC导致精子活力和存活率下降不同浓度4-HC(0、1.0、2.5、5.0、7.5 μmol/L)处理精子24 h后。结果显示:与对照组比较,随着4-HC浓度的增加,精子活力和活率逐渐降低,呈剂量依赖关系,差异有统计学意义(P<0.05,表1)。按给药浓度IC50标准,选择2.5 μmol/L 4-HC为后续实验给药浓度。
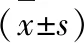
表1 4-HC对精子活力和活率影响
2.2 RES改善了4-HC导致的精子活力和活率下降
为了研究RES对4-HC诱导精子活力和活率的改善作用,加入4-HC前使用不同浓度的RES预处理,24 h检测精子活力和活率。结果显示:随着RES作用浓度的增加,精子的活力和活率逐渐增加;RES浓度达50 μmol/L时,精子的活力和活率显著升高,与2.5 μmol/L 4-HC组相比,差异有统计学意义(P<0.05),上述结果提示RES预处理能改善4-HC诱导的精子损伤。在RES浓度为50 μmol/L时效果最佳,选择50 μmol/L为后续实验药物浓度(P<0.05,表2)。
2.3 RES改善4-HC导致精子氧化应激对各组氧化应激水平进行分析,结果显示,4-HC组精子MDA水平增高,SOD、GSH-Px酶活性显著下降,与对照组相比差异具有统计学意义(P<0.05)。在RES+4-HC组,MDA水平降低,SOD、GSH-Px酶活性升高(P<0.05),与4-HC组相比,差异具有统计学意义(P<0.05)。由此可见,RES预处理降低了4-HC诱导的精子氧化应激产物产生,增强了抗氧化酶活性,起到保护精子的作用。
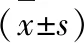
表2 RES预处理对4-HC诱导精子活力和活率的影响
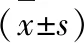
表3 RES预处理对4-HC诱导精子氧化应激水平的影响
2.4 RES改善了4-HC诱导的精子凋亡对各组精子进行流式细胞仪凋亡检测,结果显示,4-HC组精子凋亡情况(42.6%),与对照组(6.8%)比较,差异有统计学意义(P<0.05),RES+4-HC组精子细胞凋亡率明显降低为14.0%,与4-HC比较,差异有统计学意义(P<0.05),RES预处理改善了4-HC诱导的精子凋亡(图1)。
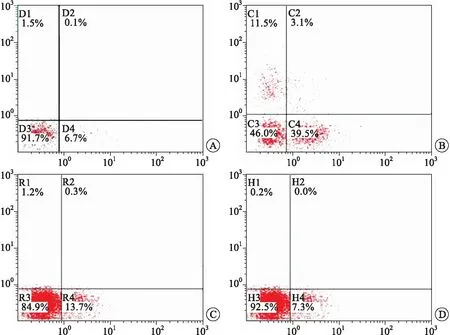
A:对照组;B:4-HC组;C:RES+4-HC组;D:RES组。
3 讨 论
近年来,随着恶性肿瘤年轻化的趋势,探寻化疗前保护性腺功能、减少性腺损伤或化疗后提高生育力的补救治疗显得尤为重要。精准医疗、化疗方案改善、现代手术方式改进以及精子和睾丸组织保存、辅助生殖技术的大力发展,使更多肿瘤患者能够生育后代。目前,上述措施各有利弊,尚需进一步探寻新的保护肿瘤患者生育力的方法。
研究认为多数化疗药物会影响生育,约50%男性患者在化疗结束后会出现少弱精子症,其中烷化剂和铂类化疗药物对生育力影响最大[9]。氧化应激损伤是化疗药物导致性腺损伤的原因之一。抗氧化剂应用可以减弱氧化应激对精子的损伤。刘波等[10]研究发现通过提高抗氧化能力可以改善Cy致精子浓度减少和活力降低的情况。李杜娟等[11]在灌注Cy小鼠的实验中,抗氧化剂维生素E组通过提高抗氧化酶水平改善了Cy诱导的睾丸组织损伤。RES由于其化学结构中存在酚羟基,能有效清除羟基和过氧化物,防止细胞膜脂质过氧化和活性氧对DNA的损伤[12]。RES能够激活体内抗氧化酶系统SOD、CAT等酶活性,具有细胞内抗氧化活性的功能[13]。目前有一些研究证实RES在体外氧化应激环境中对精子有一定的保护作用。王莉莉等[14]在精子优选过程中加入RES,结果发现RES显著降低了精子优选过程中活性氧(reactive oxygen species,ROS)的含量。此外,RES通过降低精子氧化应激水平,改善了氧化剂导致的精子膜完整性破坏并且增加了精子活力和受精能力[15]。但RES对化疗药物导致的精子损伤是否有保护作用尚未见报道。本研究首先采用Cy构建精子损伤模型,结果显示,随着4-HC浓度增加,精子活力和存活率下降,在2.5 μmo1/L时精子活力下降至52.2%,根据药物浓度选择的IC50原则,将2.5 μmo1/L 4-HC作为后续研究浓度。RES+4-HC组,随着RES浓度升高,精子活力得到提升,50 μmol/L RES对精子改善效果最佳,选择50 μmol/L为后续实验药物浓度。
氧化应激可以造成精子结构和功能损害,是导致男性不育的主要原因[16]。本研究进一步评估了氧化应激产物MDA和抗氧化酶GSH-Px、SOD酶活性的变化,MDA是氧化应激损伤过程中产生的主要氧化应激产物之一,对精子细胞有明显损伤作用,是引起不育的常见代谢产物[17]。
本研究结果显示,4-HC组MDA水平显著上升,GSH-Px、SOD酶活性显著下降。ROS破坏线粒体呼吸功能,降低线粒体膜电位,导致能量生成障碍使得精子活力进一步下降[18]。高水平的ROS可损害线粒体膜,引起细胞色素C释放触发细胞凋亡[19]。本研究显示4-HC组精子活力、存活率下降,流式细胞仪检测精子凋亡增加。我们推测4-HC诱导精子产生过量的氧化应激反应,导致精子发生高氧化应激损伤,高浓度的ROS破坏精子线粒体的结构和功能,导致精子活力减弱,也加速生殖细胞的凋亡过程。本研究发现RES预处理组GSH-Px、SOD氧化酶酶活性增加,MDA水平降低,RES组精子活力和活率得到改善,精子凋亡降低。在RES组,MDA水平显著下降,GSH-Px、SOD酶活性上升。精子活力、存活率得到提高,流式细胞仪检测精子凋亡降低。由此可见,RES抵抗了过度氧化应激对精子的损伤作用,从而改善了4-HC诱导的精子损伤。在一些其他体外研究中发现RES可以增强细胞的抗氧化功能,可以保护细胞免受氧化应激损伤而延缓细胞死亡[20]。RES预处理通过抗氧化改善了4-HC诱导的精子损伤。
综上所述,本研究为临床肿瘤治疗中应用化疗药物的男性生育力保护提供了一定的依据。未来研究将进一步阐明RES改善化疗药物对精子的损害机制和RES应用安全性的问题。

