兔源奇异变形杆菌的分离鉴定及耐药基因检测
廖娟 石英子 冯丹妮 王钢 喻世刚 杨子艺 梁梓


摘要:对腹泻死亡的兔肠道中分离得到的1株疑似病原菌进行鉴定及其耐药基因检测,并对分离菌进行了革兰氏染色、生化鉴定、16SrRNA基因序列分析,确定分离菌株为奇异变形杆菌,将其命名为T2019。将分离菌株与NCBI中10株已登录的标准菌株进行同源性比对,并用MEGA软件构建系统进化树,证明T2019与多种不同来源的奇异变形杆菌亲源性较近。药敏试验结果以及PCR体外扩增技术对相关耐药基因表型检测结果表明,T2019除对米诺环素和氯霉素表现为敏感,对四环素和多西四环素表现为中介以外,对其他所试抗生素均表现为耐药。检出耐药基因tetB、ant(3″)-I、strA和sul2,其他所试耐药基因未检出。这为奇异变形杆菌引起兔疾病诊断及合理使用常规抗生素药物提供科学依据。
关键词:兔;奇异变形杆菌;分离;鉴定;耐药基因
中图分类号:S852.61文献标志码:A
文章编号:1002-1302(2021)04-0125-05
作者简介:廖娟(1990—),女,四川乐山人,硕士,实验师,主要从事家禽肠道微生物研究。E-mail:lsliaojuan@163.com。
通信作者:王钢,硕士,教授,主要从事养殖业废弃物处理与资源化利用研究。E-mail:1274898363@qq.com。
奇异变形杆菌(Proteusmirabilis)是一种无荚膜、无芽孢,性状多为短杆菌的革兰氏阴性菌,是一种常见的人畜共患病原菌[1-2]。该菌广泛地分布于自然界中,可引起食物中毒、腹泻、化脓性炎症以及败血症等[3-4]。近年来,养殖业中被奇异变形杆菌感染的报道激增,如鸡[5]、鹅[6]、孔雀[7]、牛[8]、水貂[9]、山羊[10]、狐狸[11]、猪[2]等动物在感染该致病菌后会表现出很多发病症状,最明显的有厌食、神情低落、畏寒、腹泻、扎堆、流产,在短期内急速死亡,对养殖业造成了严重的经济损失。近些年来,养殖场抗生素类药物加剧使用以及不规范使用,甚至滥用,导致致病菌对抗生素类药物的耐药性与日俱增,生物体内致病菌通过异化而产生的耐药基因也越来越多。添加抗生素类药物耐药基因,就会加大致病菌对于不同抗生素的耐药概率,给养殖业动物的饲养及临床治疗造成了巨大的挑战。
在2019年夏季,四川省峨眉山市某养殖场出现大量幼兔发病,主要症状为精神萎靡、食欲不振、黄色瓢性稀便,在1周内死亡。对该养殖场病死兔进行解剖,病死兔經解剖多数可见肝脏及肾脏出血肿大、肺部有出血点。取病变组织进行细菌分离鉴定、生化试验,再通过测定16SrRNA基因序列并构建系统进化树分析同源性,确定分离出1株奇异变形杆菌,并对其进行药敏试验及耐药基因检测,以期在分子水平上为奇异变形杆菌引起的兔病变死亡的诊断及治疗提供案例分析和参考依据。
1材料与方法
1.1被检材料
本试验所用的病料来自峨眉山市某养殖兔场。
1.2主要试剂
普通营养琼脂、营养肉汤培养基、血琼脂培养基、麦康凯培养基、细菌生化鉴定管、药敏片等,均购自杭州微生物试剂有限公司。PCR相关试剂、细菌DNA提取试剂盒、DNA凝胶回收试剂盒等,均购自天根生化科技(北京)有限公司。
1.3主要仪器
Motic光学显微镜(麦克奥迪实业集团有限公司);超净工作台、立式电热压力灭菌锅(青岛海尔股份有限公司);全温空气摇床、恒温培养箱(上海龙跃仪器设备有限公司);PCR仪、电泳仪[美国SelectBioProducts(SBP)公司];凝胶成像系统(德国耶拿分析仪器股份有限公司)。
1.4细菌分离与革兰氏染色
用接种环无菌挑取病变组织,接种于普通营养琼脂培养基上,37℃培养24h,挑取疑似菌落进行纯培养,再挑取优势单个菌落分别接种于普通营养琼脂培养基、麦康凯培养基和血琼脂培养基上,观察记录疑似菌在不同培养基上的生长情况。挑取纯培养物涂片后,进行革兰氏染色,并在显微镜下观察细菌的形态。
1.5生化试验
将普通营养琼脂培养基上的纯培养物分别接种于细菌微量生化管中,37℃培养24h后,观察记录结果。
1.6药敏试验
将分离得到的菌株,采用国际通用的K-B纸片法[12],对每一种所试抗菌药物进行体外敏感药物筛选试验。结果参照美国临床和实验室标准协会(ClinicalandLaboratoryStandardsInstitute,简称CLSI)制定的抗菌药物敏感性试验执行标准进行判定。
1.716SrRNA基因扩增及序列测定
挑取已纯化的菌落,接种于普通肉汤液体培养基上进行扩大培养,直至肉眼可见试管中菌液浑浊即增菌完成,收集菌液进行离心。使用细菌DNA提取试剂盒提取分离菌株基因组DNA。PCR扩增参考通用引物序列:rmtc-F,5′-[JP9]AGAGTTTGATCMTGGCTCAG-3′;rmtc-R,5′-[JP9]AAGGAGGTGAGCCAGCCGCA-3′。
PCR反应体系为25μL体系:2×TaqMix12.5μL,上、下游引物各1μL,DNA模板1μL,ddH2O9.5μL。PCR反应条件:94℃预变性10min;94℃变性30s,55℃退火30s,72℃延伸1min,共30个循环;72℃延伸10min,4℃保存。
取5μLPCR产物进行1.2%琼脂糖凝胶电泳检测,用DNAmarker作为参照。电泳成功后将胶体放入凝胶成像系统中进行观察,切下目的条带做胶回收试验,参照DNA凝胶回收试剂盒说明书进行操作,胶回收完成后将回收的目的条带送往北京擎科生物科技有限公司成都分公司测序。
1.816SrRNA系统进化树的构建
将分离菌测序结果进行拼接编辑,再与NCBI数据库中公布的10种不同来源的变形杆菌(表1)进行BLAST(basiclocalalignmentsearchtool)比对,用DNAStar软件进行同源性分析,应用Mega7.0软件构建16SrRNA系统进化树,确定分离菌株的种属。
1.9耐药基因检测
1.9.1引物設计
参照文献[13-17],并自行依据引物设计原则(引物长度为15~30bp/18~27bp,不得超过38bp,且GC含量为45%~55%最好)分别设计合成3种常见的广谱抗生素类药物引物,所有耐药基因的引物序列、体外扩增产物长度及退火温度见表2。
1.9.2耐药基因PCR检测
以分离菌的基因组DNA为模板,用不同耐药基因的引物进行PCR扩增。其反应体系和反应循环条件参照“1.6”节(不同的引物具有不同的退火温度见表2)。PCR反应结束后进行琼脂糖凝胶电泳检测,凝胶成像系统观察记录结果。
2结果与分析
2.1细菌分离与革兰氏染色
从病变组织中分离出了1株具有共性且具有鉴定意义的菌株,将该分离菌株命名为T2019。它在普通营养琼脂培养基上呈圆形、灰白色,有腐败臭味,中间稍微突起,有透明的单个菌落;在麦康凯培养基上呈圆形、扁平、半透明、表面光滑的菌落;在血琼脂培养基上呈现无色菌落,无溶血现象。革兰氏染色镜检可见分离菌株多数为中等大小,以短杆状为主,大多单个存在,两端钝圆的革兰氏阴性细菌。结合菌落和菌体特征,初步判定分离菌T2019疑似为奇异变形杆菌。
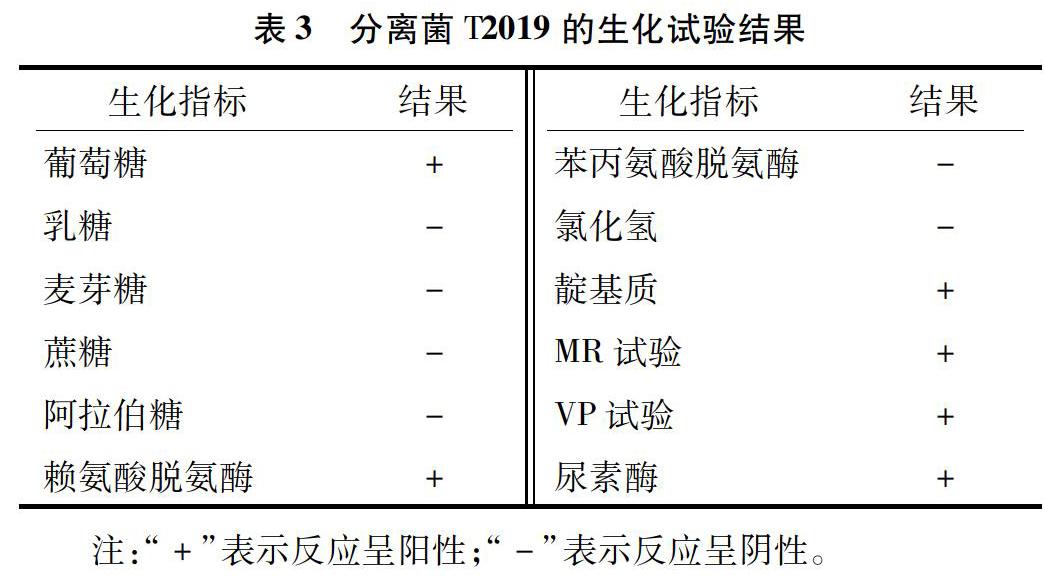
2.2生化试验
生化试验结果见表3,根据《伯杰氏鉴定细菌学手册》,分离菌T2019的生化鉴定结果与奇异变形杆菌基本一致。
2.3药敏试验
由表4可知,分离菌T2019除对米诺环素和氯霉素表现为敏感,对四环素和多西四环素表现为中介以外,对其他所试抗生素均表现为耐药。
2.416SrRNA基因PCR扩增
扩增结果见图1,得到1条清晰的、大小约为1500bp的条带,与可查证的奇异变形杆菌的特异性条带大小接近,与预期结果相符。
2.516SrRNA同源性比对和遗传进化分析
结果(表5、图2)显示,分离菌株T2019与发表的菌株NCTC11938(GenBank登录号为MN326692.1)同源性最接近,高达100%,NCTC11938菌株是从印度的动物懒熊粪便中分离得来,鉴定为奇异变形杆菌,由此从分子水平上可将分离株T2019确定为奇异变形杆菌。
2.6耐药基因的检测结果
耐药基因经PCR检测后,ant(3″)-I、strA、sul2和tetB基因电泳检测结果片段大小与预期片段大小一致;除此之外,其他所试耐药基因均未检出(图3至图5)。
3讨论与结论
奇异变形杆菌病是近些年在动物中多发的急性细菌性传染病,发病率主要集中在猪、鸡、羊等家禽中,兔感染奇异变形杆菌的报道较为少见。本研究从腹泻死亡的幼兔肠道中分离得到1株疑似病原菌进行鉴定,对分离菌进行了革兰氏染色、生化鉴定、16SrRNA基因序列分析,最终确定分离菌株为奇异变形杆菌。奇异变形杆菌为多种动物易感的致病菌,对于不同种群和不同习性的动物感染后的临床表现有所差异,在哺乳动物中常见腹泻、肺炎等症状。近年有新研究发现,感染奇异变形杆菌可导致动物流产,但目前仅见于少数动物,如狐狸[18]。
奇异变形杆菌的主要毒力因子包括鞭毛、菌毛、尿素酶等,该菌的鞭毛有利于其在普通细胞中定植,在感染动物机体时,首先附着于机体防御较弱的部位以及伤口处进行大量繁殖,通过分泌特定蛋白来破坏细胞表面,进而进入细胞内部,开始分泌大量致病因子,毒力因子与受染细胞结合使细胞正常功能改变,最终侵害动物机体[1]。
近年来,由于抗生素的大量滥用,大量致病菌都表现出对相应药物的耐药性,奇异变形杆菌也不例外,其对多种抗生素表现出高度耐药性。在养殖业中,商户大都偏爱在饲料中添加抗生素,但抗生素的不规范添加会直接导致细菌变异产生耐药基因,各类饲料添加剂也会对致病菌的耐药性产生影响。在兽医临床中,抗生素的滥用导致原始剂量已无法达到治疗效果,必须加大剂量投入才能显示药效,这对养殖业大为不利,不仅增加了饲养成本,也将动物病程延长,影响动物生产性能,且使用大量的抗生素容易在动物体内积累,当动物排便或死亡后,抗生素重新堆积于土壤和污水中,对环境造成污染,且可能会有耐药基因二次传递的危险[19]。所以要想避免感染奇异变形杆菌对自身养殖业造成损失,最重要的方法在于如何防止细菌感染和传播,首先要确保养殖场的环境卫生,及时清理动物粪便,不要过度密集地养殖,保持通风,每周进行3~4次的全方位清洁并消毒,将动物放出棚外进行户外运动,保持身心愉悦;其次,注意饲料中抗生素的添加,按照相关说明规范合理地添加抗生素,切勿秉持多种类多数量的观念;最后,若养殖场出现患病动物,及时将其隔离,进行全面消毒,无害化处理患病动物的排泄物,防止对环境造成污染,制造疾病传播源。
参考文献:
[1]刘燕云,柴家前.奇异变形杆菌研究进展[J].中国兽医学报,2017,37(1):196-198.
[2]赵振鹏,杨振,林伟东.猪源奇异变形杆菌的分离鉴定及集群运动分析[J].中国畜牧兽医,2014,41(10):219-224.
[3]王晓松.一起由奇异变形杆菌引起食物中毒的调查[J].职业与健康,2008,24(13):83.
[4]朱明华,朱瑞良,马荣德,等.鸡奇异变形杆菌的分离鉴定和16SrRNA基因序列测定与系统进化分析[J].中国兽医学报,2011,31(6):804-808.
[5]徐睿,李颜桃.鸡源致病性奇异变形杆菌的分离鉴定与遗传进化分析[J].中国畜牧兽医,2018,45(9):2550-2558.
[6]王岩,尹珺伊,侯美如,等.鹅源奇异变形杆菌的分离鉴定及药敏试验[J].中国家禽,2017,39(23):56-59.
[7]李迎晓,焦凤超,潘志明,等.孔雀奇异变形杆菌的分离鉴定及遗传进化分析[J].畜牧与兽医,2016,48(5):79-81.
[8]曾邦权,段博芳,郑欢莉,等.牛奇异变形杆菌的分离鉴定及16SrRNA基因系统发育分析[J].中国畜牧獸医文摘,2018,34(4):77-79.
[9]王建科,程悦宁,易立,等.水貂奇异变形杆菌的分离鉴定及16SrRNA基因序列分析[J].中国畜牧兽医,2015,42(4):852-858.
[10]陈曦,王远微,王永.山羊腹泻粪便中奇异变形杆菌的分离鉴定及系统发育分析[J].中国畜牧兽医,2014,41(8):215-218.
[11]段二珍,夏平安,张凤华,等.狐狸奇异变形杆菌的分离与鉴定[J].中国兽医科学,2008,38(12):1050-1054.
[12]马越,李景云,金少鸿.美国临床实验室标准委员会推荐药敏试验操作方法和判断标准(2005年修订版)[J].中华医学杂志,2005(17):1182-1184.
[13]陈红梅,程龙飞,邓辉,等.鸭源多杀性巴氏杆菌对磺胺类药物的耐药性检测及耐药基因分析[J].中国畜牧兽医,2019,46(1):223-230.
[14]晏云涛,俸江琴,赵汝,等.猪源大肠杆菌对氨基糖苷类药物耐药性及耐药基因检测[J].江苏农业科学,2019,47(11):222-224.
[15]黄伟德,肖双燕,黎姗梅,等.广西凡纳滨对虾源副溶血弧菌耐药性和耐药基因的检测[J].西南农业学报,2018,31(9):1979-1988.
[16]杨明伟,韦慕兰,罗福广,等.罗非鱼源无乳链球菌对氨基糖苷类耐药性及耐药基因检测[J].西南农业学报,2018,31(11):2438-2444.
[17]杨艳,王厚照,张玲.多重耐药鲍曼不动杆菌氨基糖苷类修饰酶与16SrRNA甲基化酶基因的研究[J].微生物学杂志,2017,37(4):28-33.
[18]张萍,程悦宁,张海威,等.狐狸流产奇异变形杆菌的分离鉴定及特征分析[J].中国畜牧兽医,2019,46(11):3370-3377.
[19]边海霞,王学强,周云锋,等.鸡奇异变形杆菌的研究[J].兽医导刊,2017(4):189.

