乳鸽新城疫病毒的分离和鉴定
芮艺 徐洲 赵宝华


摘要:江苏某肉鸽养殖合作社饲养的乳鸽出现扭头等神经症状,死亡率高达65%,剖检可见脑部出血、颈部皮下出血、十二指肠出血。从病死乳鸽中采集病料,分离到1株鸽新城疫强毒株,病毒毒力测定其MDT为52h、ICPI为2.2,动物回归试验表明具有较高的致病力,基因测序其F基因型为ClassⅡ基因Ⅵb亚型。病理组织学研究发现,新城疫病毒会引起非化脓性脑炎和出血性坏死。研究结果为了解江苏地区乳鸽新城疫的发生、流行和组织损害提供了研究数据。
关键词:乳鸽;新城疫病毒;毒力;F基因型;病理组织学
中图分类号:S852.65+7文献标志码:A
文章编号:1002-1302(2021)04-0116-04
作者简介:芮艺(1967—),男,江苏泰兴人,副教授,主要从事动物疾病教学和科研工作。E-mail:13814423402@139.com。
通信作者:赵宝华,硕士,研究员,主要从事禽病传染病研究工作。E-mail:yzzhaobao@126.com。
鸽新城疫,俗称鸽瘟,又称鸽Ⅰ型副黏病毒病,是鸽的重要传染病。该病危害极大,鸽群常突然发病,蔓延迅速,具有发病快、流行期长、发病率和死亡率高的特点,病死率一般为30%~80%,严重时,死亡率可达95%以上[1]。病鸽的康复时间较长,通常需要1月左右才逐渐康复,有些需要更长时间才能康复,部分患病鸽表现扭头等神经症状,从而丧失了其经济价值,损失严重[2]。
江苏徐州某肉鸽养殖合作社成员饲养2000多对肉鸽,2019年11月入冬后,其乳鸽不断地出现死亡现象,死亡的有7日龄小乳鸽,也有20多日龄[HJ1.8mm]大的乳鸽,起初死亡2~3只/d,成年鸽临床上未发现明显异常。1周后乳鸽死亡近10只/d;部分成年鸽拉稀,并出现零星死亡。解剖病死乳鸽,主要表现脑部出血,颈部皮下出血,十二指肠等肠道出血,少部分可见腺胃乳头、肌胃出血、泄殖腔黏膜出血。病死成年鸽脑部出血不明显,此病变与乳鸽的解剖病变有明显差异,但可见颈部皮下、腺胃乳头、肌胃和十二指肠出血[3]。
为此,本研究团队从病死乳鸽中采集病料,分离到1株鸽新城疫病毒,进行了鸽新城疫病毒毒力测定,对新城疫病毒F基因测序,开展了病理组织学研究,以期为了解江苏地区乳鸽新城疫的发生、流行和组织损害提供数据支撑。
1材料与方法
1.1材料
1.1.1病料无菌采集江苏徐州某肉鸽养殖合作社病死乳鸽的脑组织,冻存备用。
1.1.2试验鸡胚SPF鸡蛋购自北京梅里亚维通实验动物技术有限公司,扬州大学实验室孵化至10日龄鸡胚供使用。
1.1.3试剂新城疫病毒标准阳性血清(生产批号20190508)、产蛋下降综合征病毒阳性血清(生产批号20190308)和H5、H7、H9亚型禽流感病毒阳性血清(生产批号分别为20190522、20181206、20191116),购自哈尔滨国生生物科技股份有限公司;TRIzol,购自Invitrogen公司;AMV反转录酶、RNA酶抑制剂、ExTaq酶、pMD18-T、感受态细胞DH5α,均购自宝生物工程(大连)有限公司;DNA回收试剂盒,购自OMEGA公司[4]。
1.1.4未免疫鸽未免疫鸽,购自扬州市绿杨畜禽养殖专业合作社,扬州大学实验动物房饲养供试验用。
1.2方法
1.2.1病毒的分离和鉴定
1.2.1.1病毒分离2020年3月23日于扬州大学生物安全三级实验室,取出无菌采集病死乳鸽的脑组织病料,将病料剪成小块,置于研磨器内磨碎,用生理盐水将病料按1∶5稀释制成组织混悬液,经3次冻融后,置离心机中以5000r/min离心10min,取上清,加入“双抗”(含青霉素1000mg/mL和链霉素1000mg/mL),室温作用4h。取处理好的病料上清液,经尿囊腔接种10日龄的SPF鸡胚,每枚0.2mL,用蜡封孔,置于37℃继续孵化,弃去24h死亡的鸡胚。24h后每2h照蛋1次,收取死亡的鸡胚,置4℃冰箱,4h后无菌收集其尿囊液[4]。
1.2.1.2微量血凝试验和血凝抑制试验
血凝抑制(HA)试验和血凝抑制(HI)试验按常规微量方法。2020年4月26日于江苏省家禽科学研究所实验室,对收获的尿囊液进行HA试验,对HA阴性者盲传3代。经检测,对具有血凝性的鸡胚尿囊液,再用抗新城疫病毒标准阳性血清、产蛋下降综合征病毒阳性血清和H5、H7、H9亚型禽流感病毒阳性血清进行HI试验[4]。
1.2.1.3病毒毒力测定
2020年5月11日于揚州大学生物安全三级实验室,采用世界动物卫生组织(OIE)规定的方法测定分离病毒的鸡胚最小致死量平均死亡时间(MDT)和1日龄鸡脑内接种致病指数(ICPI)[5]。
1.2.1.4动物回归试验
2020年5月21日于扬州大学实验动物房隔离器,分别以0.1mL的分离毒株第3代种毒液对10羽1月龄未免疫的鸽进行肌肉注射,观察20d,记录发病和死亡情况,未发病的鸽则采血检测新城疫抗体[6]。同时设置未攻毒的未免疫鸽10羽作为对照,观察记录,采血检测新城疫抗体。
1.2.2引物的设计
根据GenBank中收录的数百条NDVF基因序列[7],用Primer5.0自行设计扩增NDVF基因部分片段的引物,P1:5′-[JP9]AGGATCCTTGGGTCTACAGGTAACTC-3′;P2:5′-[JP9]AAAGCTTGTTCGTTCCTCATCTGTGTTC-3′。引物交生工生物工程(上海)股份有限公司合成。
1.2.3RT-PCR
按照TRIzol试剂盒的说明对第3代分离毒株的尿囊液进行病毒RNA的抽提,加入适量的DEPC水溶解。在PCR管中加入RNA9.5μL,10mmol/LdNTP2μL,10×RTbuffer2μL,AMV反转录1μL,RNA酶抑制剂0.5μL,随机引物1μL,加灭菌去离子水至20μL,混匀,室温下作用10min,接着42℃水浴1h,即为第一链cDNA,以反转录产物为模板进行PCR。PCR反应体系为:反转录产物2μL,5×RTbuffer5μL,10mmol/LdNTP2μL,20μmol/L的上下游引物各1μL,Ex-Taq0.25μL,加灭菌去离子水至25μL。反应条件:94℃2min;然后94℃30s,59℃30s,72℃1min,30个循环;最后72℃延伸10min,取5μL反应产物在1%琼脂糖中电泳进行检验[8]。
1.2.4连接、转化和产物的测序
按照DNA凝胶回收试剂盒说明回收PCR产物,按照pMD18-T载体试剂盒说明进行连接,16℃连接过夜。将连接产物转化感受态细胞DH5α,均匀涂布在含氨苄青霉素的LB固体培养基上,37℃培养18h后,挑取大小合适的白色单菌落进行培养。将菌液PCR阳性者送上海华大基因科技股份有限公司测序。
1.2.5病毒F基因片段的序列分析
利用DNASTAR5.0软件分析测序结果,并翻译F基因裂解位点氨基酸序列。对F基因核苷酸序列进行同源性分析,并将F基因片段序列与GenBank中收录的NDV毒株绘制系统进化树;分析F基因裂解位点区(112~117)氨基酸序列特征。通过对F基因分型相关序列的生物遗传进化分析进行基因分型[9]。
1.2.6病理组织学研究
2020年3月23日于扬州大学生物安全三级实验室,采集病死乳鸽的脑、肺、肝、肠、脾组织器官,浸泡于10%福尔马林溶液中,按常规病理切片制作方法,按次序对其组织器官进行固定、脱水、浸泡包埋、切片、贴片、H.E染色和封片[10],放置高倍显微镜下观察。
2结果与分析
2.1病毒分离鉴定结果
从乳鸽脑组织中分离得到1株具有血凝性的病毒株,在鸡胚上传第3代后,鸡胚出现规律性死亡,死亡时间集中于48~60h。其第3代尿囊液HA效价为27,血凝性能被新城疫阳性血清所抑制,但不能被产蛋下降综合征及H5、H7、H9亚型禽流感阳性血清所抑制。经鉴定其为鸽新城疫病毒,称为鸽新城疫徐州毒株,命名为PPMV-1/Pigeon/XZ/CH/2019(简称XZ2019)。
2.2病毒毒力测定结果
试验表明,鸽新城疫徐州毒株的MDT为52h、ICPI为2.2,根据OIE推荐的毒力判定标准,可判定其为速发型新城疫病毒。
2.3动物回归试验结果
经注射鸽新城疫徐州毒株的10羽非免疫鸽,2d3羽发病,4d内全部发病。3d出现2羽死亡,4d死亡3羽,6d死亡4羽,其他存活至20d出现扭头等神经症状。检测未死亡鸽的血清,其NDV的HI效价达到25,表明鸽感染了鸽新城疫徐州毒株。对照组10羽非免疫鸽表现正常,20d采集鸽的血清,进行NDV的HI效价测定,均为0。
2.4鸽新城疫徐州毒株F蛋白基因序列及同性分析
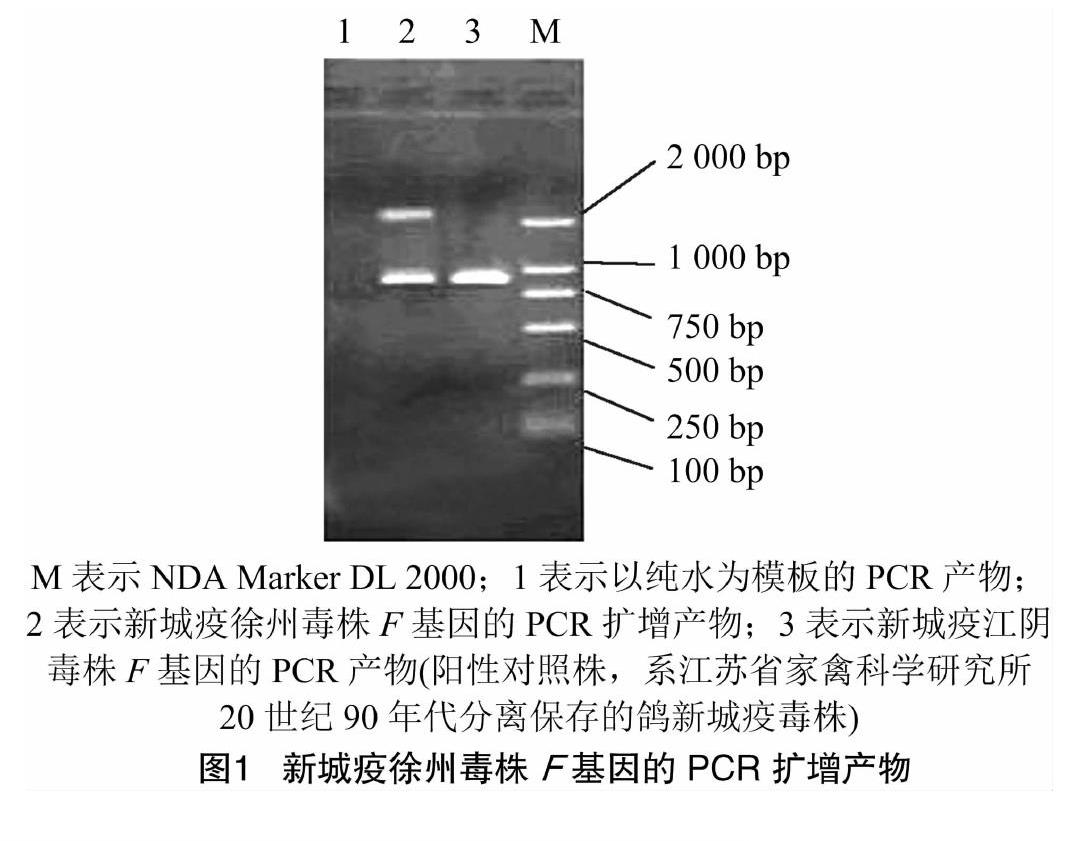
鸽新城疫徐州毒株F蛋白基因PCR扩增产物见图1。由图1可知,F蛋白裂解位点处的序列(112R-R-Q-K-R-117F)与新城疫强毒在这一区域的序列相符,与国内强毒F48E9株、疫苗毒LaSota株的核苷酸同源性分别为85.2%、80.0%,氨基酸同源性为83.6%、81.5%。经基因的遗传进化分析(图2)可知,鸽新城疫徐州毒株属于ClassⅡ基因Ⅵb亚型。
2.5病理组织学研究结果
通过病理切片观察(图3)可知,鸽新城疫病毒能引起非化脓性脑炎,坏死灶中心和周围有大量多核巨细胞、巨噬细胞和淋巴细胞浸润。由图4可知,脑组织内血管充血、水肿和出血,血管中层水肿变性,毛细血管和小动脉玻璃样变,小血管生成透明血栓及血管内皮细胞坏死;肠道黏膜绒毛脱落,出血性坏死。肝脏出现网状组织细胞增生,脾脏的皮质部和生发中心可见局灶性淋巴细胞的空泡形成和破坏,出现坏死性损害;肺组织损害不明显。
3小结与讨论
本研究从病死乳鸽脑组织中分离得到1株鸽新城疫病毒株,其MDT为52h、ICPI为2.2,动物回归试验及其F蛋白裂解位点处的序列测定,均表明鸽
新城疫徐州毒株为强毒株,对鸽尤其是乳鸽具有较强的致病力,与临诊表现相符。据绘制的基因遗传进化树,鉴定出该分离株为基因Ⅵ型,为国内常发生的病毒基因型毒株[11]。本结果提示我们在肉鸽生产上需加强对鸽城疫强毒株的防控,尤其需加强鸽场的卫生消毒工作,避免鸽新城疫强毒株的侵入,减少鸽场内的病原数量,降低鸽群的发病风险。
通过病理组织学观察,鸽新城疫病毒具有较强的嗜神经性,从而使乳鸽临床上出现扭头等神经症状。鸽新城疫病毒对神经系统的损害对乳鸽的危害尤其严重,由于鸽是晚成鸟,乳鸽出生后并不张眼,自身无法觅食,完全靠亲鸽哺喂,其脑部神经受鸽新城疫病毒侵袭而损伤后,造成乳鸽在哺食时抬头或举头困难,致使无法吃到食物,这可能是乳鸽发生鸽新城疫后死亡率较高的原因之一。
通过基因的遗传进化分析,鸽新城疫徐州毒株与目前国内流行株属于同一遗传分支,与弱毒疫苗株LaSota的遗传距离较远,提示需加强鸽新城疫专用疫苗的研制,并建议对乳鸽新城疫防制应尽量选择鸽新城疫专用疫苗,专用疫苗对鸽新城疫防疫将更有针对性,免疫效果也会更好,避免仅使用鸡新城疫弱毒LaSota株而影响免疫效果的问题[12]。另外,为有效预防乳鸽发生新城疫,生产上需加强对亲鸽的新城疫防疫工作,以提高乳鸽的母源抗体水平,提高乳鸽特异性抵抗力,避免乳鸽早期被新城疫病毒感染而造成较大的经济损失。
参考文献:
[1]赵宝华,戴鼎震,杨一波.鸽病防治图谱[M].上海:上海科学技术出版社,2017.
[2]SaifYM.禽病学[M].12版.北京:中国农业出版社,2016:82-99.
[3]孙桂芹.鸽Ⅰ型副黏病毒病(简称鸽瘟)的发生与防治[J].中国动物保健,2017,19(12):93-94.
[4]杨丽云,阮二垒,陈芳艳,等.1株肉鸽新城疫强毒的分离鉴定[J].中国畜牧兽医,2010,37(4):201-204.
[5]马玉峰,李敏,李琛,等.两株鸽Ⅰ型副黏病毒的分离与鉴定[J].中国家禽,2019,41(15):67-69.
[6]熊晓妍,孙兴臣,李敏婕,等.赛鸽新城疫病毒南京分离株的生物学特性及其F和HN基因的分析[J].中国兽医科学,2017,39(11):1363-1370.
[7]刘华雷,周斌,郁斌,等.五株鸽副黏病毒国内分离株F基因片段的克隆与分子特性[J].病毒学报,2004,20(4):378-381.
[8]李治,范俊清,李冉,等.信鸽新城疫病毒的分离、鉴定及F基因的进化分析[J].中国家禽,2018,40(8):56-59.
[9]张彦红,孙敏华.1株鸽新城疫病毒分离鉴定及分析[J].养禽与禽病防治,2018,40(8):17-21.
[10]郭亚男,马文才,何生虎.肉鸽神经系统病理组织病理学观察[J].黑龙江畜牧兽医,2016(176):286-287.
[11]李仕超,刘佩红,丁铲,等.六株鸽源新城疫病毒的分离、鉴定与生物信息学分析[J].中国动物传染病学报,2014,22(5):1-9.
[12]劉秀梵,胡顺林.新城疫病毒的进化及其新型疫苗的研制[J].中国兽药杂志,2010,44(1):12-18.

