胃癌全胃切除术后早期肠内营养支持的临床效果
毛一清 魏云海 朱云

[摘要] 目的 分析胃癌全胃切除術后早期肠内营养支持的临床效果。 方法 选取2017年9月至2019年7月我院收治的胃癌全胃切除术患者68例,随机分为研究组和对照组,每组各34例。对照组采用完全肠外营养支持,研究组采用早期肠内营养支持,观察比较两组患者的临床效果、肛门排气时间、排便时间以及住院时间;并比较两组治疗过程中发生的不良反应。 结果 研究组患者总有效率为91.18%,明显高于对照组的73.53%,差异有统计学意义(P<0.05);研究组患者肛门排气时间、排便时间及住院时间均明显短于对照组,差异有统计学意义(P<0.05);研究组患者不良反应总发生率为5.88%,明显低于对照组的17.65%,差异有统计学意义(P<0.05)。 结论 胃癌全胃切除术患者经早期肠内营养支持效果理想,能缩短住院时间,降低不良反应发生的可能性,可有效增强治疗效果,临床上应进一步推广使用。
[关键词] 胃癌;全胃切除术;早期;肠内营养支持
[中图分类号] R735.2 [文献标识码] A [文章编号] 1673-9701(2021)06-0017-03
The clinical effect of enteral nutrition support in the early stage after total gastrectomy for gastric cancer
MAO Yiqing1 WEI Yunhai2 ZHU Yun3
Department of Gastrointestinal Surgery, Huzhou Central Hospital in Zhejiang Province, Affiliated Center Hospital of Huzhou Teachers College, Huzhou 313000, China
[Abstract] Objective To analyze the clinical effect of enteral nutrition(EN) support in the early stage after total gastrectomy for gastric cancer(GC). Methods A total of 68 patients admitted to and treated in our hospital from September 2017 to July 2019 that underwent total gastrectomy for GC were selected and randomly divided into the study group and the control group,with 34 patients in each group. The control group was received total parenteral nutrition support,while the study group was received EN support in the early stage. The clinical effect, the anal exhaust time, the defecation time and the hospitalization time between the two groups were observed and compared. The adverse reactions(ADRs) that occurred during the treatment between the two groups were also observed and compared. Results The total effective rate in the study group was 91.18%, which was significantly higher than that of 73.53% in the control group, with significant difference(P<0.05). The anal exhaust time, the defecation time and the hospitalization time in the study group were respectively significantly shorter than those in the control group, with significant difference(P<0.05). The total incidence of ADRs in the study group was 5.88%, which was significantly lower than that of 17.65% in the control group, with significant difference(P<0.05). Conclusion EN support in the early stage produces an ideal effect on the patients who have undergone total gastrectomy for GC. It can shorten the hospitalization time, lower the incidence of ADRs, and enhance the curative effect effectively. It should be further promoted and applied in clinical practice.
[Key words] Gastric cancer; Total gastrectomy; The early stage; Enteral nutrition support
胃癌属于消化道内常见恶性肿瘤之一。随着生活水平的不断提升,人们的生活方式及饮食习惯等发生了明显的变化,同时胃癌的发生率也随之升高,严重影响了人们的日常生活和工作[1]。临床上多应用全胃切除术对晚期胃癌患者实施治疗,但手术结束后,大多数患者会出现不同程度的营养不良症状,且患者在接受全胃切除术前需要进行较长时间的禁食。因此,必要的营养支持是促进患者早日恢复的重要方式。但长时间对患者实施肠外营养支持会导致其出现肠道黏膜萎缩及肠道功能紊乱等并发症,因此早期肠内营养比较适合肠道的正常生理过程,可有效促进肠道功能的恢复[2-3]。本研究分析胃癌全胃切除术后应用早期肠内营养支持的临床效果,现报道如下。
1 资料与方法
1.1 一般资料
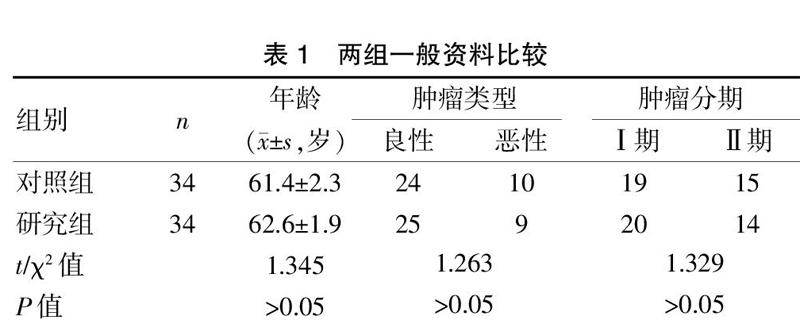
选取2017年9月至2019年7月我院收治的胃癌全胃切除术患者68例,随机分为研究组和对照组,每组各34例。其中对照组男18例,女16例,年龄42~73岁,平均(61.4±2.3)岁。研究组男21例,女13例,年龄41~74岁,平均(62.6±1.9)岁。纳入标准:①均有完整临床资料,且经诊断确诊为胃癌者;②对本研究知情且同意者;③未接受过放疗或化疗者;④手术前两个月内未服用过任何免疫类增强剂者;⑤心肺、肝肾以及脾功能正常者。排除标准:①实施胃癌手术后出现复发或转移者;②存在代谢性疾病及免疫系统疾病者;③凝血时间出现异常者。两组患者性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
表1 两组一般资料比较
1.2 方法
1.2.1 对照组 采用完全肠外营养(Total parenteral nutrition,TPN)支持。手术后第1天开始经中心静脉置管输入混合营养液,其热量为126 KJ/(kg·d),氮量为0.2 g/(kg·d),糖脂比2∶1,氮源来自复方氨基酸溶液,脂肪为30%脂肪乳剂,维生素、电解质和微量元素予以均衡配方,第 1 天输入速度为 50 mL/h,以后每天增加 10 mL/h。用输液泵控制速度和量,以后逐渐增加输入量,每天增加 150 mL/h,术后每天所需的营养供给能量为 6276 kJ。患者需持续使用7~10 d。
1.2.2 研究组 采用早期肠内营养(Early enteral nutrition,EEN)支持。手术前通过鼻腔插入营养管和胃管,在手术过程中将空肠营养管和胃管分开,空肠营养管插至最远端吻合口远端(输出段)30 cm空肠处。术后第1天滴入0.9%氯化钠注射液500 mL,第2天加用能全力(Nutricia公司,每500毫升含蛋白质20.0 g、脂肪19.5 g、糖61.5 g、纤维素7.5 g)500 mL,逐步加量直至1500~2000 mL输液泵匀速注入,患者需持续使用7~10 d[4-5]。
1.3 观察指标及评价标准
①临床疗效。采用电话随访方式对患者的临床治疗效果进行调查,比较分析两组患者的临床效果。疾病进展(PD):靶病灶最大径之和至少增加≥20%,或出现新病灶;疾病稳定(SD):靶病灶最大径之和缩小未达PR,或增大未达PD;部分缓解(PR):靶病灶最大径之和减少≥30%,至少维持4周;完全缓解(CR):全部靶病灶消除,没有新的病灶发生,且肿瘤标志物正常,至少维持4周。总有效率=(CR+PR+SD)例数/总例数×100%[6]。②比较两组患者的不良反应发生情况。③比较两组患者的肛门排气时间、排便时间以及住院时间。
1.4统计学分析
采用SPSS 20.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,组间比较采用t检验;计数资料以[n(%)] 表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组近期疗效比较
研究组患者总有效率为91.18%,明显高于对照组的73.53%,差异有统计学意义(P<0.05)。见表2。
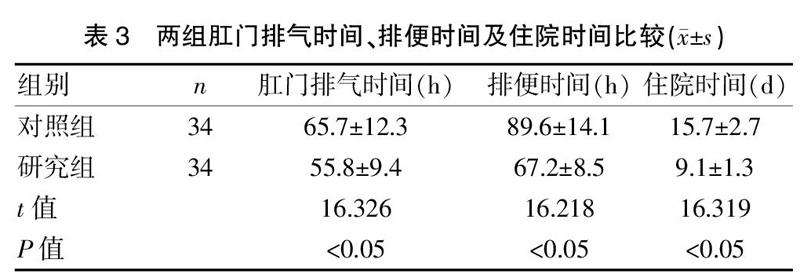
2.2两组肛门排气时间、排便时间及住院时间比较
研究组患者肛门排气时间、排便时间及住院时间均明显短于对照组,差异有统计学意义(P<0.05)。见表3。
2.3两组不良反应发生情况比较
研究组患者不良反应总发生率为5.88%,明显低于对照组的17.65%,差异有统计学意义(P<0.05)。见表4。
3 讨论
胃癌属于近年来被普遍提及的恶性肿瘤之一,其严重威胁着人们的生命安全,且临床上已认定癌症是影响人类身体健康及生命安全的重要原因,由于人们生活方式的不断变化,胃癌的发生率也不断提高。因而,临床上也对胃癌的提早诊断及治疗也愈加重视[7]。其中手术治疗作为治疗胃癌的重要方式之一,但大多数胃癌患者在入院接受治疗时其病情已进展至中晚期,需行全胃切除术,以此延长患者的存活期。胃癌切除术的实施虽然能挽救患者的生命,但由于人体胃肠道生理功能的复杂性,导致患者实施全胃切除术后会造成严重的疼痛,甚至会进一步加剧营养不良等症状的发生。因此,胃癌患者在接受全胃切除术治疗时,必定会对胃肠道功能产生影响,进而改变胃肠道对营养物质的吸收,严重影响患者术后肠道功能的恢复[8-9]。
营养不良作为恶性肿瘤患者治療期间发生较普遍的一种症状,在年龄较大的患者中尤为突出,老年患者本身由于病情的原因,在手术前就可能伴有严重的不良反应及免疫功能减退等状况,并因手术及创伤应激时机体产生的高代谢状态,会进一步加剧营养不良状况。合理的营养支持不但能参与机体免疫调控,提高机体免疫功能,还能促进组织修复及创口愈合,极大地降低并发症发生率,有利于患者尽快恢复。另外,胃癌患者多数伴有营养不良及免疫力低等状况,因而对患者实施早期营养支持具有关键作用[10]。
以前胃癌患者在手术结束后主要靠静脉输液来维持身体所需营养,也就是临床上所说的肠外营养。但长时间静脉输液,不仅加剧医疗负担,还会引发肠功能衰竭、肠细菌移位以及菌血症等并发症,并在许多腹部危重疾病中,若长时间应用肠外营养支持会损伤肠道屏障,继而使细菌及毒素发生移位,并进入人体血液循环中,导致人体重要器官组织出现损伤,威胁生命安全。有相关研究显示,消化道肿瘤手术后应用早期肠内营养支持可有效促进患者康复[11-13]。本研究结果显示,研究组患者的术后肛门排气时间、排便时间及住院时间均明显短于对照组(P<0.05),提示实施早期肠内营养支持具有较理想的效果,可进一步增强治疗效果,促进患者临床症状改善,进而有效缩短住院时间,有助于患者早日康复。分析原因为早期肠内营养的食物可以对肠道产生直接性刺激,可进一步促进胃肠道激素合成及分泌,并能有效调节人体内胆汁及胰液的分泌,从而尽快改善患者的肠道功能,使患者的营养状态得到合理调整。
传统观念认为,在术后给予一定的营养支持,可有效改善患者的胃功能,对于降低并发症发生率有关键作用。临床上实施全胃切除术的患者,在术后进行营养支持,主要包括肠外营养及肠内营养两类。从临床疗效来看,肠外可以为机体恢复提供充足的营养,但长时间采用肠外营养,可能会加速人体肠黏膜的萎缩,提高其通透性,从而导致免疫力低下,严重者还会出现肠源性败血病,给家庭造成巨大的经济压力[14-15]。肠内营养主要是指仅需少量消化过程或不需要消化过程就可以被人体吸收的营养液,经过消化道置管(或造口)及少量多次口服的方式,为患者提供机体必需的营养物质。临床上特制的营养粉包含各项人体所需的营养成分,且配方均衡,肠内营养在消化及吸收的过程中会增加胃肠道的血液供应,刺激内脏神经加快对消化道支配及消化道激素分泌,其不仅为全身及胃肠道本身供给各种营养成分,还可以有效保护胃肠道的正常菌群及免疫系统[16-17]。本研究结果显示,研究组总有效率明显高于对照组(P<0.05),提示早期肠内营养支持在一定程度上可以提高治疗效果,改善患者预后。与肠外营养相比,其肠内营养的优势在于:①可有效维持肠道屏障结构及相关功能,降低对肝功能的损伤,避免发生感染等并发症;②可以直接给人体提供必需的谷氨酰胺等营养素,减轻肠道内部发生细菌及毒素移位;③增强治疗效果,缩短住院时间,降低营养药品的花费,减轻医疗负担[18-20]。本研究结果显示,研究组不良反应总发生率明显低于对照组(P<0.05),提示应用早期肠内营养支持可有效降低不良反应的发生,改善患者机体营养状况,有助于恢复患者的胃肠道功能。总之,随着对营养支持认识的逐渐深入,可以发现全肠外营养支持可能会出现多种并发症,且营养供给也不全面,而肠内营养更加符合人体的生理要求,且实施起来更加简便,对促进胃肠道功能恢复,保持血糖稳定,维护肠道黏膜屏障,减少感染性并发症,改善机体营养状况也具有关键意义。
综上所述,胃癌全胃切除术患者经早期肠内营养支持效果理想,能缩短住院时间,降低不良反应发生的可能性,可有效增强治疗效果,临床上应进一步推广使用。
[参考文献]
[1] 陶小亮,姜淮芜,徐亮.全胃切除术后调节型双通道空肠间置代胃术重建消化道效果观察[J].山东医药,2017, 37(40):66-68.
[2] 梁丽芹,陈娟,胡雪梅.胃癌患者胃大部分切除术后感染与营养状态的相关性研究[J].中华医院感染学杂志,2019,29(1):96-98,102.
[3] 李满,梅方超,易斌,等.肝癌病人手术后早期肠内营养支持疗效的Meta分析[J].肠外与肠内营养,2017,24(1):41-45.
[4] 李强,方路,张小斌.肝切除术后早期应用肠内营养的系统评价[J].中国老年学杂志,2018,38(18):69-75.
[5] 王冬,仲蓓,刘兆礼.早期经口肠内营养对胃癌患者术后恢复的影响[J].中华普通外科杂志,2017,32(10):883-884.
[6] Li HT,Liu HG. Perioperative nutritional support for gastric stump cancer[J].Parenteral and Enteral Nutrition,2018, 38(4):193-196.
[7] 宗祥龙,季鑫,贾子豫.老年胃癌患者术后应用肠内营养管胃肠减压的临床研究[J].中华老年医学杂志,2017, 36(6):680-682.
[8] 黄彪,王琦三.早期肠内和肠外营养对胃癌病人术后免疫功能影响的系统评价[J].肠外与肠内营养,2014,21(1):35-38,42.
[9] 尤久红,陈琦,蔡飞燕.规范化营养治疗在胃癌围手术期病人中的应用效果观察[J].肠外与肠内营养,2017, 24(1):24-27.
[10] Li Q,Fang L,Zhang XB.Systematice valuation of early application of enteral nutrition after hepatectomy[J].Chinese Journal of Gerontology,2018,38(18):4416-4422.
[11] 冯志刚,杨雨民.胃癌患者微创全胃切除的手术效果研究[J].中国内镜杂志,2018,53(7):51-55.
[12] 余涛,曹祥龙,贾文焯.全胃切除术后两种消化道重建方式在老年胃癌患者中的临床疗效比较[J].中华老年医学杂志,2017,36(3):300-302.
[13] 林振孟,郑辉哲,严明芳.胃癌患者全胃切除术后吻合口瘘的危险因素及其预后[J].中华普通外科杂志,2018, 33(10):817-820.
[14] 王书昌,余四特,徐佳.保留功能胃切除在早期胃癌手术中的应用[J].中华胃肠外科杂志,2017,20(10):1141-1144.
[15] 徐徕,牛备战,孙曦羽.腹腔镜下早期胃癌节段切除术疗效分析[J].中华胃肠外科杂志,2017,20(2):213-217.
[16] 张威庆,张花花.腹腔镜辅助全胃切除术与开腹胃切除术+D2清扫术治疗胃上部癌的效果及对患者应激反应的影响[J].中国内镜杂志,2018,24(6):84-88.
[17] 任惠敏,苏卓彬,杨永江.胃癌全胃切除术后患者行家庭肠内营养的可行性研究[J].中国食物与营养,2018, 24(10):62-64.
[18] 李静,李璇,陈锐.内脏脂肪过多对胃癌切除术患者围手术期的影响[J].中国现代医学杂志,2017,21(26):89-92.
[19] 刘凤林,秦新裕.中国腹腔镜全胃切除的临床研究现狀[J].中华胃肠外科杂志,2018,65(2):121- 125.
[20] Wang Y,Wang HL,ZhaoYJ. Effects of early enteral nutrition support on postoperative recovery and nutritional status of patients after radical gastritis[J].Chinese Gerontology,2018,16(5):70-72.
(收稿日期:2020-04-01)

