小球藻对罗非鱼养殖水体水质及细菌群落结构的影响
秦 璐,陈 曦,裘丽萍,范立民,宋 超,郑 尧,孟顺龙,,陈家长,
(1南京农业大学无锡渔业学院,江苏无锡214081;2中国水产科学研究院淡水渔业研究中心/农业部长江下游渔业资源环境科学观测实验站/中国水产科学研究院内陆渔业生态环境和资源重点开放实验室,江苏无锡214081)
0 引言
中国是水产养殖大国,2019年淡水养殖总产量为3013万t,其中罗非鱼产量达164万t,占整个淡水养殖产量的5.44%[1]。吉富罗非鱼(GIFT)作为被改良过的品种,其遗传性状稳定,养殖周期短,是中国目前罗非鱼养殖的主导品种之一[2]。近年来,随着养殖密度的不断增加、饵料的过量投喂以及药物的滥用等,使养殖水域环境不断恶化,甚至引发养殖生物大规模死亡现象。可见,良好的水质条件对养殖动物的生长和养殖生态系统的稳定至关重要[3]。
微生物在水体中扮演重要角色,它参与营养物质的循环、残饵和粪便的分解以及鱼体病原体的抑制等[4-6]。水体中微生物群落组成并非固定的,它们容易受到养殖水环境和人为因素的影响,并且微生物群落结构变化能影响养殖水体水质状况及养殖生物的健康生长[7]。因此,研究投加小球藻对养殖水体微生物群落结构的影响能从微观层面揭示微生物的水质净化机理,提高水体净化效率[8]。
目前,应用于养殖水体调节的方法主要包括物理和化学方法,包括增氧、换水、吸附和氧化还原法等,但处理效果并不理想,运行成本较高,在实际运用过程中容易造成环境污染。生物方法主要包括种植浮生植物、投加微生态制剂等,它主要是通过生物自身的特性对养殖水体进行调控。利用浮游动植物和微生态制剂来调控水质已经在生产中有较多应用[9],并能有效减少对水产药物的依赖性[10-11]。直接利用小球藻来调节养殖水体的研究也有很多[12],通常是直接泼洒在水体中,还有将小球藻加工成藻粉添加到饲料中,通过间接方式作用于水体和养殖生物[13]。目前,关于小球藻直接泼洒在罗非鱼养殖水体,研究其对水体中微生物群落结构变化的报道较少。笔者以吉富罗非鱼为研究对象,探究不同添加量的小球藻对养殖水体N、P的调节作用,并利用16S rRNA高通量测序技术,分析不同添加量的小球藻对养殖水体微生物群落结构的影响,探索对养殖水环境调节的最佳浓度,以期从微观层面揭示微生物净化水质机理,提高水体净化效率[14]。
1 材料与方法
1.1 试验材料
试验用蛋白核小球藻(Chlorella pyrenoidosa)购自中国科学院淡水藻种库(FACHB),在实验室用BG11液体培养基对藻种进行扩大培养。试验用罗非鱼为吉富罗非鱼(GIFT),由宜兴罗非鱼养殖试验基地提供。
1.2 试验设计与管理
每10天取样一次,取样之前先测定水体T、DO、C、pH和SD,然后用5 L有机玻璃水质采集器在水下30 cm处采水,装入5 L的塑料瓶中,带回实验室测定水体理化指标和水体微生物。
1.3 试验方法
1.3.1 水质分析方法 水质测定指标包括氨氮(NH4+-N)、亚硝态氮(NO2--N)、硝态氮(NO3--N)、总磷(TP)和叶绿素a(Chl.a)。测定方法参考国家水质检测标准GB 11893—89。
1.3.2 DNA提取和PCR扩增 取水样3 L,经0.22 μm混合纤维素酯滤膜,用抽滤装置负压抽滤,然后用灭菌后的剪刀把滤膜剪碎,放入5 mL的无菌EP管中,放入液氮中速冻,用于细菌DNA的提取。
根据 E.Z.N.A.® soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)说明书进行水样中细菌DNA提取,然后用1%的琼脂糖凝胶电泳检测DNA提取质量,使用Nano Drop 2000仪器测定DNA浓度和纯度。对于检验合格的细菌DNA,对细菌16S rRNA的V3~V4区 进 行 PCR扩 增 ,引 物 为 :338F(5’-ACTCCTACGGGAGGCAGCAG-3’) 和 806R(5'-GGACTACHVGGGTWTCTAAT-3’),扩 增 程 序 为 :95℃预变性3 min,27个循环(95℃变性30 s,55℃退火30 s,72℃延伸30 s),72℃延伸10 min。扩增体系包括4 μL 5*FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μm),0.4 μL FastPfu聚合酶,10 ng DNA模板。
1.3.3 Illμmina Miseq高通量测序 利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)对扩增产物进行纯化,用Tris-HCl洗脱后用2%琼脂糖电泳检测。利用QuantiFluor™-ST(Promega,USA)进行检测定量,经检测合格后进行纯化及测序文库构建。依托上海美吉生物医药科技有限公司,根据Illumina MiSeq平台(Illumina,San Diego,USA)将纯化后的扩增片段构建PE2*300文库,利用Miseq PE300平台进行测序。
1.3.4 数据分析 采用SPSS 21.0软件对水体数据进行统计分析,用Origin 94C对数据作图分析。为保证对微生物群落组成后续分析质量,原始测序序列使用Trimmomatic软件质控,使用Flash软件(version 1.2.11)进行拼接。使用Usearch软件(version 7.0),根据97%的相似度对序列进行OTU聚类并剔除单序列和嵌合体[15]。利用RDP classifier(version 2.11)贝叶斯算法对97%相似度水平的OTU代表序列进行分类学分析,对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。
利用Mothur软件(version 1.30.2)对序列进行抽平[16],计算Alpha多样性指数,包括Shannon指数(Ishannon)、Simpson指数(Isimpson)、Chao指数(Ichao)和Ace指数(IAce)和Coverage指数(Icoverage)。利用QIIME软件(version 1.9.1)制成稀释曲线,进行主成分分析(Principal component analysis,PCA),绘 制 相 关 性Heatmap图。
3.形式的多样性。流行音乐不应该只是流行歌曲的代名词,它还包括通俗钢琴曲、经典影视音乐和影视歌曲、轻音乐等。丰富多彩的流行音乐能够使学生更好地了解经典作品。
2 结果与分析
2.1 小球藻对养殖水体中N、P的影响
在整个养殖试验期间,水体TP的浓度呈上升趋势,在第2、3次取样期间,TP的浓度上升最快。在第3次取样时,MC组与NC组的总磷浓度差异显著(P<0.05),在第4次取样时,MC和HC组的总磷浓度都比NC组低,但各组之间无显著性差异(P>0.05)。
在整个养殖期间,水体NH4+-N浓度整体呈现上升后下降的趋势,下降速率HC>MC>LC>NC。第3次取样时,各处理组之间差异不显著(P>0.05),但MC组和HC组的NH4+-N浓度明显低于NC组,且HC组的浓度更低。第4次取样时,LC组与MC组、MC组与HC组之间,水体NH4+-N浓度差异显著(P<0.05),NC、MC和HC组的NO3--N浓度均呈上升趋势。试验期间,各处理组水体中NO2--N浓度整体呈上升趋势,但不同取样期间各处理组之间差异不显著(P>0.05)。第1、2次取样时,水体NO2--N浓度差异不大,但第3、4次取样时,水体NO2--N含量比前2次明显升高,且第3次取样HC组的NO2--N含量低于NC组。
2.2 小球藻对水体微生物群落结构的影响
2.2.1 微生物群落多样性分析 对试验过程中采集的48个水体样品进行16S rRNA测序,共获得7027597对Reads,将双端Reads拼接、过滤后共产生2537423条优化序列(clean tags),每个样品至少产生39973条优化序列,平均产生52863条优化序列;所有样品平均序列长度在415~416 bp之间,分类注释共获得1637个OTU。
不同的指数可以反映不同微生物群落组成多样性和丰富度变化[17]。通过对样品多样性指数(Shannon指数、Simpson指数)、丰富度指数(Ace指数和Chao指数)的研究,如表1所示,在第1次取样时,分析发现Sobs指数、Shannon指数、Simpson指数、Ace指数和Chao指数在各处理组之间存在差异,且LC1组的Sobs指数、Shannon指数和Chao指数与MC1组相比,有显著性差异(P<0.05)。MC1组的Shannon指数值高于其他3个处理组。在各处理组中,MC1组的Chao指数值最高,该组的微生物群落丰富度高于其他3组。LC、MC和HC组的Shannon指数值在第2、3次取样时较对照组高,差异不显著(P>0.05),但在第4次取样时,NC4组与MC4组的Chao指数有显著性差异(P<0.05),且NC4组的物种总数最高,群落丰富度也高于其他组。
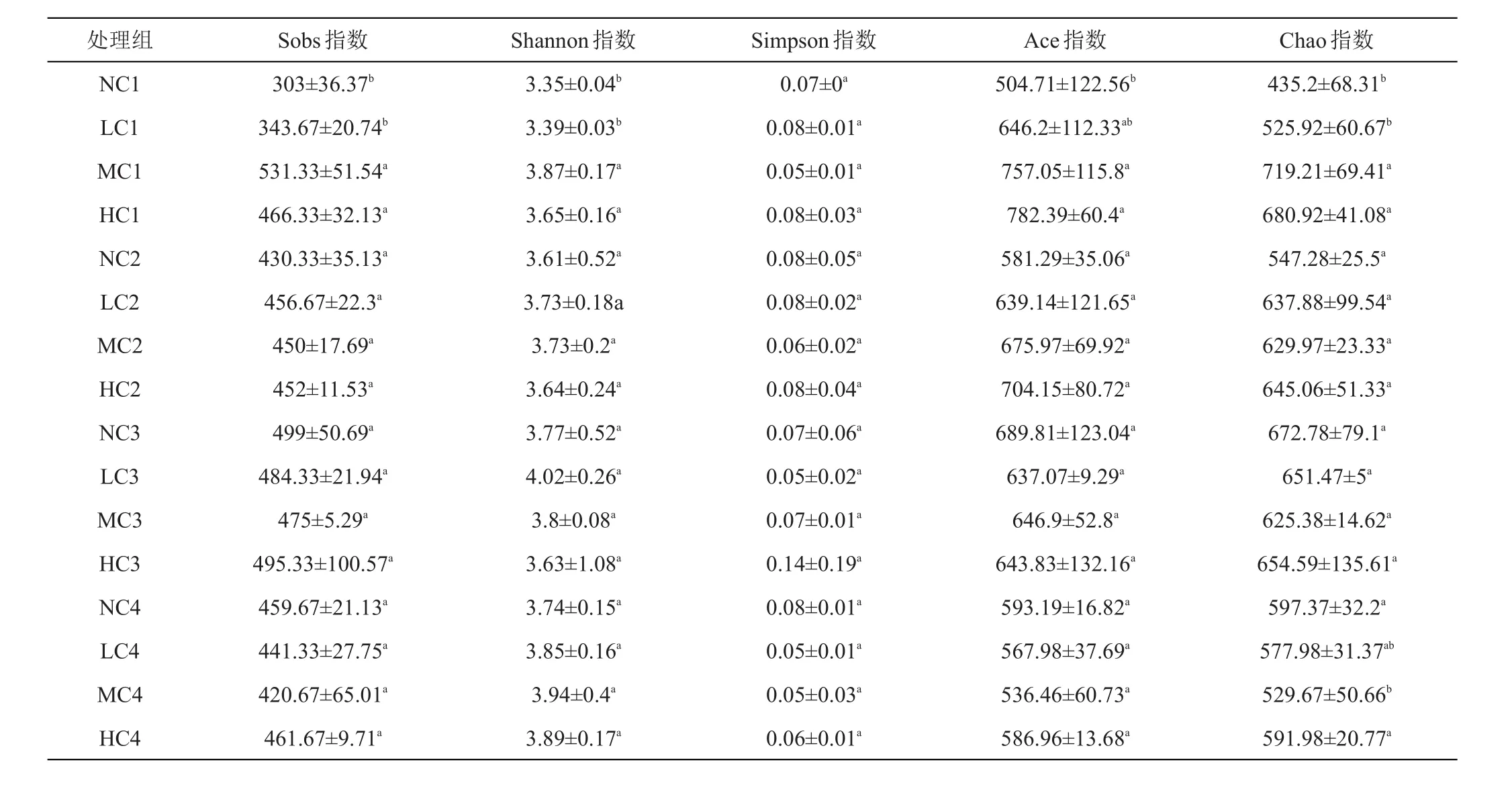
表1 细菌群落丰富度和多样性指数

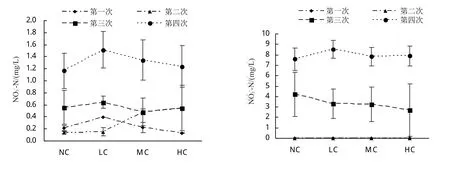
图1 养殖水体营养盐N、P浓度的变化
稀释曲线可以用于比较不同样本的物种丰富度,在选取相同序列的条件下,OTU数值越多,说明物种丰富度越高。同时,它还可以表征样本的测序深度情况,判定取样量是否合理。如图2所示,当在97%相似水平下曲线趋向平坦,说明本研究得到的序列可以代表罗非鱼养殖过程中水体中大多数微生物群落,能够很好地反映该养殖水体中细菌群落结构。
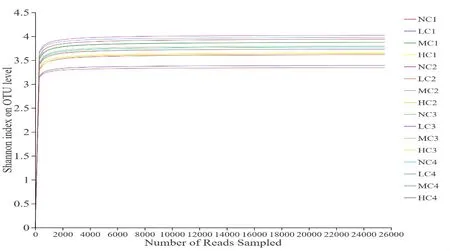
图2 Shannon稀释曲线图
2.2.2 细菌群落组成分析 根据Venn图(图3)分析可知,第1、2、3、4次取样时,水体中总OUT数目分别为1358、1275、1390和1480;NC、LC、MC和HC四个分组共有的OUT数目为282、398、456和463。在第4次取样时,NC4组与LC4、MC4和HC4组共有的OTU数目比前3次取样时高,这可能由于小球藻的添加次数增加,细菌群落组成逐渐趋于稳定。

图3 各分组样品中OUT数目Venn图
根据OUT的注释结果,分别对各处理组在门(Phylum)和属(Genus)的分类水平上群落结构组成分析,发现在整个养殖过程中,各组的优势菌门主要为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),这3种优势菌门在各处理组所占比例均达80%以上。从1~4次取样上看,NC、LC、MC和HC四个组中变形菌门的相对丰度随养殖时间的增加呈降低趋势,而放线菌门有增加的趋势,这也是群落随时间变化的重要特征之一。从单个取样时间点来看,在第1次取样时,NC1和LC1组放线菌门的相对丰度明显低于MC1和HC1组,拟杆菌门变化趋势与放线菌门相反;第2次取样时,MC2组疣微菌门(Verrucomicrobia)的相对丰度在各处理组之间最大;第3、4次取样时,放线菌门的相对丰度比前2次取样时增加,但变形菌门的比例变小,这说明随着养殖周期的增加,水环境的变化更有益于放线菌门细菌的生长,而对变形菌门细菌的生长有一定程度的抑制作用,对拟杆菌门的影响变化不大,但在HC3组中,拟杆菌门的相对丰度明显高于其他分组(图4)。

图4 门分类水平上的群落组成
分别对4次取样的水体样品在属分类水平上进行群落丰度分析。在第1次取样时,NC1和LC1处理组的优势菌属不明显,主要为Limnohabitans、Ramlibacter和新鞘脂菌属(Novosphingobium),MC1组的绝对优势菌属为norank-f-Rhizobiales-Incertae-,HC1组的绝对优势菌属为鞘脂菌属(Sphingobium)。在第2次取样时,各处理组的优势菌属较第1次取样时差别较大,主要由norank-f-Rhizobiales-Incertae-、noranko-OPB56和Mycobacterium三种菌属组成,且随着小球藻浓度的增加,3种优势菌属的相对丰度有降低趋势,unclassified-f-Rhodobacteracea和黄杆菌属(Flavobacterium)的相对丰度逐渐增加。与前2次取样时相比,第3、4次取样时Aurantimicrobium和hgcI-clade菌属的相对丰度显著增加。在整个养殖过程中,HC3组Flavobacterium的相对丰度明显高于其他各处理组,HC4组中hgcI-clade菌属的相对丰度在该组占比达30%,属绝对优势菌属。Limnohabitans菌属随养殖时间的增加逐渐减少,这种现象表明不仅是因为小球藻的添加抑制了该菌属的生长,还可能因为这种菌属是自然养殖过程中群落随时间变化的标志菌之一。
2.3 水体微生物与环境之间的关系
图6为养殖期间水体微生物在门分类学水平上与环境因子NH4+-N、NO3--N、NO2--N和TP的相关性Heatmap图,红色越深代表对应菌门的丰度越高,蓝色越深代表对应菌门的丰度越低。选取丰度前10的门类进行分析,发现养殖水体中主要菌门为放线菌门(Actinobacteria)、栖热菌门(Deinococcus-Thermus)、疣微菌门(Verrucomicrobia)和梭杆菌门(Fusobacteria),其中,变形菌门细菌的丰度和NO3--N、NO2--N和总磷都具有极显著的相关性,但和NH4+-N的相关性不大;变形菌门(Proteobacteria)、蓝藻菌门(Cyanobacteria)和装甲菌门(Armatimonadetes)在养殖期间的丰富度较低,尤其以变形菌门的丰富度最低。在4种水质指标中,拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)和梭杆菌门(Fusobacteria)和NH4+-N的相关性最高,和其他水质指标的相关性较低。

图5 属水平微生物群落结构组成分布

图6 门分类水平上环境因子与微生物组成相关性分析图
3 讨论
3.1 小球藻对水体氮磷的去除作用
养殖水体是鱼类生活的直接环境,水质的好坏决定了鱼体能否健康生长。本研究发现,随着养殖周期的增加,残饵和粪便在水体中不断积累,使水体中的氮磷含量都有一定程度的上升趋势。对于水体磷含量,上升呈先急后缓的趋势,这可能因为试验前期小球藻未能在水体中形成优势物种,在水体中含量较少,从而对磷酸盐的去除效果不好。不同取样时期,HC组的总磷含量低于其他处理组,也说明有吸收磷酸盐的作用,这与陈春云等研究小球藻在对虾养殖水体中的影响[18],它能够去除水体中的磷酸盐一致,但去除率较低,可能与养殖生物种类和小球藻的添加量有关。
水体中残饵和鱼体代谢物经微生物分解,变成NH4+-N等小分子无机物[19],使水体游离态的氨浓度上升,含量过高会对鱼体产生毒害作用[20]。养殖过程中,NH4+-N呈先上升后下降的趋势,可能随着残饵、粪便的不断积累,水体中的NH4+-N含量升高,而小球藻的浓度不足以降低养殖水体中的NH4+-N浓度。但随着小球藻添加量的增加,对NH4+-N的去除效果更好。第3次取样HC组明显低于NC组,这说明小球藻有去除养殖水体氮的作用,与王黎颖等[21]的结果一致。
NO2--N作为NH4+-N转化为NO3--N的中间产物,对鱼类的毒害作用比NH4+-N和NO3--N更强[22]。在养殖试验后期,水体中的NO2--N含量较前两次高,可能因为养殖后期,阴雨天较多,水体中溶解氧含量降低,阻碍了水体中NH4+-N转化为NO3--N,使中间产物NO2--N增多,但HC组的含量和其他3个组相比偏低,这可能与小球藻的不同添加量有关。与NO2--N相比,NO3--N对养殖生物的毒性比NH4+-N和NO2--N小得多,但高浓度NO3--N对养殖生物也会产生不良影响[23]。马红芳等[24]研究发现在养殖废水中添加一定浓度的栅藻,在一定时间内可以降低水体中NO3--N含量,且去除效率可达90%,与本研究结果相似,但本研究中小球藻对NO3--N的去除率较低,这可能与小球藻的添加量以及饲料投喂量的增加有关。因此,建议在实际养殖水体中,适当提高小球藻的添加浓度,使养殖水体中N、P营养盐浓度处于达标状态。
3.2 小球藻对养殖水体微生物群落结构的影响
3.2.1 小球藻对养殖水体微生物群落结构多样性影响 养殖水体是养殖生物直接生活的环境,水体中细菌群落种类和丰富度是水质条件好坏的综合反映[25]。在养殖期间,随着添加蛋白核小球藻次数的增加,水体中共有的OUT数目也在不断增加,群落组成相似性增加,说明小球藻的添加有助于某些微生物的生长,使养殖水体中的共有物种数目增加,细菌群落相似性增加。
细菌群落多样性决定了它对外界干扰因素的抵抗能力,菌群组成越复杂,说明对外界环境变化和种群波动的调节能力越强,群落结构稳定性越高[26]。在试验前期和中期,随着养殖的进行,各处理组物种多样性和群落丰富度差异减小,且添加小球藻组(LC、MC和HC)的Shannon指数值高于对照组,但差异不显著(P>0.05),这可能是因为在小球藻投放初期,它还没有在养殖水体中形成优势种,对水体中微生物群落的影响较小。在养殖试验末期,NC4组与MC4组的Chao1指数有显著性差异(P<0.05),且NC4组的物种总数最高,群落丰富度也高于其他组,这可能由于小球藻在该水体中逐渐稳定,生长优势形成,对水体某些微生物种群的影响较大,形成优势种,导致其他物种种类减少,物种丰富度降低。
3.2.2 小球藻对微生物群落组成差异性分析 细菌在养殖水体中营养物质的转化和能量流动具有重要作用,细菌群落组成结构决定了水体环境生态功能特性。添加不同浓度的小球藻对养殖水体细菌微生物的群落结构影响不同。在养殖前期和中期,投加小球藻可以改变原有的群落组成结构,增加各菌门细菌微生物的竞争,使原有菌门的优势度降低,但在养殖后期,变形菌门、拟杆菌门和放线菌门的比例,这可能与随着养殖周期的增加,这些菌门很快适应这种变化,又形成了新的竞争优势有关。众多学者研究表明:在淡水养殖水体中,微生物主要由变形菌门、放线菌门、拟杆菌门、蓝细菌门、疣微菌门和浮霉菌门等[27-29]在整个养殖过程中,发现变形菌门、拟杆菌门和放线菌门的细菌丰度最高,这与之前学者的研究结果相似。放线菌门的生长能调节水质,抑制有害微生物的生长繁殖,还可以将水体中的N、P等元素转化成其他物质[30],与水环境中N、P的去除紧密相关。本研究发现添加小球藻可以使变形菌门微生物有一定程度增加,但各处理组之间差异不明显,这可能与小球藻的添加浓度较低有关。
在养殖中后期,优势菌属为不动杆菌属、Aurantimicrobium和hgcI_clade等。hgcI_clade具有很强的吸附能力,它可以吸收养殖水体中碳水化合物和含氮量较高的化合物[31],还可以促进水体碳、氮循环,与环境因子相互作用,从而改善养殖水环境。不动杆菌属多为致病菌,它们会危害鱼类健康[32]。在最后一次取样时,不动杆菌属的相对丰度较前3次偏高,这可能与第3~4次取样期间阴雨天气较多,水体溶氧含量低,对不动杆菌属的细菌生长有利。但HC4组的该菌属的相对丰度偏低,这也能说明添加小球藻可以一定程度上降低该菌属的比例,减轻对鱼体的毒害作用,但且该黄杆菌属是一种条件致病菌,且为革兰氏阴性菌,它可以引起鱼体烂鳃和出血病。在第3次取样时,HC3组该菌属的相对丰度比其他处理组高,且该组部分鱼体出现轻微烂鳃状况,导致这种差异的主要原因可能是受自然环境和水体环境因子如光照、温度等条件的影响,使该处理组的水体条件有益于黄杆菌门的生长[33]。
3.3 养殖水环境与微生物群落的关系
在整个养殖过程中,从斯皮尔曼相关性热图可以看出,养殖水体中拟杆菌门群落丰富度与NH4+-N含量显著相关,这与[34]研究结果中拟杆菌门丰度与NH4+-N浓度呈正相关结果一致。在本研究中,还发现放线菌门的相对丰度和水体NH4+-N、NO3--N和NO2--N浓度呈正相关,这与Philippot等[35]的研究结果水体NH4+-N和NO3--N的含量与放线细菌门相对丰度呈负相关相反,这可能与养殖生物的种类、水温、天气状况等有关。
4 结论
投加小球藻可以一定程度降低罗非鱼养殖水体中氮磷含量,且高浓度组的去除效果更好,对3种形态氮的去除率NH4+-N>NO3--N>NO2--N。投加小球藻可以使养殖水体细菌群落多样性和物种丰富度有不同程度的降低作用,中浓度组和高浓度组的降低效果更显著;此外,小球藻还可以改变养殖水体细菌组成结构,使变形菌门相对丰度减小,放线菌门相对丰度增加,拟杆菌门群落丰富度与NH4+-N含量显著相关,放线菌门的相对丰度和水体NH4+-N、NO3--N和NO2--N浓度呈正相关。在实际生产中,可以通过向罗非鱼养殖池塘泼洒一定浓度的小球藻来调节养殖水体中的氮磷含量,从而达到对水体微生物群落的调节作用,同时也可以从微观层面解释微生物对水体的调控机理,为养殖废水的处理提供参考,进而提高水体净化效率。

