SULT1A1基因多态性与女性乳腺癌易感性及他莫昔芬治疗预后相关性研究
安玉英 张风林 宋小颖
乳腺癌是1种发病率较高的女性常见恶性肿瘤,据统计2013年我国新发女性乳腺癌人数高达27.9万人,在各类女性恶性肿瘤中发病率居首,死亡病例超过6万人[1-2]。硫酸化(sulfation)是人体重要的共轭途径之一,在机体脱毒并从宿主体内清除有毒外源性化学物质和内源性小分子过程中起主要作用,在磺基转移酶(sulfotransferase,SULT)家族成员的作用下维持内源性小分子与外源性化合物的稳态[3-4]。SULT1A1作为SULT家族主要成员其基因多态性已被发现与膀胱癌、肝癌等恶性肿瘤疾病易感性存在关联,但在乳腺癌患者中,其临床价值尚存争议[5-6]。本研究对我院收治的乳腺癌患者SULT1A1 基因Arg213His(rs9282861)位点多态性进行调查,旨在为该位点与本地区居民对乳腺癌的易感性及治疗反应研究提供有价值的研究基础,现报告如下。
1 资料与方法
1.1 研究对象
选择本院肿瘤科2015年3月至2017年3月收治的女性乳腺癌患者86例作为研究对象。纳入标准:①均经我院病理科确诊为浸润性乳腺癌,诊断参照《中国抗癌协会乳腺癌诊治指南与规范(2019版)》[7]。②雌激素受体阳性,均在化疗或放疗结束后口服他莫昔芬进行内分泌治疗,治疗时间超过6个月。③均在我院初次接受治疗,治疗前无转移或复发。排除标准:①合并其它恶性肿瘤者。②合并传染性疾病者。③治疗中途转院或更改治疗方案者。选择本院体检中心健康女性80例作为对照组,均为汉族女性且无肿瘤史,研究组患者平均年龄为50.15±6.18岁,已绝经患者34例(39.53%),TNM分期Ⅰ~Ⅱ期52例(60.47%),Ⅲ~Ⅳ期34例(39.53%),对照组女性平均年龄(50.88±5.94)岁,已绝经者30例,两组研究对象平均年龄、绝经率比较无差异(P>0.05)。本研究所有患者均签署对研究知情同意书。
1.2 方法
1.2.1 SULT1A1 基因Arg213His(rs9282861)位点多态性检测 ①所有研究对象均抽取外周静脉血3 ml,采用DNA提取试剂盒(北京天根生化有限公司)提取全血DNA,使用NanoDrop2000超微量分光光度计对提取DNA浓度及纯度进行检测,合格标本置于-20 ℃冰箱保存。②针对SULT1A1基因Arg213His(rs9282861)位点,根据目标序列设计特异性引物并交由生物公司进行合成,所用序列为SULT1A1-F:5’-CAATTCTTTTTACCCCCGG-3’,SULT1A1-R:5’-AGGGAGCAAAGCTGGAGTC-3’。③实验时将冰箱中DNA取出在室温下化冻,离心平衡后采用限制性片段长度多态性聚合酶链反应(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)法对模板中目的序列进行扩增,反应体系为20 μl,其中PCR master mix 10 μl,模板1 μl,上、下游引物各1 μl,双蒸水补足剩余体积,反应条件:94 ℃4 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 42 s,反应进行35个循环,72 ℃ 10 min,将反应产物回收纯化后进行双酶切反应,反应结束后采用1.8%琼脂糖凝胶进行扩增,在凝胶成像仪中观察分型结果,取1/3样品送公司测序对结果进行验证。
1.2.2 预后判定 以局部复发或转移作为他莫昔芬治疗不良结局,局部复发定义:患侧乳腺或胸壁发现复发病灶,且经活检证实。转移定义:非患侧区域经活检发现肿大淋巴结,或远处器官以活检结果作为诊断依据,将研究组患者分为复发转移组及非复发转移组,随访:所有患者均在他莫昔芬治疗开始后进行随访,随访方式为电话随访或复诊时,频率为每3个月1次,以患者发生复发、转移或全因死亡作为随访终点,截止日期与2020年5月1日。总生存期计算:患者发生肿瘤复发、转移或全因死亡或末次随访时间与初次随访时间时间差。
1.3 统计学分析
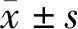
2 结果
2.1 两组SULT1A1基因rs9282861位点基因型、等位基因分布比较
两组SULT1A1基因rs9282861位点基因型分布符合哈迪-温伯格平衡(P>0.05),具有群体代表性。研究组rs9282861位点GA、AA基因型、A等位基因频率高于对照组(P<0.05),GG基因型、G等位基因频率低于对照组(P<0.05),见表1。
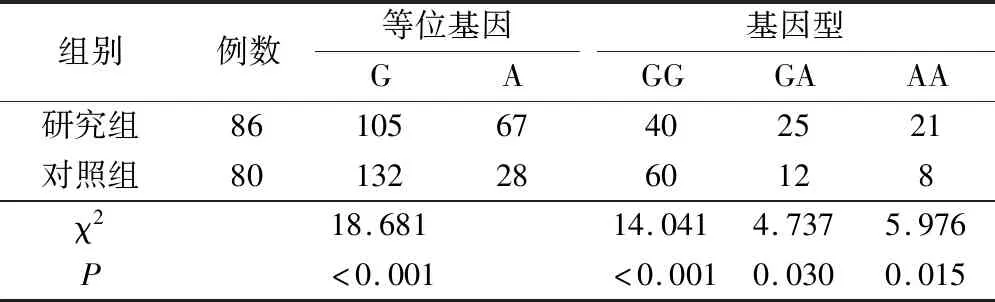
表1 两组SULT1A1基因rs9282861位点基因型、等位基因分布比较
2.2 SULT1A1基因rs9282861位点与乳腺癌发病风险关联性分析
校正年龄、绝经状态等因素后,Logistic回归分析结果显示,与携带GG基因型患者相比,携带GA、AA、GA+AA患者发生乳腺癌风险分别为3.125、3.938、3.450倍,与携带G等位基因患者相比,携带A等位基因患者发生乳腺癌风险为3.008倍,均具有统计学意义(P<0.05),见表2。
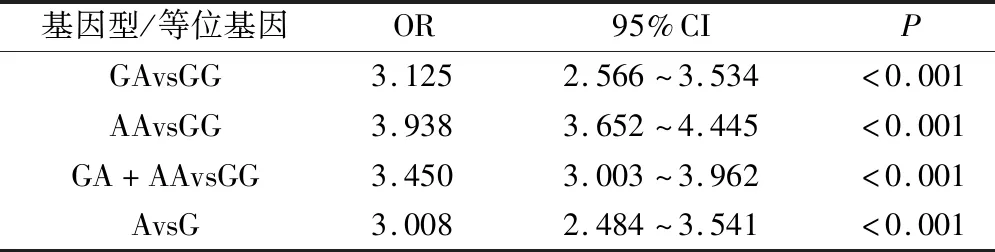
表2 SULT1A1基因rs9282861位点与乳腺癌发病风险关联性分析
2.3 SULT1A1基因rs9282861位点不同基因型乳腺癌患者预后比较
截止随访截止时,86例研究组患者共有5例失访(GG型3例,GA型1例,AA型1例)。所有患者随访时间31~58个月,平均41个月。所有患者中位生存期为26个月,rs9282861位点GG、GA、AA基因型中位生存时间分别为30个月、24个月、20个月,差异具有统计学意义(P<0.05)。
3 讨论
近年来女性乳腺癌在我国呈现出发病率不断增加、发病年龄不断降低的特点,尽管已有多种新药用于该病的临床治疗,预期寿命明显延长,死亡率降低,但继续对其机制进行研究对于改善患者治疗体验及预后具有重要的意义[8-9]。研究[10-11]认为,随着年龄的增长女性雌激素水平改变明显,这一过程对于雌激素依赖型乳腺癌的发病具有重要影响。机制研究[12-13]发现,雌激素E2可通过与雌激素受体结合并激活相关癌基因的方式促进乳腺癌细胞的增殖或凋亡过程。因此,阻断E2与雌激素受体的结合过程可能是阻止乳腺癌病情进展的关键靶点。
SULTA1与雌激素相关疾病已有较多的报道,邵茵等[14]研究发现SULT1A1在子宫肌瘤患者中低表达,且与年龄、肌瘤数目存在关联;Moyer等[15]研究发现SULT1A1基因变异对近期绝经后白人妇女雌激素水平和激素治疗反应有关,对于雌激素治疗具有指导意义。本研究对于本地区女性乳腺癌患者外周血中SULT1A1基因rs9282861位点多态性进行调查,结果显示与对照组对象相比,研究组患者GA、AA基因型、A等位基因频率明显升高,而GG基因型、G等位基因频率明显下降,说明该位点在遗传水平上的多态性与本地区女性对于乳腺癌的易感性存在关联,本研究进一步通过Logistic回归分析发现,SULT1A1基因rs9282861位点携带GA、AA基因型及A等位基因患者相较于携带GG基因型及G等位基因患者发病发病风险明显增加,因此SULT1A1基因rs9282861位点作为乳腺癌相关筛查指标具有一定的价值。Forat-Yazdi等[16]通过Meta分析对11077 乳腺癌患者及14798健康对照组结果显示,SULT1A1基因rs9282861位点与亚洲女性对乳腺癌易感性具有明显的影响,与本研究结果一致。
内分泌治疗是雌激素受体阳性乳腺癌患者治疗的一线经典方案,具有毒性低、作用效应好及经济性好的有点,在乳腺癌的早期治疗中获益较大,但在持续治疗后易出现耐药问题,是导致肿瘤的进展及转移的药物性因素之一[17]。既往研究发现,磺基转移酶可参与他莫昔芬代谢过程中的磺化反应,进一步影响其失活外排过程[18],因此,SULT1A1基因遗传多态性可能通过影响磺基转移酶合成的方式对他莫昔芬代谢过程产生影响,但对于SULT1A1基因多态性与他莫昔芬治疗的雌激素依赖型乳腺癌患者的预后尚存争议。本研究对于SULT1A1基因rs9282861位点携带不同基因型患者OS进行比较,与GG型患者相比,携带GA、AA型患者OS明显降低,说明检测SULT1A1基因rs9282861位点多态性对患者的预后判断也有一定的价值,与Sanchez-Spitman等[19]报道结果一致,但与Charoenchokthavee等[20]结果不同,其原因可能与纳入患者地区人种差异、患者绝经状态及化疗方案差异有关。
综上所述,本研究结果证明了SULT1A1基因rs9282861位点与本地区女性乳腺癌易感性及他莫昔芬治疗预后存在关联,参与了乳腺癌的发生、发展过程,由于纳入病例数较少、随访年限短及未进行体内、外实验等缺陷,相关结论有待进一步研究的完善。

