萤火虫荧光素酶标记结直肠癌模型的建立
杨俊寒, 段海潇, 张紫怡, 王润杨, 刘滨磊, 胡 翰, 汪 洋
(湖北工业大学生物工程与食品学院, 湖北 武汉 430068)
结直肠癌作为消化道的恶性肿瘤之一,死亡率位居所有癌症第4位[1],在中老年人群中发病率极高,且每年发病率都有增加。遗憾的是,有1/5的结直肠癌患者在病情确诊时都伴随远处转移,而该类患者5年生存率仅为12%。结直肠癌的治疗方法主要分为三大类:首先是外科手术治疗,即通过手术切除肿瘤,但是通过该方法进行治疗方法通常不够彻底,无法根除肿瘤;其次是放疗和化疗,这种疗法虽然可以有效针对肿瘤细胞,但是它们对机体正常细胞也会产生较大伤害;最后就是近年来受到研究者青睐的肿瘤免疫治疗,其能重新启动并维持患者自身免疫系统对肿瘤细胞的识别和杀伤,诱导机体慢慢恢复其抗肿瘤免疫反应。肿瘤免疫治疗不仅效果好,而且避免了治疗过程中对机体的二次损伤。但由于CT26细胞不带任何标记,在研究肿瘤细胞成瘤和病灶转移的过程中无法对其进行有效观察及检测。因此需要通过某些手段对其进行标记,且能通过仪器对标记进行捕捉和记录。肿瘤免疫治疗中常用的一项技术——生物发光分析法标记生物,正好解决这一问题。
萤火虫荧光素酶(Firefly luclferase,Fluc)是生物发光中研究最为深入、透彻的发光系统。其发光机制是荧光素酶与底物在Mg2+的作用下反应形成的腺昔酸荧光素酞化复合物, 能够与酶结合且经过氧化脱梭作用即转化至激活状态的氧化荧光素,最后发射光子[2]。 将表达Fluc的基因转入到真核细胞中使其能稳定表达, 且不影响细胞正常生长[3]。 由于其发射的光子可以被仪器捕捉记录, 因此可将它作为一种标记方法来检测特定细胞所在位置及大体数量。 作为建立动物肿瘤模型是癌症研究中一个最为重要的环节, BALB/c小鼠是常见的荷瘤鼠模型,在小鼠结直肠癌肿瘤模型建立方面是比较适合的。本研究通过在BALB/c小鼠右侧背部皮下植入构建成功的CT26-Fluc,观察记录所植入肿瘤细胞的繁殖变化情况,并在小动物活体成像设备中对荷瘤鼠的成瘤效果及相对荧光强度进行测量评估[4]。
1 实验材料
实验材料及来源见表1。
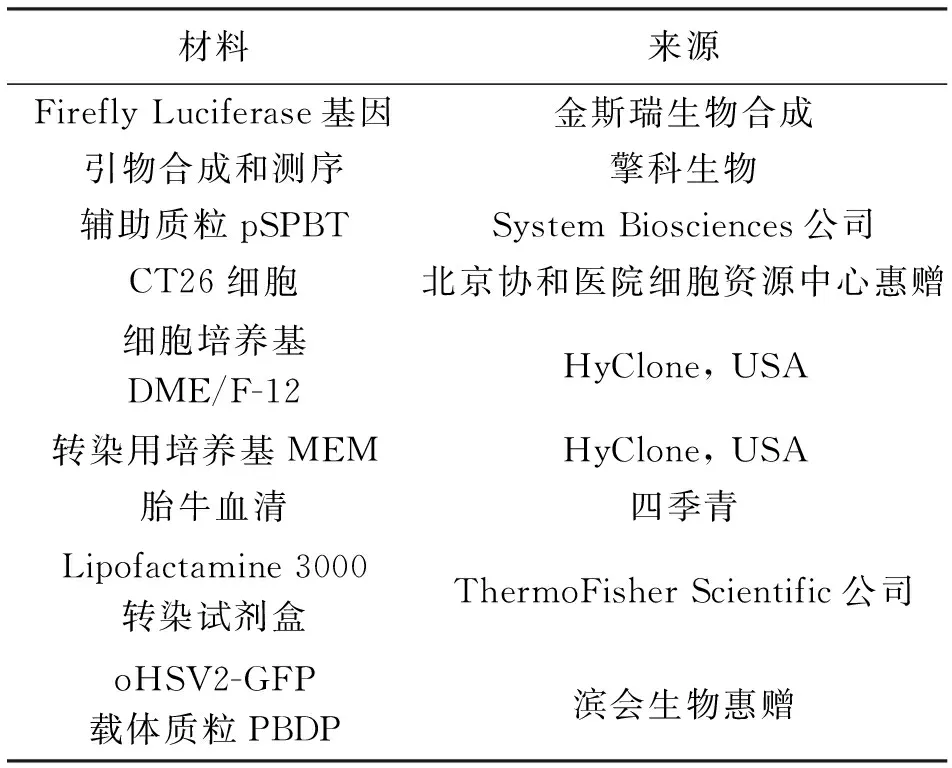
表1 实验材料及来源
2 实验方法
2.1 CT26细胞敏感性试验
按照标准方案对需实验的细胞进行培养。培养基为含10%胎牛血清的DME/F-12。收集细胞,500 g离心5 min,用DME/F-12(无血清培养基)重悬并进行细胞计数。用完全培养基(10%胎牛血清+ DME/F-12)将细胞密度稀释至2×105个/mL,然后接种于24孔板,置入CO2培养箱中进行培养,培养箱温度37℃,CO2浓度5%。翌日观察24孔板中细胞汇合度,待其汇合度达到90%左右,将不同浓度梯度的嘌呤霉素加入到24孔板中,此时记为第0天,此后每天同一时间在显微镜下对细胞生存情况进行观察记录,以第四天观察时细胞全部死亡所对应的嘌呤霉素浓度为最低致死浓度[5]。
2.2 PBDP-Fluc质粒构建
Firefly luciferase cDNA的序列长1653 bp,通过CMV启动子转录,用T2A连接PuroR和GFP基因,连接后的序列共用EF1α启动子来启动,最终得到PBDP-Flu质粒。
2.3 细胞转染试验
按照标准方案对细胞进行培养。完全培养基为含10%胎牛血清的DME/F-12。收集细胞,500 g离心5 min,用DME/F-12重悬并进行细胞计数,用完全培养基(10%胎牛血清+ DME/F-12)将细胞密度稀释至2×105个/mL,然后接种于24孔板,置入CO2培养箱中培养,培养箱温度37℃,CO2浓度5%。翌日观察24孔板中细胞汇合度,待其汇合度达到70% ~ 90%时,将质粒pSPBT和pPBDP-Fluc以质量比1∶5混合加入至含MEM的管A中,随后用MEM稀释Lipofactamine 3000加至B管。A,B两管溶液1∶1混合孵育且于室温静置10 min。将混合溶液均匀滴加至到铺有细胞的24孔板中并置于在CO2培养箱,37℃培养2~4 d[6]。在倒置荧光显微镜下观察细胞是否存在GFP。
2.4 CT26-Fluc细胞的单克隆获取
收集经嘌呤霉素筛选过后的CT26-Fluc细胞并进行计数,再以10倍浓度梯度对细胞悬液进行稀释,以500个/mL的细胞浓度接种于96孔板,每孔100 μL细胞悬液,置入CO2培养箱培养,待细胞完全贴壁后,用荧光显微镜观察细胞,当整个孔中仅有一个细胞分裂而成的细胞团,且转染成功(发绿色荧光)时,对该孔进行标记,并将其消化扩大培养[7]。
2.5 流式细胞术检测CT26-Fluc细胞纯度
将CT26原始细胞作为对照组细胞,收集扩增后的CT26-Fluc单克隆细胞[8],用BD C6 流式细胞仪 (BD Biosciences)检测CT26-Fluc中GFP的表达率并分析结果。
2.6 oHSV2-GFP[9]体外杀伤CT26-Fluc
按照标准方案对需实验的细胞进行培养。培养基为含10%胎牛血清的DME/F-12。收集细胞,500 g离心5 min,重悬至DME/F-12并铺板,待细胞汇合度达到80% ~ 90%时,按照病毒浓度1×105、0.5×105、0.25×105、0.125×105/孔接种毒株,于CO2培养箱培养30 h后,加入荧光素酶底物10 μL(15 mg/mL),孵育5 min后放入多功能酶标仪中检测荧光素表达量。
2.7 CT26-Fluc细胞成瘤性评估
于BALB/c小鼠右侧肋腹皮下注射100 μL含有1×106个CT26-Fluc的细胞悬液[10],待肿瘤体积至100 mm3,记录观察肿瘤大小,用动物活体成像系统对其进行麻醉拍摄。
3 实验结果
3.1 PBDP-Fluc质粒构建
PBDP-Fluc质粒构建见图1。
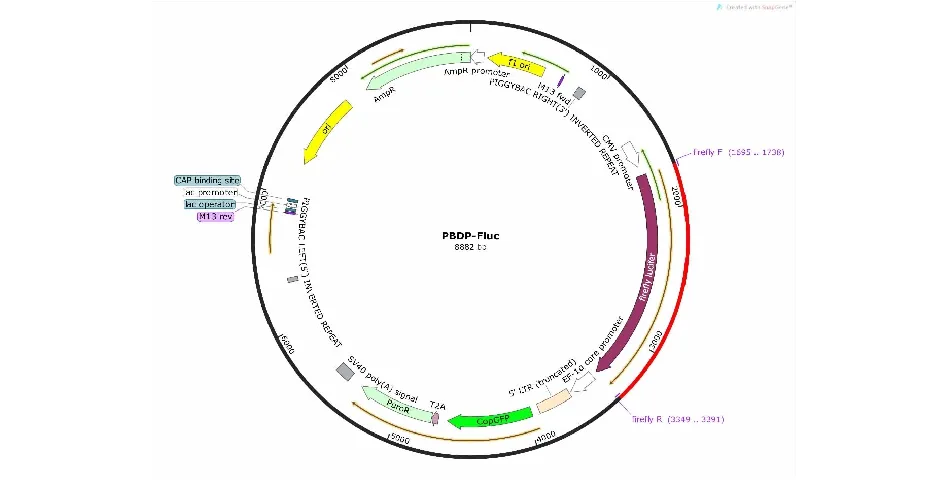
图 1 PBDP-Flu质粒
3.2 CT26细胞质粒转染及CT26-Fluc单克隆细胞的挑取、扩培
PBDP-Fluc和辅助质粒转染CT26细胞,转染成功即可见发绿色荧光的CT26-Fluc。图2放大倍数为40,图3放大倍数为100。
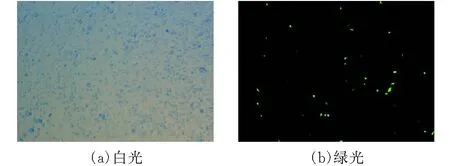
图 2 PBDP-Fluc-GFP转染CT26
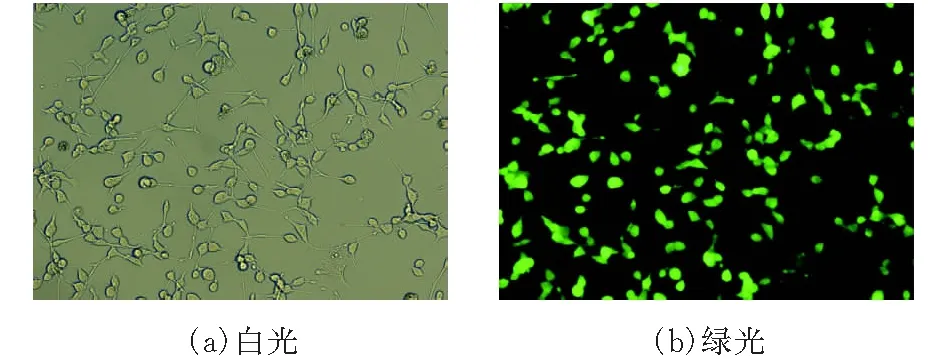
图 3 CT26-Fluc单克隆细胞扩培
3.3 流式细胞仪检测CT26-Fluc单克隆细胞
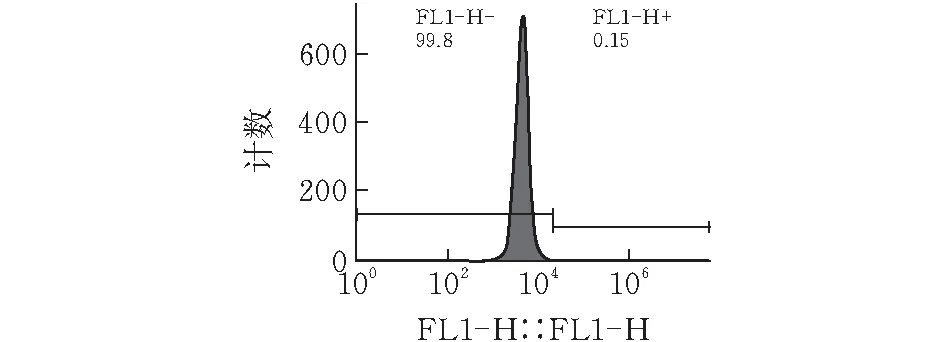
流式细胞仪检测对照组(CT26)和实验组(CT26-Fluc)GFP的表达(图4),结果显示实验组GFP(GFP所在通道即为FL1-H)表达率达到99.8%,表明CT26-Fluc细胞系是单克隆细胞系。
(a)CT26
3.4 多功能酶标仪检测oHSV2-GFP体外杀伤CT26-Fluc
接种毒株后30 h,用多功能酶标仪检测CT26-Fluc的荧光素表达(图5)。结果显示,病毒感染复数(MOI)越高,亦即病毒滴度越高时,检测到的荧光素酶荧光强度表达量越低,说明活细胞数越少。而未加病毒的mock组荧光素酶荧光强度表达量最高,Negative组(阴性对照,仅为CT26原始细胞系)检测不到荧光素信号。
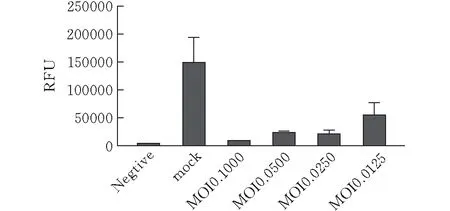
图 5 酶标仪检测病毒杀伤CT26-Fluc细胞荧光素荧光强度表达
3.5 CT26-Fluc BALB/c模型建立
为了证明CT26-Fluc细胞系能够在BALB/c小鼠体内表达Firefly luciferase,在小鼠右侧背部植入CT26-Fluc(图6)。第5天时,用小动物活体成像系统观察到植瘤部位有明显的CT26-Fluc肿瘤生长。
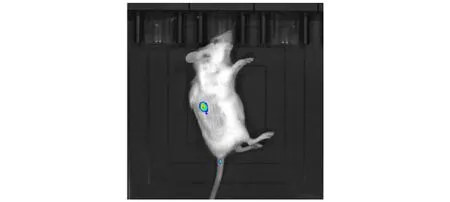
图 6 动物活体成像拍摄CT26-Fluc
4 结论
研究发现,Firefly luciferase的表达不影响CT26-Fluc细胞系的细胞形态、细胞增殖等细胞学特征,因此可以以此为基础建立新的体外杀伤肿瘤细胞检测方法,即通过向孔板内加入荧光素酶底物,检测板孔内的荧光素信号并与空白对照进行对比,从而反映所研究物质对肿瘤细胞的杀伤作用。与传统方法相比,该方法更便捷也更准确客观。同时,为了验证CT26-Fluc细胞是否可用于建立小鼠结直肠癌成瘤模型,以及Fluc基因是否可在荷瘤鼠模型中稳定表达,又将CT26-Fluc细胞对BALB/c小鼠进行右侧背部皮下植瘤,饲养期间注射部位出现结节,随后对其成瘤情况进行了活体成像拍摄。结果表明,在结节形成部位有明确的荧光显示,说明CT26-Fluc细胞不仅可以用于建立小鼠结直肠癌成瘤模型,而且Firefly luciferase基因能够在成瘤部位表达。以该方法标记替代传统的游标卡尺测量肿瘤大小,减少了各种误差,具有更明显的客观性。同时也降低了传统测量方法给实验人员带来的安全隐患,在肿瘤细胞在活体动物体内的生长和转移方面,也提供了更为直观、快捷的方法。

