CYP2C9*3基因多态性对苯溴马隆降尿酸疗效及其肝毒性的影响
盛碧 孟军华 安靖 吴金虎 宋红艳 李江健 陈灵

摘 要 目的:研究CYP2C9*3基因多态性对苯溴马隆降尿酸疗效及其肝毒性的影响。方法:采用回顾性研究方法,对武汉市第三医院2018年1月-2019年9月196例服用苯溴马隆并行CYP2C9*3基因多态性检测的痛风患者的相关临床指标与基因型的相关性进行分析。结果:196例患者中,CYP2C9*3基因*1/*1、*1/*3、*3/*3基因型分别有179、15、2例,各基因型分布均符合Hardy- Weinberg遗传平衡定律(P>0.05)。治疗前,*1/*1基因型患者的尿酸、血肌酐、丙氨酸转氨酶、天冬氨酸转氨酶、C反应蛋白水平与*1/*3+*3/*3基因型患者比较差异均无统计学意义(P>0.05);治疗4周后,*1/*1基因型患者的尿酸、血肌酐、C反应蛋白水平以及*1/*3+*3/*3基因型患者的尿酸、C反应蛋白水平均较治疗前显著降低,且*1/*1基因型患者尿酸水平显著低于*1/*3+*3/*3基因型患者(P<0.05或P<0.01);不同基因型患者治疗前后丙氨酸转氨酶、天冬氨酸转氨酶水平均无明显变化(P>0.05),且在正常范围内,治疗过程中未见肝功能严重异常者。结论:CYP2C9*3基因*1/*1基因型痛风患者使用苯溴马隆降尿酸的疗效较*1/*3、*3/*3基因型更好;而该基因多态性与该药肝毒性可能不相关。
关键词 CYP2C9*3;基因多态性;痛风;苯溴马隆;临床疗效;肝毒性
中图分类号 R966 文献标志码 A 文章编号 1001-0408(2021)06-0725-04
ABSTRACT OBJECTIVE: To study the effects of CYP2C9*3 gene polymorphism on therapeutic efficacy of benzbromarone in lowering uric acid and its hepatotoxicity. METHODS: A retrospective study was conducted to analyze the relevant clinical indicators and genotypes of 196 gout patients who received benzbromarone and CYP2C9*3 gene polymorphism test in Wuhan third hospital from Jan. 2018 to Sept. 2019. RESULTS: Among 196 patients, 179, 15 and 2 patients with CYP2C9*3 genotypes *1/*1, *1/*3 and *3/*3 genotypes were found, respectively, and the distribution of each genotype was in line with Hardy-Weinberg balance (P>0.05). Before treatment, there were no significant differences in the levels of UA, Scr, ALT, AST and CRP between *1/*1 genotype and *1/*3+*3/*3 genotype (P>0.05). After 4 weeks of treatment, the UA, Scr, CRP levels of patients with *1/*1 genotype as well as the UA and CRP levels of patients with *1/*3+*3/*3 genotype were significantly reduced, the UA level of patients with *1/*1 genotype was significantly lower than that of patients with *1/*3+*3/*3 genotype (P<0.05 or P<0.01). The ALT and AST levels had no obvious changes in patients with different genotype before and after treatment, and they were in the normal range. No serious abnormal liver function was observed during the treatment. CONCLUSIONS: Therapeutic efficacy of benzbromarone in lowering uric acid in gout patients with CYP2C9*3 genotypes *1/*1 genotype is better than that of *1/*3 and *3/*3 genotypes. However, the gene polymorphism may be not associated with its hepatotoxicity.
KEYWORDS CYP2C9*3; Gene polymorphism; Gout; Benzbromarone; Clinical efficacy; Hepatotoxicity
痛風是由单钠尿酸盐沉积在骨关节、肾脏、皮下等部位所引发的急、慢性炎症和组织损伤性疾病,与嘌呤代谢紊乱等相关[1]。目前,国内通过降低尿酸治疗痛风的药物主要分为两大类,即促进尿酸排泄药物和抑制尿酸生成药物。苯溴马隆(Benzbromarone)属于促进尿酸排泄药物,为苯并呋喃衍生物,可通过抑制肾小管对尿酸的重吸收而起到降尿酸的作用,具有疗效显著、不良反应少等特点,临床应用广泛[2-3]。体内外研究表明,细胞色素P4502C9(CYP2C9)酶是参与苯溴马隆体内代谢的关键酶,CYP2C9*3(rs1057910)等位基因机体突变可改变CYP2C9酶结构,使酶活性降低,进而减弱机体对苯溴马隆的代谢能力,增加不良反应发生的潜在风险[4-5]。此外,近年来相继有苯溴马隆引起严重肝损伤并致死的个案报道[6-7]。可见CYP2C9*3基因多态性可能是影响苯溴马隆疗效及其不良反应的重要因素。基于此,本研究通过回顾性研究方法,分析了武汉市第三医院196例汉族痛风患者CYP2C9*3基因多态性对苯溴马隆降尿酸疗效及其肝毒性的影响,旨在为苯溴马隆的合理使用提供参考。
1 资料与方法
1.1 研究对象
收集武汉市第三医院2018年1月-2019年9月服用苯溴马隆并行CYP2C9*3基因多态性检测的汉族痛风患者。纳入标准:(1)符合痛风的临床诊断标准[8],经临床诊断为痛风;(2)汉族,相互无血缘关系,年龄>18周岁;(3)使用苯溴马隆片(德国Sano Arzneimittelfabrik GmbH,由昆山龙灯瑞迪制药有限公司分装,国药准字J20180056,规格每片50 mg)作为唯一降尿酸药物,用量均为每次1片,每天1次;(4)住院期间行CYP2C9*3基因分型检测;(5)入院就诊2周前未使用其他降尿酸药物以及促尿酸排泄类药物和抑制尿酸生成药物。排除标准:(1)心、肝、肾功能严重功能异常者;(2)血液性疾病、恶性肿瘤及其他自身免疫性疾病者;(3)妊娠期或哺乳期乳女;(4)苯溴马隆服用时间少于4周者;(5)苯溴马隆过敏者。本研究经武汉市第三医院伦理委员会审查通过(批件号为武三医伦KY2020-081),取样前所有患者均签署知情同意书。
1.2 临床资料收集
收集纳入患者的临床资料进行回顾性分析。临床资料包括年龄、性别、合并疾病种类以及尿酸、尿素氮、血肌酐、丙氨酸转氨酶、天冬氨酸转氨酶、总胆固醇、三酰甘油、高密度脂蛋白、低密度脂蛋白、C反应蛋白等实验室检测指标。
1.3 CYP2C9*3(rs1057910)基因多态性检测
参考文献[9],采用熒光染色原位杂交技术进行检测。抽取患者外周静脉血2 mL于乙二胺四乙酸(EDTA)抗凝管中,混匀后取200 μL于EP管中,加入红细胞裂解液[1×NH4Cl,北京华夏时代基因科技发展有限公司,批号20171104、20180312、20180816、20190121、20190703(由于产品保质期仅半年,所以有多个批号的产品,下同)]1 000 μL,混匀后静置5 min至澄清透明。将上述混合液以3 300 r/min离心5 min,吸去上清液,得下层白细胞沉淀,以细胞裂解液洗涤沉淀2~3次,静止1 min,吸去上清液,加入核酸纯化试剂(北京华夏时代基因科技发展有限公司,批号20171222、20180606、20181122、20190406)30 μL,混匀。取上述待测混悬液1.5 μL加至CYP2C9*3(rs1057910)测序反应试剂(北京华夏时代基因科技发展有限公司,批号20171225、20180613、20181129、20190413)中,封管标记,混匀后使用TL998A型基因扩增荧光检测仪(西安天隆科技有限公司)进行检测,根据CYP2C9*3(rs1057910)位点相应质控品进行基因分型判读。
1.4 统计学方法
采用SPSS 22.0软件对数据进行统计分析。以Kolmogorov-Smirnov检验进行正态分布检验,符合正态分布的计量资料以x±s表示,两组间比较采用t检验;不符合正态分布的计量资料以M(P25,P75)表示,独立组间比较采用Mann-Whitney U检验,配对组间比较采用Wilcoxon符号秩检验。计数资料以例数或率表示,采用χ 2检验。采用χ 2检验分析CYP2C9*3基因型分布是否符合Hardy-Weinberg遗传平衡定律。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料
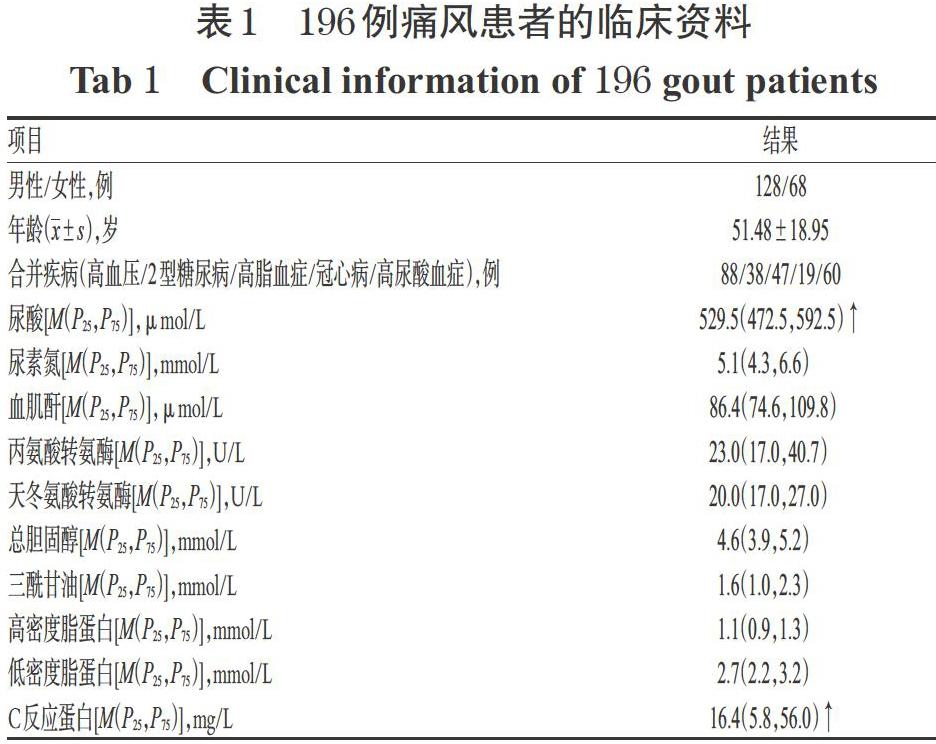
共纳入患者196例,其中男性128例、女性68例,年龄19~90岁、平均年龄(51.48±18.95)岁。纳入患者除尿酸、C反应蛋白水平均高于正常范围外,其余指标都在正常范围内。196例痛风患者的临床资料见表1(表中,由于同一患者可能合并多种疾病,故其合计值>196例;↑表示高于正常范围,下同)。
2.2 CYP2C9*3基因型分布和等位基因频率
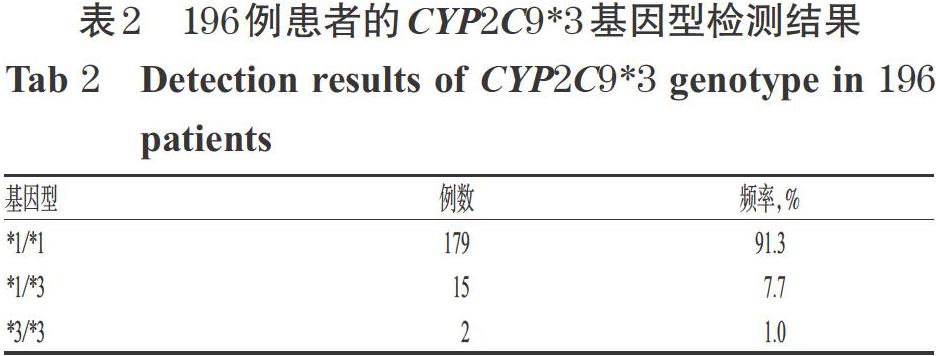
本研究测得的CYP2C9*3基因型包括纯合野生型 *1/*1、杂合突变型*1/*3、纯合突变型*3/*3。196例患者中,*1/*1基因型179例(占91.3%)、*1/*3基因型15例(占7.7%)、*3/*3基因型2例(占1.0%),基因型分布符合Hardy-Weinberg遗传平衡定律(P>0.05);CYP2C9*3等位基因突变频率为4.8%。196例患者的CYP2C9*3基因型检测结果见表2。
2.3 苯溴马隆治疗前后临床指标比较
196例痛风患者使用苯溴马隆连续治疗4周后,其尿酸、血肌酐、C反应蛋白水平均较治疗前均显著降低(P<0.01),而丙氨酸转氨酶、天冬氨酸转氨酶水平与治疗前比较差异均无统计学意义(P>0.05)。196例痛风患者使用苯溴马隆治疗前后临床指标比较见表3。
2.4 CYP2C9*3基因多态性对苯溴马隆治疗痛风患者疗效的影响
本研究中,*3等位基因等位基频率较低,且*1/*3基因型与*3/*3基因型均为突变型基因,故合并为一组,与*1/*1基因型患者进行治疗前后临床指标比较,以初步评价基因多态性对苯溴马隆疗效的影响。治疗前,*1/*1基因型患者的各临床指标与*1/*3+*3/*3基因型患者比较差异均无统计学意义(P>0.05)。治疗4周后,*1/*1基因型患者的尿酸、血肌酐、C反应蛋白水平以及*1/*3+*3/*3基因型患者的尿酸、C反应蛋白水平均显著降低(P<0.05),其中*1/*1基因型患者的尿酸水平显著低于 *1/*3+*3/*3基因型患者(P<0.05),其余指标差异均无统计学差异(P>0.05)。CYP2C9*3不同基因型痛风患者使用苯溴马隆治疗前后的临床指标比较详见表4。
3 讨论
CYP2C是CYP酶亚家族成员,由位于人染色体10q24上的CYP2C8、CYP2C9、CYP2C18和CYP2C19基因编码而成,其中,CYP2C9酶约占CYP2C亚家族整个细胞表达的50%,并参与15%~20%药物的氧化代谢和消除,包括抗凝药(华法林)、降压药(氯沙坦和缬沙坦)等[10-11]。
CYP2C9有多个等位基因,最常见的发生突变的等位基因是CYP2C9*2(rs1799853)和CYP2C9*3(rs1057910)型。*2等位基因常见于欧洲人群,而在亚洲人群中非常罕见;*3等位基因则常见于亚洲人群和非洲人群[12]。基于此,本研究采用荧光染色原位杂交技术,对196例痛风患者CYP2C9*3基因型进行分析。结果,共检测出*1/*1野生型、*1/*3及*3/*3突变型3种基因型,各基因型分布均符合Hardy-Weinberg遗传平衡定律,表明检测样本具有群体代表性,可用于基因多态性的分析研究。此外,196例患者中,91.3%为*1/*1基因型;突变的主要基因型为*1/*3,该基因型分布频率为7.7%。He等[13]对3 200余例汉族人群CYP2C9基因多态性进行研究,结果显示,91.2%的人群为*1/*1野生型,CYP2C9*3发生突变的主要基因型为*1/*3,该基因型分布为8.04%。本研究结果与上述研究结果接近。另有研究显示,在日本、韩国、越南、印尼、泰国,CYP2C9*3发生突变的主要基因型为*1/*3,突变频率分别为4.45%~7.75%[14]。本研究所测*1/*3基因型分布频率与这些亚洲国家接近,提示本研究纳入患者的CYP2C9*3基因多态性分布与我国汉族人群基本一致且符合亚洲人群分布特征。
Uchida等[5]对20例携带CYP2C9*3基因型的日本健康受试者的苯溴马隆药动学参数进行分析,结果显示, *3/*3基因型受試者血浆中苯溴马隆的AUC0-24 h和t1/2均显著高于或长于*1/*1基因型受试者,表观清除率显著低于*1/*1基因型受试者,提示CYP2C9*3基因多态性可能影响苯溴马隆的体内代谢,存在引发毒性的风险。林令华等[15]对20例携带CYP2C9*3基因型的中国健康受试者进行苯溴马隆药动学试验,结果显示,苯溴马隆在CYP2C9*1/*3和*3/*3基因型受试者体内的tmax较*1/*1基因型受试者延迟约4 h,*1/*3和*3/*3基因型受试者的cmax、t1/2、AUC0-24 h均显著高于或长于*1/*1基因型受试者,提示CYP2C9*1/*3和*3/*3基因型受试者的代谢明显低于*1/*1基因型。本研究结果显示,治疗前,CYP2C9*1/*1基因型患者的各临床指标与*1/*3+ *3/*3基因型患者比较差异均无统计学意义(P>0.05),提示不同基因型患者的临床指标具有可比性。治疗4周后,所有患者的尿酸、血肌酐、C反应蛋白水平均显著低于治疗前(P<0.01),其中CYP2C9*1/*1基因型患者的尿酸水平显著低于*1/*3+*3/*3基因型患者(P<0.05),提示苯溴马隆治疗痛风临床疗效良好,CYP2C9*1/*1基因型患者可能对该药的应答性更好。
已有研究表明,CYP2C9等位基因发生突变时,酶活性降低,易产生药物毒性[16]。2015年,国家食品药品监督管理总局药品不良反应信息通报提示,应警惕苯溴马隆的肝损害风险[17-18]。基于此,本研究比较了196例痛风患者使用苯溴马隆治疗前后的丙氨酸转氨酶、天冬氨酸转氨酶水平变化情况,发现所有患者的上述指标水平均无明显变化,且均在正常范围内,治疗过程中也未发现肝功能严重异常者。这提示本研究中苯溴马隆未对患者的肝功能造成明显影响。目前,苯溴马隆肝毒性的机制尚不明确,有多项研究提示CYP2C9基因多态性减弱了苯溴马隆的代谢,使患者发生严重肝毒性的风险升高[7,19],但我国关于苯溴马隆肝毒性致死的案例并不多见,这可能与我国CYP2C9*3基因发生突变的频率较低、苯溴马隆因慢代谢而对肝毒性产生的影响较小有关。关于苯溴马隆肝毒性严重程度与各种族的CYP2C9基因多态性是否存在相关性有待进一步研究。
综上所述,CYP2C9*3基因多态性影响了痛风患者苯溴马隆降尿酸的疗效,其中CYP2C9*1/*1基因型患者对苯溴马隆的应答更好;此基因多态性与该药肝毒性可能不相关。建议在使用苯溴马隆治疗痛风及相关疾病前可考虑行CYP2C9*3基因检测,对于CYP2C9*3突变基因携带者(*1/*3+*3/*3基因型),可使用其他降尿酸药物进行替代。由于本研究为回顾性研究,样本量有限,CYP2C9*3基因多态性与苯溴马隆治疗痛风的疗效及其肝毒性的相关性有待进一步扩大样本量进行前瞻性研究。
参考文献
[ 1 ] 王蕾明,卢立芹,徐瑾.苯溴马隆治疗痛风伴高尿酸血症对患者肾功能的影响及血清BUA水平变化与预后的相关性分析[J].湖南师范大学学报(医学版),2020,17(4):109-112.
[ 2 ] LIN HC,DAIMON M,WANG CH,et al. Allopurinol,benzbromarone and risk of coronary heart disease in gout patients:a population-based study[J]. Int J Cardiol,2017,233:85-90.
[ 3 ] ROOS NJ,DUTHALER U,BOUITBIR J,et al. The uricosuric benzbromarone disturbs the mitochondrial redox homeostasis and activates the NRF2 signaling pathway in HepG2 cells[J]. Free Radic Biol Med,2020,152:216-226.
[ 4 ] HE LI,LI C,LIU XY,et al. Comparative study on the interaction between 3 CYP2C9 allelic isoforms and benzbromarone by using LC-MS/MS method[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2017,1070:97-103.
[ 5 ] UCHIDA S,SHIMADA K,MISAKA S,et al. Benzbromarone pharmacokinetics and pharmacodynamics in différent cytochrome P450 2C9 genotypes[J]. Drug Metab Pharmacok,2010,25(6):605-610.
[ 6 ] ZHANG MY,NIU JQ,WEN XY,et al. Liver failure associated with benzbromarone:a case report and review of the literature[J]. World J Clin Cases,2019,7(13):1717- 1725.
[ 7 ] 梁华玉,王育琴.苯溴马隆肝毒性机制的研究进展[J].药物不良反应杂志,2016,18(4):286-289.
[ 8 ] NEOGI T,JANSEN TLTA,DALBETH N,et al. 2015 Gout classification criteria:an American College of Rheumatology/European League Against Rheumatism collabo- rative initiative[J]. Ann Rheum Dis,2015,74(10):1789- 1798.
[ 9 ] 任丹阳,涂彩霞,李惠英,等. ADRB2(rs1042713)基因多态性对抗胆碱能药物治疗难治性哮喘患儿疗效的影响[J].中国药房,2019,30(23):3265-3270.
[10] AHMED S,ALTAF N,EJAZ M,et al. Genetic variations in the drug metabolizing enzyme,CYP2E1,among va- rious ethnic populations of Pakistan[J]. PeerJ,2020,8(5):e9721.
[11] LEON-MORENO LC,SALDANA-CRUZ AM,SANCHEZ-CORONA J,et al. Distribution of potential risk alleles and haplotypes of the CYP2C9 and CYP2C19 genes in Mexican native populations:a comparative study among Amerindian populations[J]. Meta Gene,2019,20:100565.
[12] ZHOU Y,INGELMAN-SUNDBERG M,LAUSCHKE VM. Worldwide distribution of cytochrome P450 alleles:a meta-analysis of population-scale sequencing projects[J].Clin Pharmacol Ther,2017,102(4):688-700.
[13] HE L,CHEN SJ,LI JG,et al. Genetic and phenotypic frequency distribution of CYP2C9,CYP2C19 and CYP2D6 in over 3200 Han Chinese[J]. Clin Exp Pharmacol P,2020,47(10):1659-1663.
[14] DORJI PW,TSHERING G,NA-BANGCHANG K.CYP2C9,CYP2C19,CYP2D6 and CYP3A5 polymorphisms in South-East and East Asian populations:a sy- stematic review[J]. J Clin Pharm Ther,2019,44(4):508- 524.
[15] 林令华,孙守兵. CYP2C9基因多态性对苯溴马隆药动学的影响[J].中国新药与临床杂志,2011,30(10):759-762.
[16] PHUONG VN,HUYEN MTT,BICH TNT,et al. Polymorphic analysis of CYP2C9 gene in Vietnamese population[J]. Mol Biol Rep,2018,45(5):893-900.
[17] TOMOYUKI O,RYUTARO U,YUMINA K,et al. Synthesis of novel benzbromarone derivatives designed to avoid metabolic activation[J]. Bioorg Med Chem Let,2018,28(23):3708-3711.
[18] 国家食品药品监督管理总局. CFDA:警惕苯溴马隆的肝损害风险[J].上海医药,2015,36(5):39.
[19] ROBERTS RL,WALLACE MC,WRIGHT DFB,et al.Frequency of CYP2C9 polymorphisms in Polynesian people and potential relevance to management of gout with benzbromarone[J]. Joint Bone Spine,2014,81(2):160- 163.
(收稿日期:2020-11-25 修回日期:2021-02-17)
(編辑:邹丽娟)

