食品中沙门氏菌FTA膜结合跨越式滚环等温扩增检测方法的建立
庄梦晴,张先舟,卢鑫,郭威,马晓燕,张伟,,3
(1.河北农业大学食品科技学院,河北保定 071001)(2.河北农业大学理工学院,河北沧州 061100)(3.河北农业大学生命科学学院,河北保定 071001)
沙门氏菌是一种人畜共患的致病菌。由沙门氏菌引起的食品中毒大多是由于其穿透胃肠粘膜致使细胞死亡造成的[1],根据临床表征可以分为胃肠炎型、类伤寒型、类霍乱型、类感冒型和败血症型[2]。在所有食源性致病菌引起的食物中毒事件中,沙门氏菌引起的食品安全事件居首位,具有高检出率、高发病率和高死亡率的特点[3]。数据调查发现,全球各个国家均存在不同程度的沙门氏菌污染问题[4,5],由此引发的沙门氏菌相关疾病,对公众安全产生了严重的威胁,造成了巨大的经济损失[6]。
微生物的传统培养方法检测时间较长,对实验操作人员、周围背景及设备的无菌环境都有很高的要求,并且无法实现现场检测[7]。当细菌处于活的不可培养(Viable but non culturable,VBNC)状态时,会造成结果误判[8]。免疫学方法特异性抗体的制备复杂[9],当出现抗原或抗体的相似结构时,会影响检测的特异性和重复性[10],甚至造成最终结果的误判[11]。随着核酸体外扩增技术的不断发展,逐步建立了聚合酶链式反应(Polymerase chain reaction,PCR)[12]、多重PCR(Multiplex PCR)[13]、实时荧光定量PCR(Quantitative real-time PCR,qPCR)[14]等变温扩增技术,这些技术均需要复杂的热循环系统,仪器昂贵,限制了其在基层现场检测中的应用。为克服上述技术的缺点,研究人员创新性的发展了滚环扩增(Rolling circle amplification,RCA)和环介导等温扩增(Loop-mediated isothermal amplification,LAMP)等核酸等温扩增技术。但是,RCA技术需要锁式探针、连接酶和探针环化过程,反应时间较长(约4 h)[15];LAMP技术存在引物设计复杂、需要多对引物[16]、产物间易相互作用造成非特异扩增[17]、无法通过测序验证扩增结果的正确性等问题。
近年来,本研究团队发现了跨越式滚环等温扩增(Saltatory rolling circle amplification,SRCA)新方法,并逐渐在致病菌检测领域实现应用[18-20]。该方法仅需一对引物,在恒温条件下依靠BstDNA聚合酶即可实现线性DNA的扩增。原理如图1所示。正向引物(Forward primer,FWP)与模板DNA结合后,按照引物 5"→3"方向延伸,当延伸至模板链的 5"端时,在BstDNA聚合酶作用下通过添加若干个核苷酸跨过线性DNA两端的缺口,继而将先前合成的互补链置换下来,继续如“滚环”般循环往复的扩增。先前合成的互补链不断延伸,暴露出越来越多的反向引物(Reverse primer,RVP)结合位点,RVP与之结合并进行延伸。周而复始,最终得到许多不同长度的串联重复线性双链DNA。
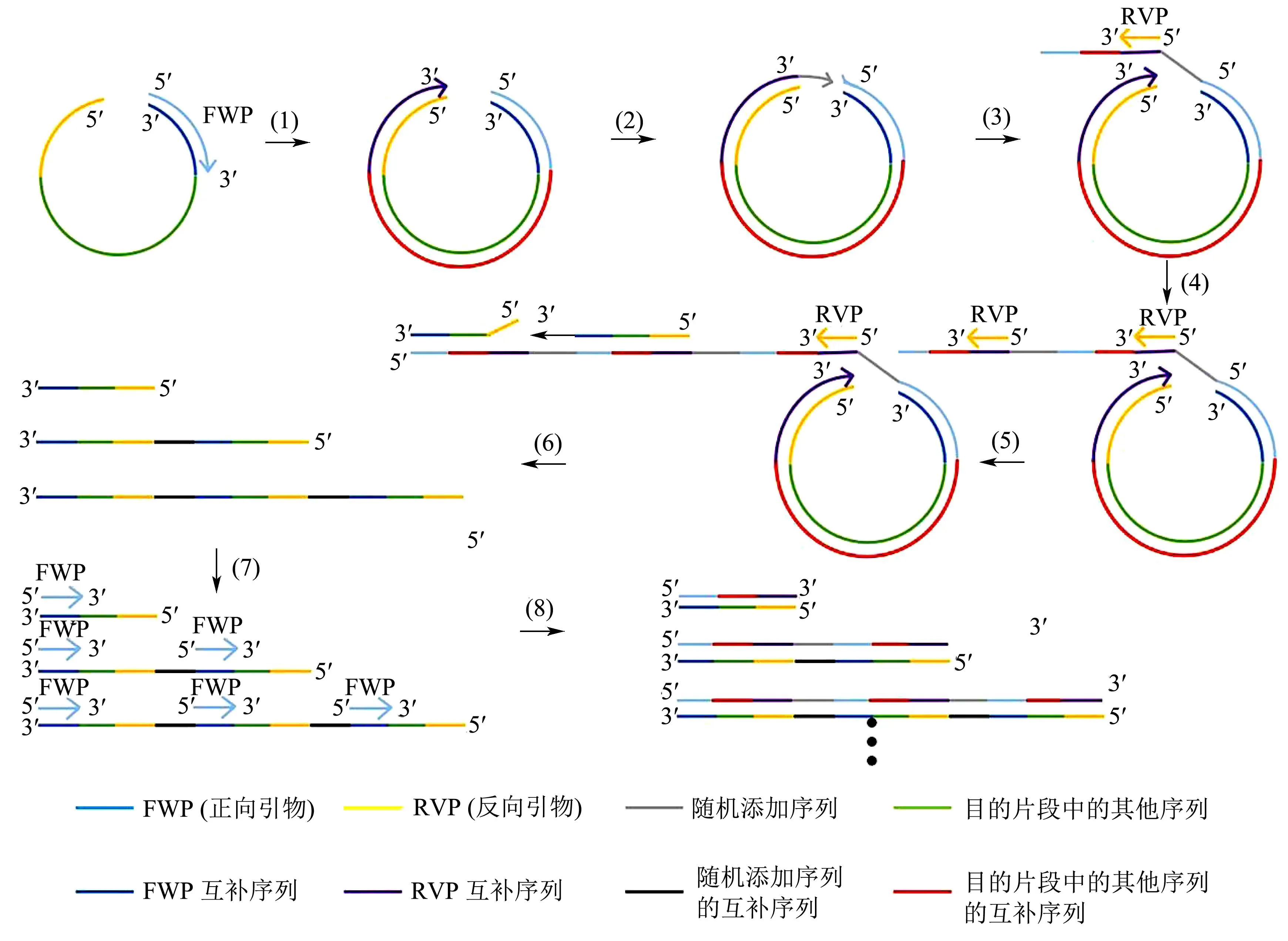
图1 SRCA反应原理图Fig.1 The schematic diagram of SRCA assay
FTA膜(Flinders technology associates,FTA)是经特殊的螯合剂和变性剂处理的棉纤维卡片,作为Whatman公司的一项专利技术创新性的应用于室温下核酸的采集、运输、纯化和储存[21]。当细胞接触FTA膜时,细胞膜裂解,核酸暴露同时被吸附固定在FTA膜上,经特定纯化试剂和缓冲溶液的洗涤干燥,即可直接作为模板。洗脱前后电镜图如图2所示。该方法操作简单,大大节省了检测时间和检测成本。FTA技术已经广泛应用于人类DNA处理、法医学、野生动植物DNA样品、食源性致病菌、寄生虫和病原体的检测中[22,23]。
本研究利用FTA膜吸附固定核酸的方法快速提取模板DNA,根据沙门氏菌的invA基因设计及筛选引物,向扩增产物中加入荧光染料进行结果的判定。扩增反应在凹孔板中进行,从而有望实现食品中沙门氏菌的大批量集约化快速检测。
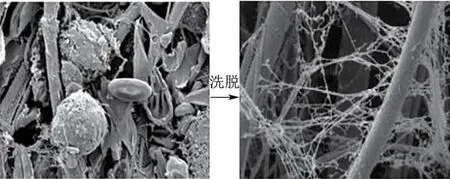
图2 FTA膜洗脱前后电镜图Fig.2 Electron micrographs of FTA card before and after elution
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
本研究选取46株菌株作为研究对象,其中17株为沙门氏菌,29株为非沙门氏菌,进行引物特异性的探究。研究所需菌种如表1所示。
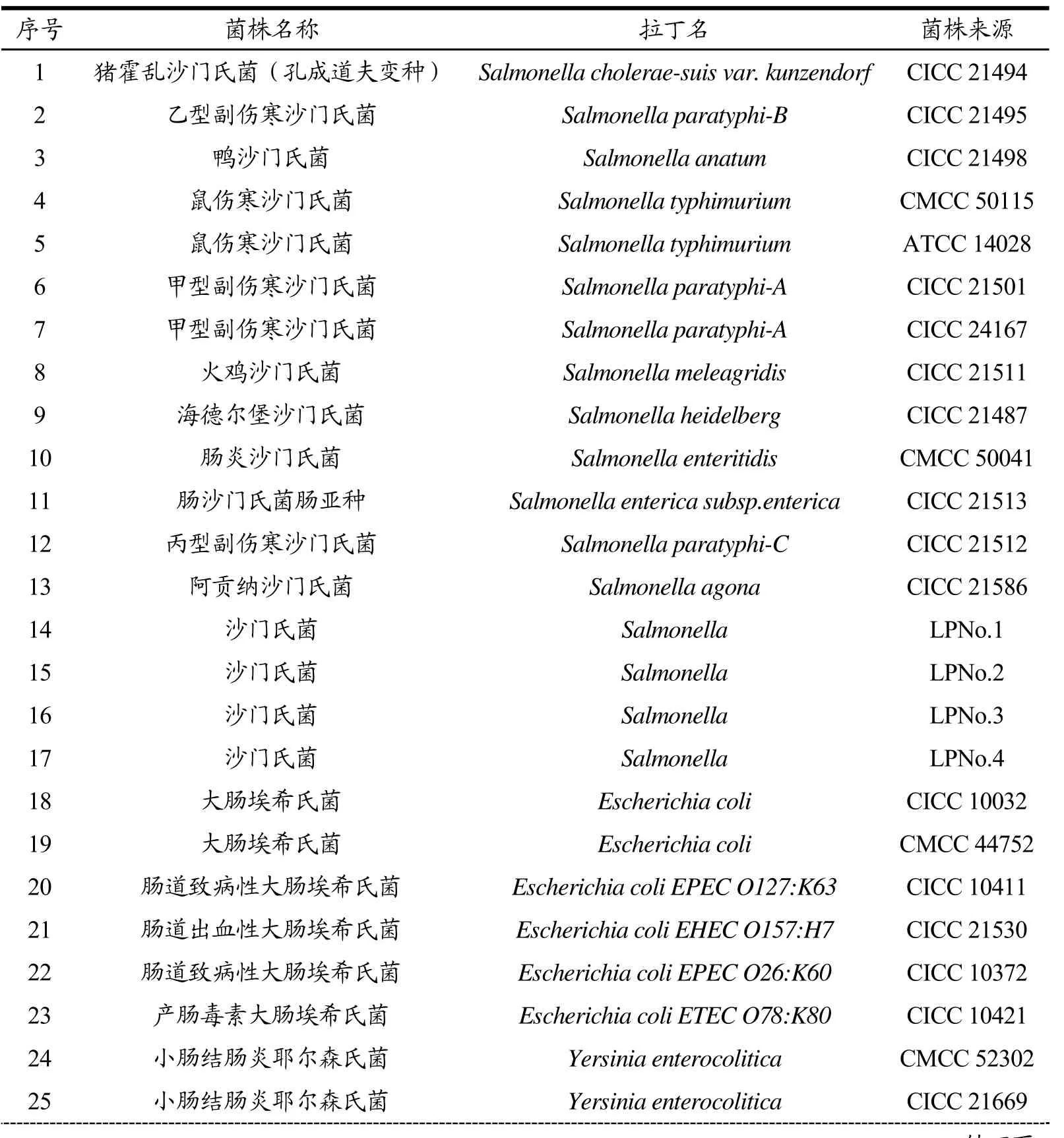
表1 本研究所用菌种Table 1 Bacterias in this study
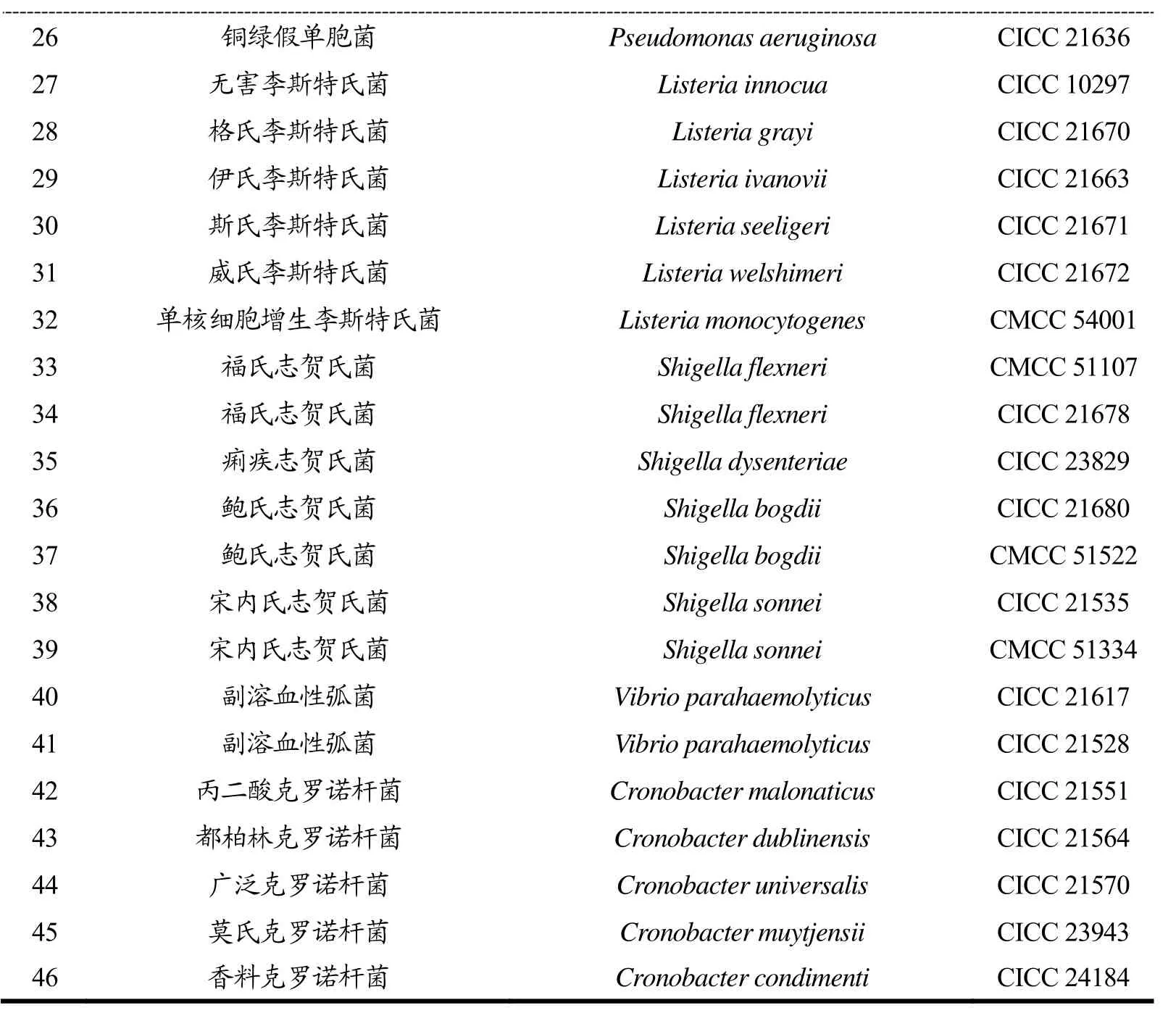
注:ATCC:美国模式菌种收集中心(America Type Culture Collection);CMCC:中国医学细胞保藏管理中心(China Medical Culture Collection);CICC:中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection);LP:实验室保藏。

表2 沙门氏菌invA基因的引物Table 2 Primers of invA gene in Salmonella
1.1.2 材料与试剂
引物,华大基因公司;6×DNA Loading Buffer、dNTPs Mixture,北京博迈德公司;SYBR Green I(10,000×)、TE缓冲液(pH 8.0),北京索莱宝公司;2×TaqPCR Master Mix,北京全式金生物技术公司;BstDNA聚合酶、DNA Marker DL2000,大连宝生物公司;FTA膜、FTA纯化试剂,Whatman公司。
检测的食品样品包括肉类38份,蛋类8份,奶类14份,共计60份。
1.1.3 仪器与设备
2720 Thermal cycler核酸扩增仪,美国 Applied biosystems公司;DYY-8C电泳仪,北京六一仪器厂;JY04S-3E凝胶成像分析系统,北京乾明基因技术有限公司;DK-8D三孔电热恒温水槽,上海一恒科学仪器有限公司。
1.2 试验方法
1.2.1 菌株的培养
挑取鼠伤寒沙门氏菌(CMCC 50115)菌株传代培养3次。挑取典型单菌落接种到营养肉汤中,37 ℃过夜培养,使菌体富集,用以提取基因组DNA。
1.2.2 基因组DNA的提取
通过试剂盒法以及 FTA膜法进行沙门氏菌基因组 DNA的提取。试剂盒法按照操作说明进行提取DNA。FTA膜法:取40 μL过夜培养的菌液滴加至2.00 mm的FTA膜上,55 ℃~60 ℃干燥10 min,FTA纯化试剂冲洗2次,TE缓冲液冲洗2次,55 ℃~60 ℃干燥10 min,将得到的吸附有沙门氏菌基因组DNA的FTA膜直接作为反应的模板。
1.2.3 引物的设计与筛选
本研究选择沙门氏菌高度特异性和保守性的invA基因进行引物设计[14,24]。通过使用 Primer 5.0和DNAMAN软件设计沙门氏菌的特异性引物,引物序列如表2所示。
1.2.4 FTA-SRCA、SRCA和PCR的反应体系和反应条件
FTA-SRCA的反应体系为:2.00 μL正反向引物(0.50 μM),12.00 μL dNTPs(0.75 mM),3.00 μL l0×Thermopol Reaction Buffer(0.75×),6.00 μL Mg2+(3.00 mM),2.00 μLBstDNA聚合酶(大片段),无菌去离子水补足至40 μL。62 ℃反应30 min,80 ℃灭酶5 min。向扩增产物中滴加2.00 μL SYBR GreenI(50×)染料进行颜色观察,从而实现结果的判定。
SRCA的反应条件与FTA-SRCA反应相同,在FTA-SRCA反应体系的基础上,增加了 3.00 μL模板DNA(3.10 ng/μL)。结果通过凝胶电泳法进行观察。
PCR反应引物与SRCA方法相同。PCR的反应体系为:11.00 μL 2×EasyTaq PCR SuperMix,1.00 μL 正反向引物(0.50 μM),1.00 μL 模板 DNA(3.10 ng/μL),无菌去离子水补足至25 μL。反应程序:95 ℃预变性5 min;94 ℃变性 45 s,55 ℃退火 45 s,72 ℃延伸 45 s,共30个循环;72 ℃再延伸1 min终止反应。
1.2.5 FTA-SRCA扩增反应的测序分析
反应产物进行凝胶电泳后,按照胶回收试剂盒操作说明进行纯化,并按照基因克隆试剂盒操作说明进行连接转化,将菌液送至测序公司进行测序。
1.2.6 引物特异性分析
利用FTA膜法提取表1中46株菌的基因组DNA作为模板,分别进行SRCA反应。通过向反应产物中添加荧光染料的方法,进行引物特异性分析。
1.2.7 灵敏度分析
将沙门氏菌菌液十倍梯度稀释后进行平板计数,测得菌液浓度为 6.81×107~6.81×10-1CFU/mL。利用试剂盒法提取不同浓度菌液的模板DNA后,分别利用SRCA和PCR方法进行扩增反应;同时利用FTA膜法提取模板DNA后,进行FTA-SRCA反应,并比较分析三种方法的灵敏度。
1.2.8 人工污染的牛奶样品中沙门氏菌的检出限分析
向已证实不含有沙门氏菌的牛奶样品中加入不同浓度的沙门氏菌菌悬液,均质液中菌液浓度为3.22×107~3.22×10-1CFU/mL。利用试剂盒法提取基因组DNA后,分别进行SRCA和PCR反应;同时利用FTA膜法提取模板DNA后[25],进行FTA-SRCA反应,并比较分析三种方法的检出限。
1.2.9 FTA-SRCA方法的实际应用与评价
为了评估 FTA-SRCA方法在实际样品检测中的可行性以及准确性,本研究对60份样品,分别用PCR方法、SRCA方法、FTA-SRCA方法及国家标准方法GB 4789.4-2016[26]进行检测,计算得到各个方法的敏感性、特异性和符合率[27]。
敏感性=真阳性/(真阳性+假阴性)×100%
特异性=真阴性/(真阴性+假阳性)×100%
符合率=(真阳性+真阴性)/(真阳性+假阴性+真阴性+假阳性)×100%
1.2.10 数据处理
本研究中PCR和SRCA反应结果均通过琼脂糖凝胶电泳图谱分析,FTA-SRCA反应结果通过观察扩增产物的荧光信号颜色变化进行分析。每个实验重复3次。
2 结果与讨论
2.1 FTA-SRCA扩增产物的测序分析
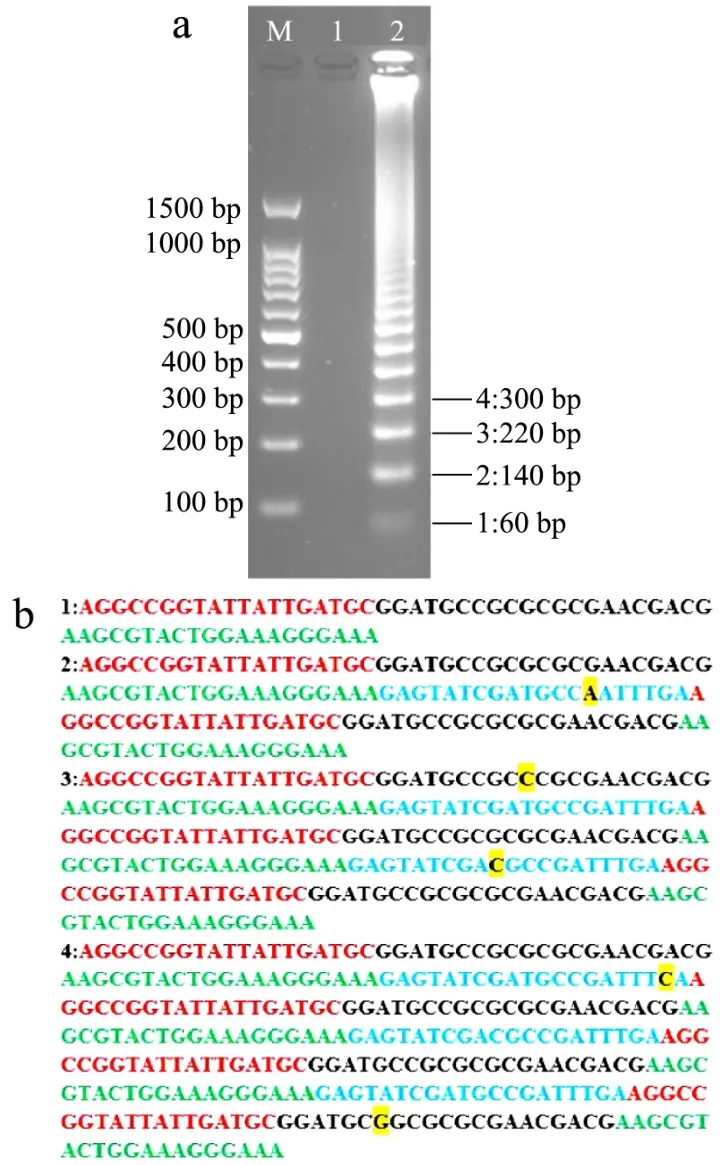
图3 沙门氏菌FTA-SRCA扩增产物测序分析Fig.3 Sequencing analysis of FTA-SRCA amplification products of Salmonella
将FTA-SRCA反应的扩增产物进行测序分析,验证其是否按照SRCA反应原理进行扩增,测序结果如图3所示。由图3a可知,扩增产物呈现明显的梯形条带。由图3b可知,第一条扩增片段长度为60 bp,第二条扩增片段包括两段60 bp长度的目的片段以及添加片段,添加片段为正向引物的上游片段,长度为20 bp,因此,第二条扩增片段的总长度为140 bp。第三条扩增片段包括三段60 bp长度的目的片段以及两段添加片段,总长度为220 bp。以此类推,第四条扩增片段总长度为300 bp。其中,出现的错配基因可能由于扩增反应发生错配造成的。理论结果与实际测得的结果相同,因此,FTA-SRCA方法的扩增结果正确。
2.2 引物特异性分析
本研究共采用46株菌株对引物进行特异性试验,结果如图4所示。17株沙门氏菌均成功扩增,荧光由橙色变为黄绿色;29株非沙门氏菌均没有发生扩增反应,仍为橙色。因此,针对invA基因设计的引物特异性极强,适用于沙门氏菌的检测。
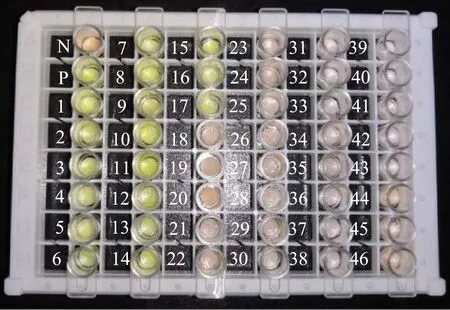
图4 沙门氏菌引物特异性分析Fig.4 The primer specificity analysis of Salmonella
2.3 灵敏度分析
对不同核酸提取方法以及扩增方法进行灵敏度比较分析,结果如图5所示。由图5a可知,利用试剂盒法提取模板进行PCR反应,当菌液浓度降低至6.81×101CFU/mL时不再产生扩增条带。因此,PCR方法的灵敏度为6.81×102CFU/mL。由图5b可知,利用试剂盒法提取模板进行SRCA反应,当菌液浓度降低至 6.81×100CFU/mL时为阴性扩增结果。因此,SRCA方法的灵敏度为6.81×101CFU/mL,比PCR方法高10倍。向FTA-SRCA扩增产物中加入SYBR GreenⅠ荧光染料,由图5c可知,当FTA膜处理的菌液浓度为 6.81×107~6.81×100CFU/mL时,荧光颜色均由橙色变为黄绿色,为阳性结果;当浓度为6.81×10-1CFU/mL时,荧光颜色仍为橙色,为阴性结果。因此,FTA-SRCA方法的灵敏度为 6.81×100CFU/mL。FTA-SRCA方法的灵敏度比PCR方法高100倍,比SRCA方法高10倍。现有研究中,FTA-PCR检测单核细胞增生李斯特氏菌的灵敏度为1.10×102CFU/mL[28],FTA-LAMP检测阪崎肠杆菌的灵敏度为1.00×103CFU/mL[29]。综上所述,FTA-SRCA方法具有更高的灵敏度。
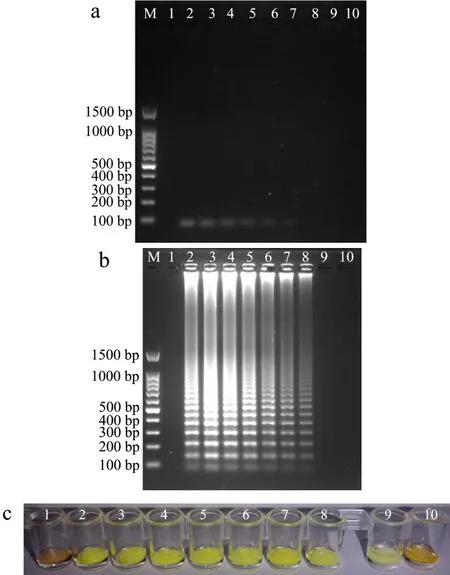
图5 灵敏度分析Fig.5 The sensitivity analysis
2.4 人工污染的牛奶样品中沙门氏菌的检出限分析
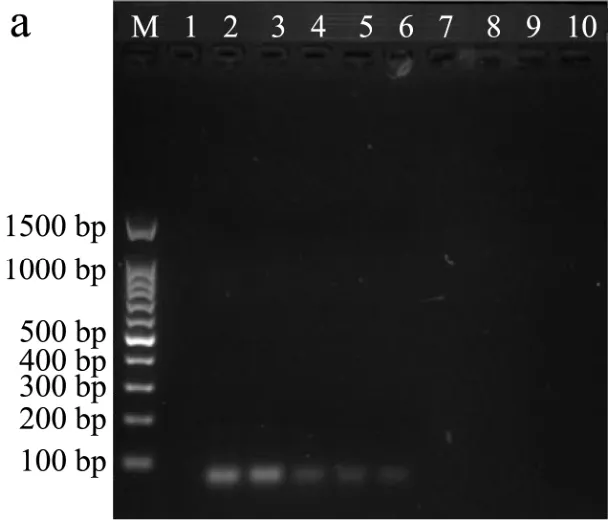

图6 检出限分析Fig.6 The detection limit analysis
分别采用PCR、SRCA和FTA-SRCA方法检测人工污染的牛奶样品中的沙门氏菌,对检出限进行比较分析,结果如图6所示。由图6a可知,当样品中沙门氏菌浓度降低至3.22×102CFU/mL,不再产生扩增条带。因此,PCR方法的检出限为3.22×103CFU/mL。由图6b可知,当样品中沙门氏菌浓度降低至 3.22×100CFU/mL,为阴性扩增结果。因此,SRCA方法的检出限为3.22×101CFU/mL。向FTA-SRCA扩增产物中加入SYBR Green Ⅰ荧光染料,由图6c可知,当样品中沙门氏菌菌液浓度为 3.22×107~3.22×100CFU/mL时,荧光颜色均由橙色变为黄绿色。当浓度为 3.22×10-1CFU/mL时,荧光颜色仍为橙色,为阴性结果。FTA-SRCA方法的检出限为3.22×100CFU/mL,比PCR方法低 1000倍,比SRCA方法低 10倍。已报道的FTA-PCR检测沙门氏菌方法的检出限为 1.00×101CFU/mL[25],FTA-SRCA方法的检出限比其低 1个数量级。原因可能是试剂盒法提取的模板DNA中含有蛋白质、脂肪等抑制因子,对扩增反应产生了抑制作用,大大降低了PCR检测牛奶中沙门氏菌的灵敏程度,故PCR方法的检出限比灵敏度低一个数量级。而因SRCA反应的灵敏度比PCR高,一定程度上抵消了部分抑制作用,故SRCA反应的灵敏度和检出限在同一数量级。FTA膜提取方法一定程度上降低了杂质含量,从而减小了抑制作用[30]。
2.5 FTA-SRCA方法的实际应用与评价
本研究分别用PCR方法、SRCA方法、FTA-SRCA方法及国家标准方法GB 4789.4-2016对60份样品进行检测,结果如表2所示。结果显示,与国标相比,PCR、SRCA和FTA-SRCA方法均出现更多的阳性结果,原因在于传统培养方法灵敏度较低,且不能检测出VBNC状态的菌株,而这些状态的菌体仍具有致病的潜在危害。对分子扩增方法而言,食品中不同状态的沙门氏菌均含有基因组DNA,但其含量有所差异。SRCA扩增方法的灵敏度比PCR高,可以检测的沙门氏菌的检出限更低;对核酸提取方法而言,FTA膜法核酸提取的效果优于试剂盒法,故检测出的阳性结果更多。
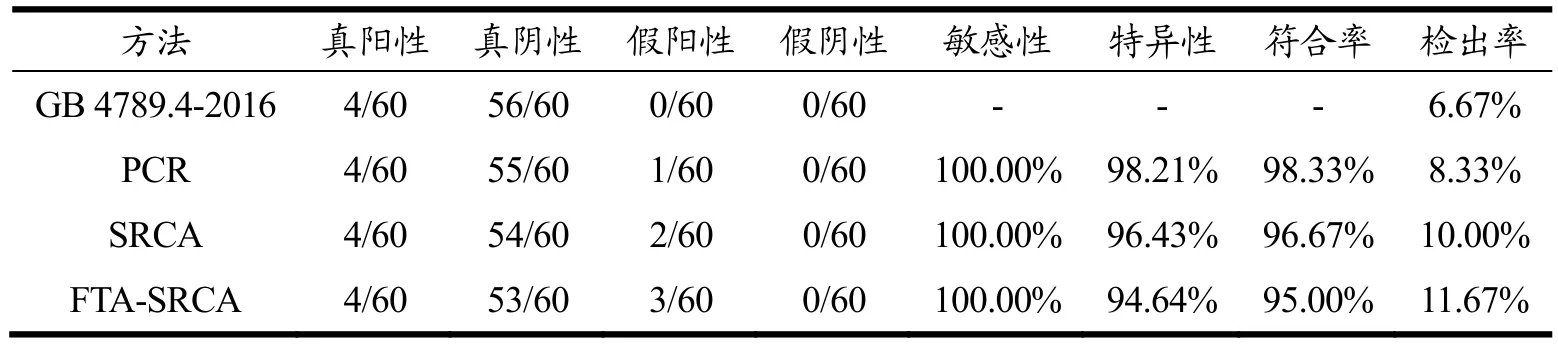
表2 实际样品检测结果Table 2 The results of actual sample detection
3 结论
3.1 本研究建立了一种FTA膜结合跨越式滚环等温扩增技术(FTA-SRCA)检测食品中沙门氏菌的方法。与传统培养方法相比,操作简单,节省了时间和成本;与变温扩增方法相比,无需复杂昂贵的变温仪器,无需对操作人员较高的技术要求;与等温扩增方法LAMP相比,引物设计简单,扩增结果可通过测序验证,利用荧光可视法进行结果的判定,避免了繁琐的电泳过程;与RCA方法相比,无需探针环化过程,节省时间和成本。与试剂盒提取DNA的SRCA方法相比,核酸提取步骤简单,成本降低约1/2,时间减少约3/4,利用凹孔板可实现对大批量样品的集约化快速检测。
3.2 综上所述,本研究建立的检测食品中沙门氏菌的FTA-SRCA方法切实可行。该方法操作简便快速、成本低廉、特异性好、灵敏度高、检测限低。利用FTA膜提取的基因组DNA吸附固定在膜上,经过FTA纯化试剂和TE缓冲液的冲洗,在一定程度上可以消除蛋白质、油脂等杂质对扩增反应的抑制作用的影响。反应在凹孔板中恒温进行,可实现大批量样品的集约化检测。上述优势为该技术在基层检测机构中的应用和推广奠定了基础。
3.3 目前,本研究所建立的 FTA-SRCA方法仅适用于定性检测,试验所用的FTA标准膜将DNA固定在其纤维基质上,导致无法实现定量分析。可采用FTA洗脱膜洗脱DNA,实现FTA-SRCA方法的定量检测。另外,该方法无法区分死活菌,后续研究可将 PMA方法与FTA-SRCA技术相结合,实现死活菌的识别和定量。FTA-SRCA方法也可用于寄生虫、动植物病毒、转基因食品和过敏原等方面的检测,以期扩大本方法的应用范围并实现其应用价值。

