双组分系统CpxR影响禽致病性大肠杆菌的耐药性、抗血清杀菌能力及毒力
易正飞,张耀东,王 瑶,2,朱 红,陶程琳,3,AFAYIBO Dossêh Jean Aptre,李 涛,祁晶晶,田明星,丁 铲,于圣青*,王少辉*
(1. 中国农业科学院上海兽医研究所,上海 200241; 2.西南民族大学生命科学与技术学院,成都 610041; 3.扬州大学兽医学院,扬州 225009)
禽致病性大肠杆菌(avian pathogenicE.coli,APEC)可感染禽类,表现多种不同症状的大肠杆菌病,给养禽业造成重大经济损失。另外,APEC属于肠道外致病性大肠杆菌(extraintestinal pathogenicE.coli, ExPEC),与人源ExPEC中新生儿脑膜炎大肠杆菌(neonatal meningitisE.coli, NMEC)和尿道致病性大肠杆菌(uropathogenicE.coli, UPEC)的基因组结构、遗传进化和生态分布高度相似,且具有类似的毒力因子和致病机制[1-3]。由于抗生素的不合理使用,APEC的耐药性日趋严重。因此,APEC被认为是人源ExPEC毒力基因和耐药基因的贮库,具有重要的公共卫生意义[4]。
病原菌通过复杂的调控网络控制基因适时表达,从而适应环境、促进生存及感染。其中,双组分系统(two component system, TCS)广泛存在于细菌中并参与感知响应环境变化及促进致病性。典型的TCS通常包含位于细菌膜的组氨酸激酶(histidine kinase, HK)感受元件和存在于细胞质中的应答调控(response regulator, RR)元件两部分[5]。另外,一些TCS还含有额外的调控辅助蛋白,在蛋白磷酸化等过程发挥作用。HK感受元件能够感应各种环境信号变化,然后通过磷酸化激活RR并调控靶基因的转录表达,从而改变细菌能量代谢、压力应激等以适应环境[6-9]。CpxA/CpxR是典型的TCS,其中,组氨酸蛋白激酶CpxA作为感受元件将外界信号传递给CpxR发挥转录调控功能[10]。Cpx最早被证实主要在维持细菌膜结构蛋白的正确折叠和组装过程中发挥作用[11]。近年来,研究发现Cpx TCS可以感知细菌膜表面压力变化信号,调控细菌的多种毒力因子,如菌毛、分泌系统,从而有助于细菌快速适应环境,进而参与调控不同细菌的耐药性、抵抗力和毒力[12-15]。
为了探讨Cpx TCS的应答调控元件CpxR对APEC生物学特性和毒力的影响,本文构建了Cpx TCS应答调控元件编码基因cpxR缺失株和基因互补株,比较分析了APEC菌株的生长速度、运动能力、生物被膜形成能力、药物敏感性和抗血清杀菌能力和毒力,为深入研究APEC的致病机制提供参考。
1 材料与方法
1.1 菌株、质粒和实验动物
O2血清型APEC菌株DE719由本实验室分离鉴定,对鸡、鸭及小鼠具有致病性[16];大肠杆菌DH5α购自天根(北京)生化科技有限公司。Red同源重组系统质粒pKD46、pKD3、pCP20由本实验室保存;低拷贝互补质粒pSTV28购自宝生物工程(大连)有限公司。1日龄樱桃谷鸭购自江苏省江阴市某养鸭合作社。
1.2 主要试剂与仪器
质粒提取试剂盒购自天根(北京)生化科技有限公司;PrimeSTAR Mix、DNA Ligation Mix、限制性核酸内切酶购自宝生物工程(大连)有限公司;DNA Marker购自诺维赞生物科技有限公司;L-阿拉伯糖购自Sigma公司;DMEM培养基、胎牛血清购自Gibco公司。PCR仪购自ABI公司;电转化仪购自Bio-Rad公司;电泳仪及凝胶成像系统购自上海天能科技有限公司。
1.3 引物设计
根据APEC DE719菌株cpxR及其上下游基因序列,设计cpxR基因缺失引物、鉴定引物及互补引物(表1),由上海睿勉生物科技有限公司合成。

表1 本研究使用的引物
1.4 cpxR基因缺失株及互补株的构建
根据Red同源重组系统方法[17],构建DE719菌株的cpxR基因缺失株。以pKD3质粒为模板,cpxRMu-F/R为引物,扩增cpxR基因打靶片段。将cpxR基因打靶片段电转化入DE719-pKD46感受态细胞,过夜培养后挑取单克隆,分别以缺失鉴定引物进行PCR及测序鉴定cpxR基因缺失株。然后通过辅助性质粒pCP20去除氯霉素抗性片段,鉴定正确的cpxR基因缺失株,命名为ΔcpxR。PCR扩增cpxR基因及其启动子序列,克隆至pSTV28构建互补质粒pSTV28-cpxR,电转化入缺失株ΔcpxR中,获得互补株CΔcpxR。
1.5 生长曲线与运动性测定
将新鲜菌液DE719、ΔcpxR、CΔcpxR培养至OD600 nm=1,按照1∶100的比例接种至200 mL LB培养基中,置于37 ℃,200 r·min-1条件下振荡培养,每隔1 h取样测定OD600 nm值,绘制生长曲线。将上述菌株培养至OD600 nm=1,取5 μL菌液点样于0.5%琼脂LB平板,37 ℃静置培养12 h,测定菌圈直径,比较不同菌株的运动能力。
1.6 生物被膜形成能力测定
将新鲜菌液稀释至OD600 nm=0.1,每孔200 μL加入到96孔细胞板中,LB培养基作为阴性对照,37 ℃ 静止培养24 h。弃去培养液,用无菌PBS洗3次 后加入200 μL结晶紫溶液染色30 min,再以无菌PBS洗涤5次,自然风干后加入200 μL 95%乙醇充分溶解,测定OD595 nm值。
1.7 最小抑菌浓度(MIC)测定
研究表明,Cpx TCS有助于尿道致病性大肠杆菌、沙门菌对卡那霉素和阿米卡星的耐受性[13, 15, 18-19]。因此,本研究根据CLSI-2018微量肉汤稀释法[20],分析APEC对卡那霉素和阿米卡星的最小抑菌浓度。将新鲜菌液1∶100倍稀释,与不同浓度抗生素混匀,37 ℃培养16 h后判读结果。同时设置不添加抗生素的阳性对照组和LB空白对照组。
1.8 血清杀菌试验
以预冷PBS洗涤新鲜菌液并重悬,调整浓度为108CFU·mL-1,取10 μL菌悬液与190 μL不同浓度SPF鸡血清(100%、50%、25%)混合,对照组为热灭活SPF鸡血清。37 ℃孵育30 min后倍比稀释,涂布LB平板,统计存活细菌数。
1.9 半数致死量(LD50)测定
收集对数生长期细菌,无菌PBS洗涤2次,重悬。分别以1×107、1×106、1×105、1×104、1×103CFU·只-1剂量感染7日龄樱桃谷鸭,每组8只, 连续观察7 d,记录发病及死亡情况,根据改良寇氏法计算半数致死量(LD50)。
2 结 果
2.1 cpxR 基因缺失株及互补株鉴定
分别以缺失株内侧鉴定引物和外侧鉴定引物对cpxR基因缺失株、互补株进行PCR检测。如图1所示,内侧引物鉴定时,野生株和互补株可扩增出458 bp的cpxR基因目的条带,而缺失株无cpxR基因条带;外侧引物鉴定时,野生株扩增片段大小为1 032 bp,而cpxR基因缺失株、互补株扩增片段大小为333 bp目的条带。PCR检测及测序结果表明,cpxR基因缺失株及互补株构建成功。
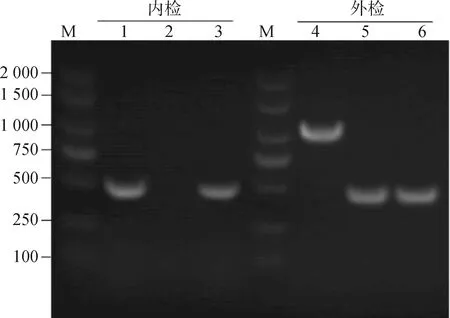
M. DNA相对分子质量标准;1、4. 野生株DE719;2、5. 缺失株ΔcpxR;3、6. 互补株CΔcpxRLane M. DNA marker; Lane 1, 4. Wild-type strain DE719; Lane 2, 5. Mutant strain ΔcpxR; Lane 3, 6. Complemented strain CΔcpxR图1 野生株、缺失株和互补株的PCR鉴定Fig.1 Identification of wild-type, mutant and complemented strains
2.2 生长曲线与运动能力测定
生长曲线和运动能力测定结果显示,DE719、ΔcpxR和CΔcpxR的生长速度和运动性趋于一致,无明显差异(图2),表明CpxR不影响APEC的生长速度和运动能力。
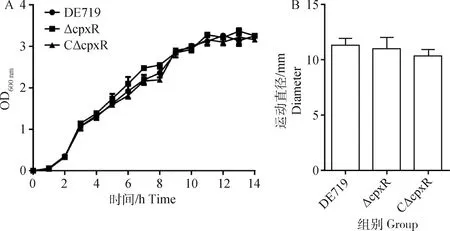
A. 生长曲线;B. 不同菌株在0.5%琼脂上的运动直径A. Growth curves; B. Motility diameter of each strains on 0.5% LB agar图2 APEC生长曲线和运动能力Fig.2 Growth curves and motility assays of APEC
2.3 生物被膜形成能力
生物被膜形成能力测定显示,缺失株ΔcpxR的生物被膜形成能力略有下降,分别为野生株DE719、互补株CΔcpxR的91.5%和96.7%,但无显著性差异(P>0.05,图3),表明CpxR不影响APEC的生物被膜形成能力。
2.4 药物敏感性
微量肉汤稀释法结果显示DE719、ΔcpxR和CΔcpxR对卡那霉素的MIC分别为30、20、50 μg·mL-1; 对阿米卡星的最小抑菌浓度分别为40、20、70 μg·mL-1(表2)。缺失株ΔcpxR对卡那霉素和阿米卡星的敏感性均高于野生株和互补株,表明CpxR有助于降低APEC对卡那霉素和阿米卡星的敏感性。

图3 生物被膜形成能力测定Fig.3 Determination of biofilm formation ability

表2 APEC菌株的最小抑菌浓度
2.5 抗血清杀菌能力
血清杀菌试验结果显示,缺失株ΔcpxR在100%、50%和25%SPF鸡血清中存活率均显著低于野生株(P<0.05),互补株的存活率恢复至野生株水平。APEC在灭活血清中的存活率均无明显差异(图4)。结果表明,CpxR促进APEC的抗血清杀菌能力。

图4 抗SPF鸡血清杀菌能力Fig.4 Resistance to bactericidal activities of SPF chicken serum
2.6 半数致死量(LD50)测定
雏鸭感染试验结果显示,野生株DE719、缺失株ΔcpxR和互补株CΔcpxR的LD50分别为7.50×105、7.50×106、1.33×106CFU·只-1。与野生株相比,缺失株的毒力降低10倍,而互补株的致病力部分恢复。另外,作者前期研究发现,缺失株ΔcpxR感染组的雏鸭发病及死亡慢,且其临床症状、病理变化及组织载菌量均低于野生株和互补株感染组雏鸭[21],表明CpxR有助于APEC的感染及毒力。
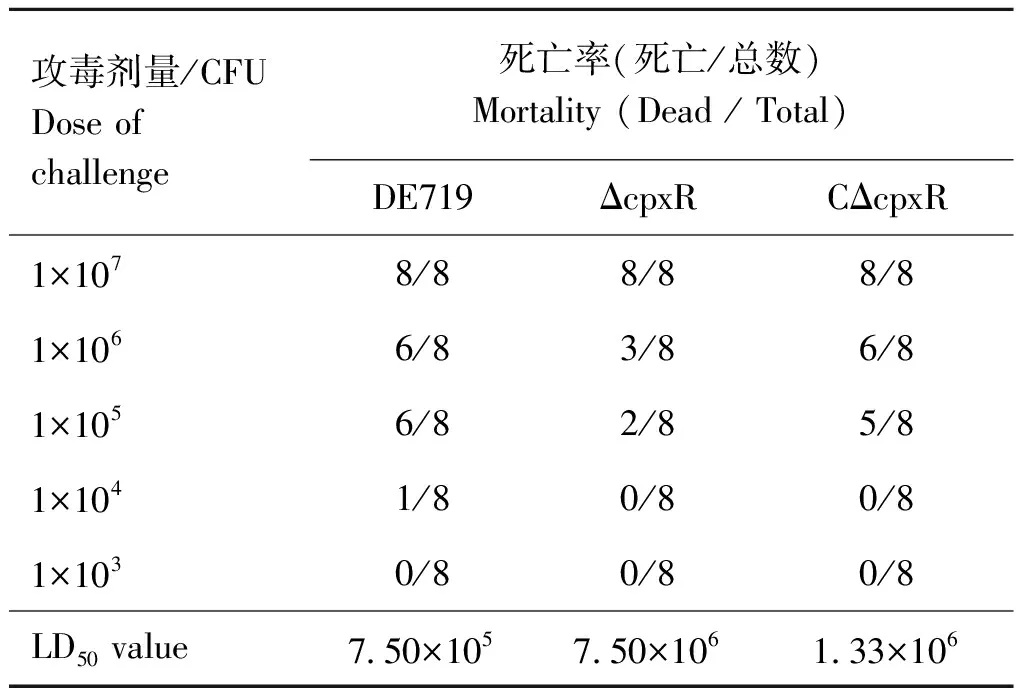
表3 禽致病性大肠杆菌的LD50测定
3 讨 论
APEC不仅给养禽业造成严重的经济损失,而且作为人类ExPEC的毒力基因及耐药基因储库,严重危害人类健康及公共卫生安全[22-23]。在感染过程中,APEC需要通过复杂的调控系统控制基因适时表达,从而抵御机体免疫和环境压力的杀伤[13, 15]并致病。TCS广泛存在于细菌中,其可以感应外界环境变化,如养分、渗透压力和抗生素等,通过双组分蛋白的磷酸化和去磷酸化调节细胞信号传导途径,从而调控细菌的生理代谢、压力应激、生物被膜及致病性等方面[5, 7, 9]。研究表明,Cpx TCS可以感知细菌膜表面压力变化信号,调控细菌的多种毒力因子适应环境变化,有利于细菌的生存[24-26]。本研究发现CpxR不影响APEC的生长速度、运动能力和生物被膜形成能力。吴同垒等[19]发现缺失cpxR基因不影响沙门菌的生长速度。另外,在缺失株ΔcpxA中,高水平的磷酸化CpxR可能抑制鞭毛和运动基因的转录,而cpxR基因的缺失可能导致这种抑制作用消除,因而ΔcpxR缺失株与野生株相比在运动性和生物被膜形成能力无明显差异[27]。
沙门菌缺失cpxR基因后,对多种抗菌药物的敏感性增加,其中,包括阿米卡星和卡那霉素[18-19]。本研究中,缺失cpxR基因导致APEC DE719菌株对阿米卡星和卡那霉素的药物敏感性增加,表明CpxR有利于APEC的耐药性。TCS Cpx感知抗生素压力信号后,调控病原菌外膜孔道蛋白和外排泵的表达,增强抵御抗生素的杀伤,从而影响细菌对药物的敏感性[28]。CpxR参与调控大肠杆菌对氨基糖苷类药物的敏感性[12, 29],大肠杆菌的Cpx可影响外膜蛋白OmpC、OmpF及acrD的表达[12, 30],从而调控大肠杆菌对氨基糖苷类药物阿米卡星和卡那霉素的敏感性。
APEC在体内定殖后,进入血液循环引发全身性感染,从而引起家禽急性死亡,因此抗血清杀菌能力在其生存及致病过程中发挥重要作用。本研究发现,CpxR有助于APEC在血清中的存活能力,与UPEC中CpxR的结果一致[15]。细菌可以利用细胞表面分子或分泌蛋白逃避补体系统的识别,从而抵抗血清的杀伤[31],但CpxR的抗血清杀菌机制还不明确。动物试验结果显示,cpxR基因缺失株对雏鸭的毒力下降约10倍,与其他菌种的CpxR功能相似[32]。其中,cpxR基因缺失株的抗血清杀菌能力降低是导致毒力下降的重要原因之一。另外,CpxR作为调控因子,通过磷酸化激活后可以结合至靶序列上调控靶基因的转录表达,从而参与细菌能量代谢、压力应激及毒力等。CpxR可以直接结合菌毛基因fimA启动子和Ⅵ型分泌系统2hcp2B操纵子序,调控菌毛和Ⅵ型分泌系统2的表达,从而影响APEC的黏附、菌间竞争能力及体内定殖能力及毒力[21, 27]。
总之,本文证实TCS CpxR在APEC对阿米卡星和卡那霉素的耐药性、抗血清杀菌能力及毒力方面发挥着重要作用,为进一步研究APEC的环境适应性及生存能力提供参考,并为筛选抗生素靶标和防控大肠杆菌病提供新的思路。
4 结 论
缺失cpxR基因不影响禽致病性大肠杆菌(APEC)的生物被膜形成能力,但可导致APEC对阿米卡星和卡那霉素耐药性降低;CpxR有助于APEC的抗血清杀菌能力;CpxR缺失显著降低APEC的毒力。研究表明,Cpx双组分系统中的CpxR在APEC耐药性、抗血清杀菌能力及毒力方面发挥作用。

