凝固点降低法测摩尔质量实验改进
何 漫,高 美,廖知常,王雪飞,田志远,陈波珍
(中国科学院大学化学科学学院,北京 100049)
0 引言
物理化学实验是大学化学教学的重要组成,通过物理化学实验的操作和训练,学生不但可以掌握物理化学的基本实验方法和技术,加深对物理化学基本理论的理解,还能培养对实验现象的观察和记录、实验数据的测量和处理、实验结果分析和归纳的能力,增强发现问题、分析问题和解决问题的技能,初步学会从事化学研究的途径和方法[1]。针对物理化学实验,近年来不断有新的教学实验设计出现,但经典的实验依然承载着传授基础知识的任务,其作用不可替代,占据课堂的主体。并且,用于传统实验的教学设备发展较为完善,便于课程普及。然而,传统实验也暴露许多问题,如内容单一,操作程式化,偏重验证性,削弱了学生的实验兴趣,束缚了学生的主动性和创造力,更不利于锻炼学生独立思考和解决问题的能力[2]。现代教学要求在知识传授的同时更加注重学生能力的培养和科学素养的形成,能否在经典实验中融入素质教育的成分,值得教育工作者思考。
我校本科物理化学实验于2017年开设,从开课初期就一直在探索传统教学内容与新时代教育发展相协调的途径。希望通过实验操作和实验步骤的调整来淡化验证性工作,引导学生转变思维方式,调动他们的积极性,增强协作精神[3-4]。比如针对“络合物稳定常数测量”这一经典实验,用光谱仪替代分光光度计,将单波长吸光度测量改为全谱扫描,在完成基本教学任务前提下融入了分子光谱知识的内容[5]。本文介绍针对物理化学实验“凝固点降低法测定摩尔质量”的教学内容的改进,所做改进立足已有的教学设备,通过实验目标的调整,要求学生以团队形式完成一项工作,并且实验过程设置具有一定的探索性和实用性。课堂实践证明采用新的教学方案,学生课前准备、实验操作、结果分析3个方面的质量都大幅提高,学习兴趣增加。
1 实验改进方案
凝固点降低法测摩尔质量是大学化学常用的教学实验之一,其原有的目的是学习凝固点降低法测摩尔质量的方法[6]。该实验是基于稀溶液凝固点相对于纯溶剂的凝固点降低值与溶液的质量摩尔浓度成正比这一原理[7-8]:

式中:ΔTf为凝固点降低值,K;Kf为凝固点降低常数,K·kg·mol-1;XB为溶液质量摩尔浓度,mol/kg。
溶液的质量摩尔浓度可以用溶质的摩尔质量表示,于是可以得到摩尔质量的计算式:
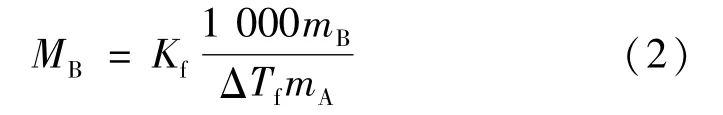
式中:MB为溶质的摩尔质量;mA、mB分别为溶剂和溶质的质量;ΔTf为凝固点降低值。
在教学实验中,一般采用冰水浴作为低温源,可选的溶剂-溶质体系有苯-萘、环己烷-萘、水-蔗糖、水-葡萄糖、水-尿素等[9];也有学者提倡用硬脂酸做溶剂,脂肪酸(月桂酸、棕榈酸、豆蔻酸等)做溶质,以一种更绿色环保的方法去研究稀溶液的依数性[10];还有将差示扫描量热技术用于该实验的报道[11],其优势在于精度高、适用温度范围宽、样品用量小,但依赖贵重仪器,不利于推广。实际教学中常用环己烷-萘这一体系,因为环己烷溶解热小,毒性低,凝固点(6.5 ℃)适中[12],冰水浴就可实现降温。
但现有的教学实验设计一般是在给定Kf值的前提下通过实验验证某种溶质的摩尔质量[13]。但是,随着科学技术的发展,目前已很少用此方法测定摩尔质量,因此该实验的主要目的是加深学生对于稀溶液依数性本质的认识[14-15]。从式(2)可见,给定溶质摩尔质量也可以测算溶剂的凝固点降低系数Kf,而Kf是化合物依数性的重要常数之一。
基于上述讨论,对原实验步骤做如下改进:不提供Kf给学生,由他们自行测定,再由所得Kf测定未知化合物的分子量。具体方案为,将学生分两组,第1组的任务是根据已知溶质摩尔质量测量溶剂的Kf;第2组基于第1组提供的Kf值测量另一种溶质的摩尔质量。实验中两组同时进行操作,数据后期处理确定。这一方案中所有学生的实验操作完全相同,测量数据相同,分析方法相似,只是目标参数不同,不会造成操作训练上的差异。遵循这一方案,前一组学生的结果是后一组的输入参数,后一组的结论可以验证前一组结果的有效性。学生之间相互配合,在普通的教学实验中融入探索和协作因素,可以提高学生的学习兴趣[16]。实践表明,改进的方案是可行的。
2 实验方法
2.1 实验仪器与试剂
SWC-LGD型凝固点测试仪,南京桑力电子设备厂;SQP型电子天平,赛多利斯科学仪器(北京)有限公司。
环己烷(分析纯),北京化工厂;萘(分析纯),上海麦克林生化科技有限公司;联苯(分析纯),上海阿拉丁生化科技有限公司。
2.2 实验步骤
参与实验的同学分为两组:溶剂组和溶质组。其中溶剂组负责溶剂凝固点降低常数Kf的测量,溶质组利用溶剂组提供的Kf测另一种化合物摩尔质量。
溶剂组具体实验步骤和内容参照相关教材。简而言之,分别绘制纯溶剂环己烷和萘的环己烷稀溶液的步冷曲线,获得各自的凝固点,利用式(2)计算环己烷的凝固点降低常数Kf。在环己烷用量相同的情况下,同组学生称取萘的质量在0.1~0.3 g范围内适当分散,通过拟合ΔTf-XB关系式,直线斜率即为环己烷的凝固点降低常数Kf。
溶质组所用溶质事先不告知学生,步冷曲线的测量方法同上。本文中用联苯,该化合物在环己烷中有较好的分散性。利用溶剂组提供的环己烷的凝固点降低常数Kf,根据式(2)计算出联苯的摩尔质量。
3 实验教学效果
3.1 凝固点降低常数Kf测量
如前所述,参与实验的学生分两组,溶剂组的任务是通过萘的摩尔质量确定环己烷凝固点降低系数Kf。为建立线性方程,建议成员数量不少于3人。图1(a)和(b)分别是20 g环己烷以及在其中加入0.151 g萘后的稀溶液的步冷曲线。其中纯溶剂平台对应的温度即为凝固点;在稀溶液中,溶剂的析出会使液态浓度稍有升高,其凝固点继续降低[17],因此不会出现平台,而是逐步下降,曲线反向延伸与纯液相的降温曲线的交点(5.44℃)可视作稀溶液的凝固点。另外,图中还可以看到液体凝固过程中明显的过冷现象。虽然教科书中多次提到过冷现象,但通过实际观测来体会这一物理过程的机会不多,因此在课堂上应适当讲解。
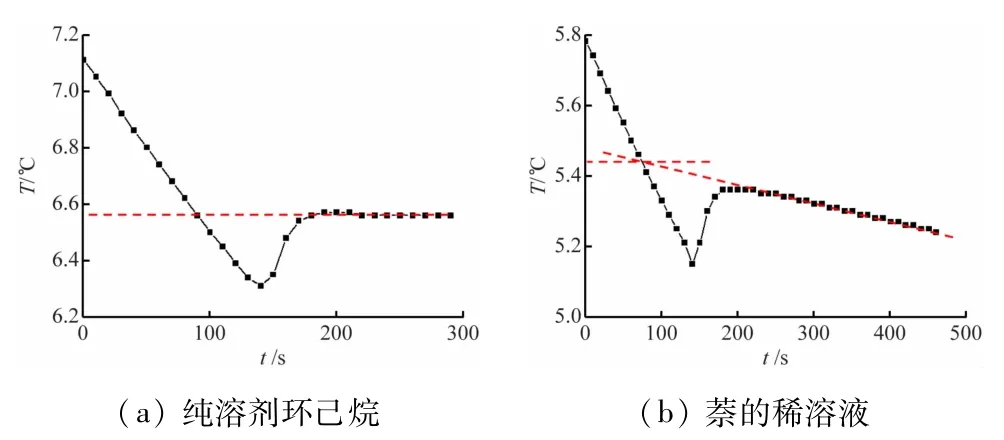
图1 两种物质的步冷曲线
以某次实验课溶剂组4位同学(A,B,C,D)的实验数据为例,他们所用环己烷约为20 g,称取萘的质量分别为0.151、0.160、0.216、0.298 g。各自测量溶剂和溶液的凝固点,重复3次,数据列于表1中。表中环己烷的凝固点的差异是仪器的系统误差所致,但不影响ΔTf的准确测量。依据实验数据计算得到的环己烷的凝固点降低常数分别为19.5、19.8、19.4、19.2 K·kg/mol,均接近理论值20.0 K·kg/mol[13]。这里有意分散萘的用量,旨在获得不同XB下的ΔTf,以便于绘制ΔTf-XB关系图(见图2),以此拟合直线斜率得到Kf。所以溶剂组提供的Kf不是他们各自结果的简单平均,而是综合分析的结果,同组成员要将各自的结果汇总在一起,摒弃偏差较大的数据点,经线性拟合后将结果提交给溶质组。课堂教学效果证明,这样大大调动了学生的责任心和积极性,活跃了课堂气氛。学生的实验数据质量较以往简单地验证萘的摩尔质量有了很大的提升。
图2所示是基于表1数据绘制的XB-ΔTf关系图,进行线性拟合得凝固点降低常数Kf为19.5 K·kg·mol-1,与实验教材中提供的参考值20.0 K·kg·mol-1非常接近,相对误差2.50%。证明实验体系设计合理可行,结果可以作为有效参数供溶质组使用。

表1 萘的稀溶液凝固点降低实验数据

图2 凝固点降低值ΔTf与溶液的质量摩尔浓度XB线性拟合图
3.2 摩尔质量测定
溶质组与溶剂组同时进行操作,且所有操作基本相同,只是所用溶质为未知化合物,其目的是确定该化合物的摩尔质量。环己烷的溶解性有限,只有少数非极性的芳香烃或烷烃能分散其中。考虑溶液的配制和确保浓度的准确性,挥发性物质和液体不适于用作溶质[18-19]。故选用联苯作为溶质,该化合物常温下为固体,便于称重。要求该组学生在约20 g环己烷中溶入少量联苯,通过步冷曲线确定溶剂凝固点的变化ΔTf,重复3次取平均值,利用溶剂组提供的Kf=19.5 K·kg·mol-1计算得摩尔质量。表2列出该组3名学生的实验数据和测量结果,从中可见3名同学测得的联苯的摩尔质量(MB)分别为154.68,154.08,152.75 g/mol,理论值为154.21 g/mol,相对误差分别为0.30%,0.08%,0.95%,均在1%以内,表明实验设计的可行性。

表2 溶质组实验参数和相应计算结果
4 结语
物理化学实验“凝固点降低法测量摩尔质量”的实验目的是熟悉稀溶液依数性这一物理特性,而化合物摩尔质量的测量是对该理论进一步认识的途径。在此,对原有的实验设计做3点改进:增加溶剂凝固点降低常数测定环节,加深学生对这一参数的理解;用相同溶剂不同溶质配置的稀溶液的凝固点降低常数不变,让学生认识到依数性的本质;考虑到教学课时的限制,设计上述两项分组进行,数据共享。实践证明,设计符合化学、物理的原理,更好地诠释了所授知识点,教学目的更加明确。学生分组不分工,对动手能力的训练不存在差异。从教学效果来看,采用新实验方案后学生的积极性大大提升,实验学习更加深入,课堂气氛更加活跃,实验结果的讨论更加具体。

