猪GV/MⅡ期卵母细胞miRNAs表达谱及Npm2基因相关miRNAs筛选
张 珂,严继猛,刘耀文,李鸿辉,陈 强,李 卓,苏艳华,普少瑕,王海臻,魏红江,贾宝瑜*,成文敏*
(1. 云南农业大学动物科学技术学院,昆明 650201; 2. 云南农业大学动物医学院,昆明 650201;3.云南农业大学 云南省动物基因编辑与体细胞克隆技术重点实验室,昆明 650201)
体细胞核移植技术(somatic cell nuclear transfer,SCNT)是将体细胞注入去核的体外成熟卵母细胞中以产生新个体的技术,可用于研究基因组重编程、生产基因编辑动物和保护濒危物种。自克隆羊“多莉”出生后的24年内,尽管体细胞核移植技术在很多物种中均已获得后代,但克隆胚胎能够发育到成活个体的比例仍非常低,这极大程度限制了SCNT技术的应用[1]。优化SCNT技术参数并不能显著提高克隆效率,只有从理论上阐明SCNT机制才可以克服克隆胚胎发育异常瓶颈[2]。其中,供体细胞核不完全重编程是导致克隆效率低、胚胎表型异常和克隆动物成活率低的主要原因[3],然而SCNT介导的核重编程机制尚不明确,影响克隆胚胎发育能力的关键因子也不清楚[4]。
核质蛋白是一种组蛋白分子伴侣,其家族成员有3个同系物:NPM1、NPM2和NPM3[5]。其中,NPM2是卵母细胞和早期胚胎内特异性表达的蛋白,在精子染色质解聚[6]和体细胞重编程过程中发挥重要的作用[7]。NPM2是小鼠核仁组织区的组成部分,单独的NPM2可在体外使精子染色质解聚[8],Npm2缺失导致卵母细胞缺乏正常的核仁结构,说明以NPM2为基础的卵母细胞核仁区对早期胚胎发育过程中雄性染色体组装至关重要[9],发育过程中细胞内NPM2数量减少,会影响核组蛋白水平和染色体结构[10]。在斑马鱼中发现,Npm2基因存在两种形式:Npm2a和Npm2b,其中,Npm2a参与受精过程中精子染色质解聚,Npm2b在受精后参与胚胎基因组激活[11]。体细胞核移植过程中将NPM注射入牛卵母细胞中可提高克隆胚胎的存活率和妊娠率[12],使用爪蟾卵母细胞提取物处理猪成纤维细胞可提高细胞活率,促进体细胞核移植胚胎的体外发育能力[13]。本课题组前期的研究结果也表明,通过原核表达载体获得的重组核质蛋白注射入去核的卵母细胞中,可提高版纳微型猪近交系克隆胚胎的发育能力[14]。上述研究说明,NPM2可促进体细胞重编程,但NPM2的调控机制尚不明确。
microRNAs (miRNAs) 是一类长度约为22 nt的短链非编码RNAs,通过与靶基因序列互补的方式进行翻译后抑制或mRNA降解,以调控基因表达和翻译[15]。miRNA参与调控繁殖过程的首例报道为小鼠减数分裂过程中miRNA调控雌性原始生殖[16]。之后,研究结果表明,卵子发生过程中miRNAs 表达会影响成熟卵母细胞的基因表达谱[17],如miR-21通过影响下游基因SPRY2参与小鼠第一次减数分裂过程[18],抑制miR-21活性可改变PDCD4蛋白丰度,影响猪卵母细胞成熟过程中脂肪酸代谢及脂肪酸生物合成[19],miR-335-5p调控小鼠卵母细胞减数分裂中细胞骨架动力学[20]。通过深度测序技术分析水牛卵丘细胞(cumulus cells,CCs)[21]、人卵丘细胞和卵母细胞miRNA表达[22]表明,miRNA可通过调控卵丘细胞以及卵母细胞和卵丘细胞间的缝隙连接影响卵母细胞成熟,增加卵丘细胞中miR-224表达可通过PTX3表达变化降低卵母细胞成熟率和抑制胚胎发育[23]。let-7 和miR-106a可调控牛卵母细胞母源mRNAs表达[22],miR-27b及其靶基因PPARγ通过调控脂肪代谢影响猪卵母细胞成熟[23],过表达miR-148a可下调DNMT1 基因的表达,上调重编程相关基因表达,提高猪核移植胚胎早期发育能力[24]。尽管许多miRNAs 及其靶基因均已被识别,但miRNAs 调控Npm2表达的研究较少,仅有研究表明,miRNA-181a 可调控牛卵母细胞中Npm2表达[25],猪卵母细胞中调控Npm2表达的miRNAs还未见报道。
本研究目的在于构建猪GV期和MⅡ期卵母细胞中miRNAs表达谱,筛选出调控Npm2基因表达的miRNAs,并进行验证。
1 材料与方法
1.1 卵母细胞采集培养
从昆明市呈贡区鸿腾屠宰场采集猪卵巢,放入盛有37 ℃生理盐水(含100 IU·mL-1青霉素和链霉素)的保温瓶中送回实验室。用37 ℃生理盐水冲洗卵巢3遍,随后用配有20 G针头的10 mL注射器抽取卵巢表面3~6 mm卵泡中的卵丘-卵母细胞复合体(cumulus-oocyte complex,COCs)。置于体视显微镜下挑选胞质均匀、有3层及3层以上卵丘细胞包裹的A、B级COCs作为GV期卵母细胞;挑出之后将其置于成熟培养液中并放入5% CO2、38.5 ℃、饱和湿度的CO2培养箱中培养42~44 h。成熟培养液为TCM-199,添加0.1 mg·mL-1丙酮酸钠、0.1 mg·mL-1L-半胱氨酸、10%(v/v)猪卵泡液(porcine follicular fluid,pFF)、10 ng·mL-1表皮生长因子(epidernal growth factor,EGF)、10 IU·mL-1hCG和10 IU·mL-1eCG。成熟培养后选出细胞膜完整、胞质均匀且第一极体排出的卵母细胞作为MⅡ期卵母细胞。
1.2 GV和MⅡ期卵母细胞RNA提取、文库构建及测序
收集的GV期和MⅡ期卵母细胞用0.1 mg· mL-1的透明质酸酶去除卵丘细胞,使用1%链霉蛋白酶去除透明带,约130个卵母细胞加5~10 μL Trizol,经液氮处理后置于-80 ℃保存备用。样品经解冻后加入1 mL MagzolTM Reagent进行总RNA提取,由广州锐博生物科技有限公司进行文库构建和测序。具体步骤:提取纯化的总RNA分别连接5′接头和3′接头,使用superscript Ⅱreverse transcriptase (Invitrogen)合成cDNA,PCR扩增,用凝胶电泳法获取插入片段在18~40 nt 的cDNA文库,使用Illumina HiSeqTM2500进行上机测序。
1.3 GV和MⅡ期卵母细胞miRNA测序及生物信息学分析
将Illumina HiSeqTM2500 测序所得 50 nt 原始序列(raw reads)集,通过去掉 reads 两端的接头、去掉低质量reads、去污染等过程完成数据初步过滤,得到干净序列(clean reads),对其进行序列长度分布的统计及样本间共有序列统计,对clean reads进行分类注释,可以获得样本中各类sRNA的组分及表达量信息,将所有sRNA片段注释后,使用余下的未注释片段进行新miRNA的预测。
1.4 GV和MⅡ期卵母细胞差异表达miRNAs筛选及富集分析
对各样本中已知和新miRNA进行表达量统计,并进行归一化处理,采用DEGseq进行差异分析,从差异倍数(fold change,FC)和校正后的显著水平(qvalue<0.05)进行评估,对差异miRNAs进行筛选。对获得的差异表达miRNAs进行靶基因预测,并对靶基因进行GO和KEGG富集分析。
1.5 实时荧光定量PCR检测
对筛选的GV期和M Ⅱ期卵母细胞中差异表达的两个miRNAs进行qRT-PCR检测,以U6为内参基因。miRNA引物购自广州锐博生物科技有限公司。所用的qPCR反应体系为10 μL:cDNA 2 μL,2×SYBR Green Mix 5 μL,上、下游引物(10 μmol·L-1)各0.4 μL,RNase-free H2O 2.2 μL。PCR反应条件:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 20 s,70 ℃ 10 s,共40个循环;70~95 ℃每间隔0.5 ℃读数一次,每个样本重复试验3次。相对表达量结果采用2-ΔΔct法计算。
1.6 统计分析
结果描述为“平均数±标准误(mean±SE)”,运用SPSS 19.0软件进行t检验,*P<0.05认为差异显著,**P<0.01认为差异极显著。
2 结 果
2.1 测序数据过滤和sRNA参考序列的分布情况
经过测序,去除两端接头、污染及低质量序列后,GV期和MⅡ期卵母细胞sRNA文库测序分别获得了14 782 574和15 589 900条Raw reads,大部分序列的长度都集中在21~24 nt,均以24 nt长度的比例最高。将经长度筛选的sRNA与猪基因组进行比对发现,GV期卵母细胞特有序列占36.37%,MⅡ期卵母细胞特有序列占46.04%,GV期和MⅡ期卵母细胞共有序列占17.60%。
2.2 GV期和MⅡ期卵母细胞新miRNAs预测
GV期卵母细胞共预测到367个新miRNAs,MⅡ期卵母细胞共预测到408个新miRNAs。其中,GV911预测到95个新的miRNAs,GV913预测到152个新的miRNAs,GV918预测到103个新的miRNAs。MⅡ911预测到119个新的miRNAs,MⅡ913 预测到93个新的miRNAs,MⅡ918预测到152个新的miRNAs。
2.3 GV期和MⅡ期卵母细胞差异表达miRNAs筛选
对GV期和MII期卵母细胞中表达的已知miRNA进行差异表达分析,以log2(fold change)≥1为阈值,qvalue<0.01表示极显著差异,qvalue<0.05表示显著差异。结果如图1所示,log2(fold change)≥1的miRNA共计172个,差异表达的miRNA有95个,其中65个存在极显著差异,30个存在显著差异。相对于GV期卵母细胞,MⅡ期卵母细胞中37个miRNAs极显著下调,25个显著下调,28个极显著上调,5个显著上调。其中miR-676-5p和miR-493-5p为下调和上调表达中差异倍数最大的miRNAs。
2.4 GV期和MⅡ期卵母细胞差异miRNA聚类分析
为判断GV期和M Ⅱ期卵母细胞中差异miRNA表达量的聚类模式,以更好地理解已知miRNA的未知功能,对GV期和MⅡ期卵母细胞中miRNAs做聚类分析(图2)。结果表明,具有相似表达模式的miRNAs聚在一起。如miR-363、miR-7138-5p、miR-142-3p和miR-126-5p等表达模式相似(在GV期卵母细胞中低表达,在MⅡ期卵母细胞中高表达)且聚为一类。因此推测,聚为一类的miRNAs可能具有相似的生物学功能。
2.5 GV期和MⅡ期卵母细胞差异表达miRNAs靶基因预测及功能注释
对95个差异表达miRNAs进行靶基因预测,共得到3 967个靶基因。其中,miR-423-5p涉及的靶基因有224个,miR-671-5p涉及的靶基因有206个,miR-296-3p涉及的靶基因有211个,miR-370涉及的靶基因有150个,miR-874涉及的靶基因有145个。 对靶基因进行Gene Ontology富集,结果表明,这些靶基因被富集于472个细胞组分(cellular component,CC)、695个细胞功能(molecular function,MF)和4 027个生物学过程(biological process,BP),共5 194个GO条目。每个GO分类显著富集的前20个条目见表1和图3。从生物学过程看,这些靶基因主要参与细胞进程(cellular process)、代谢过程(metabolic process)、生物调控(biological regulation)、刺激应答(stimulus response)、定位(localization)和发育(developmental process)等过程。从分子功能来看,多数靶基因与蛋白结合(protein binding)、催化活性(catalytic activity)、各类离子结合(ion binding)和环状化合物结合(cyclic compound binding)相关。其表达产物主要分布于细胞质、细胞器和细胞膜(cytoplasm, organelle and membrane)区域。

表1 GV期和MⅡ期卵母细胞差异miRNAs靶基因显著富集的GO条目
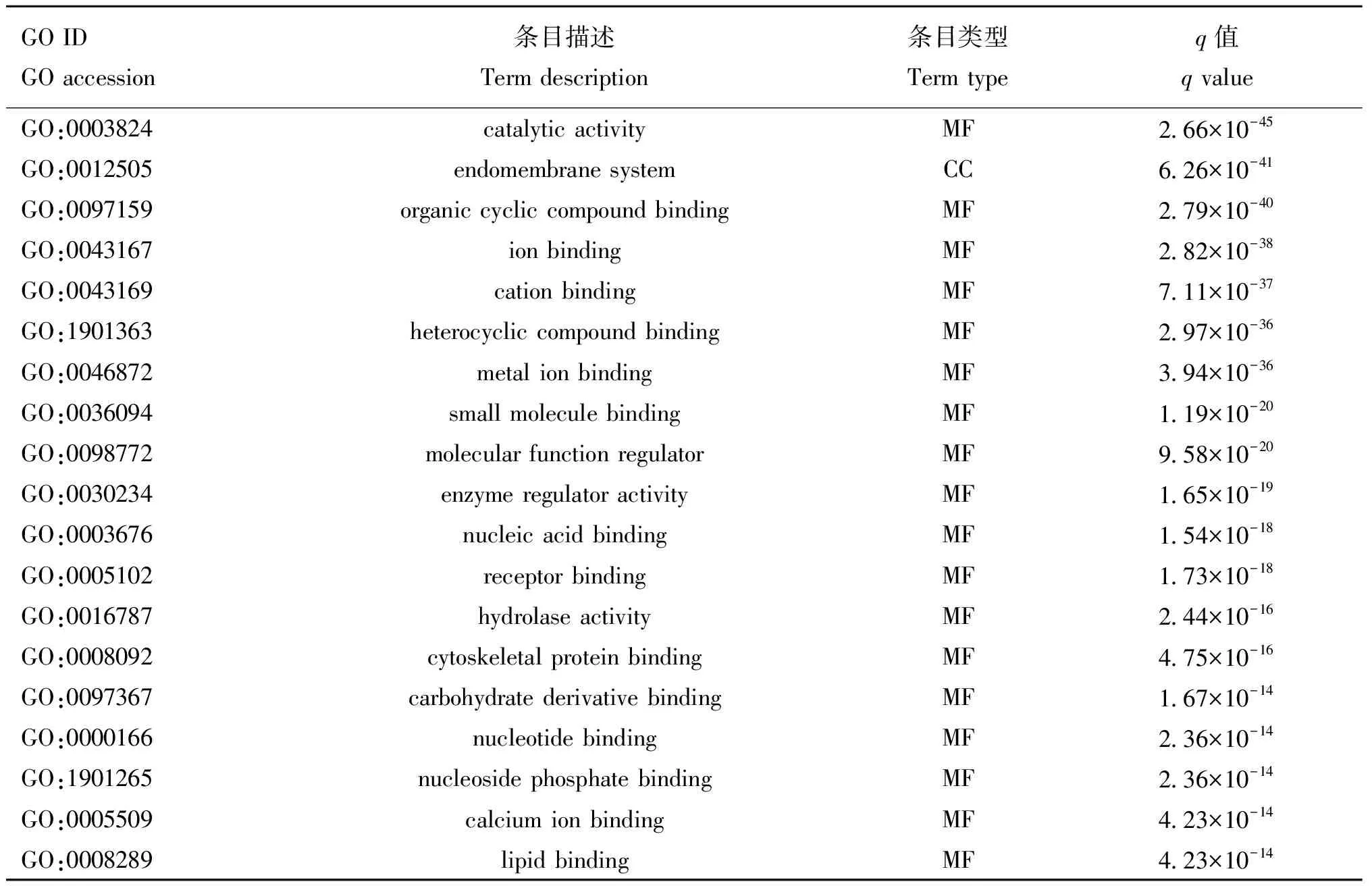
(转下页 Carried forward)
2.6 差异表达miRNAs 靶基因KEGG富集分析
对95个差异表达miRNAs的靶基因基于KEGG数据库进行通路富集,共富集到212个信号通路,在富集程度最高的前20个KEGG通路中(表2和图4),这些靶基因主要参与代谢通路(metabolic pathways)、信号转导PI3K-Akt信号通路(PI3K-Akt signaling pathway)和AMPK细胞通路(AMPK signaling pathway)、信号分子和相互作用的细胞黏附(cell adhesion molecules)、细胞因子-细胞因子受体结合(cytokine-cytokine receptor interaction)、内分泌系统的胰岛素信号通路(insulin signaling pathway)、细胞活力的肌动蛋白细胞骨架调控(actin cytoskeleton regulation)等途径。
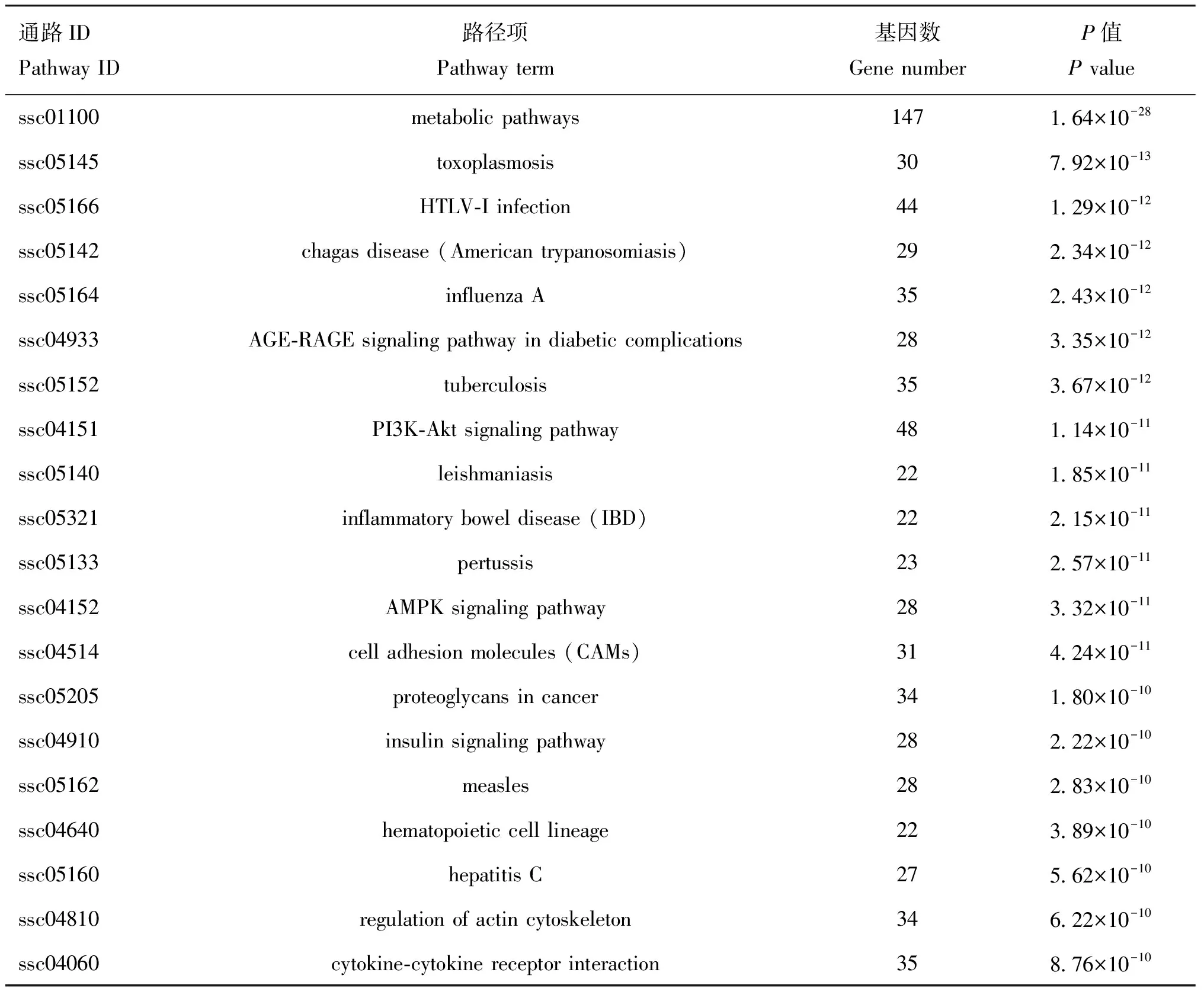
表2 差异表达miRNAs靶基因富集程度前20的KEGG通路
其中,与卵母细胞减数分裂相关的通路有2个,基因有CPEB、MAPK1、Rsk1/2、Cdk2、Cdc2、Cdc23、MAPK12等(图5A)。孕激素介导的卵母细胞成熟通路中涉及的基因有PIK3、MAPK1、CPEB、Cdk2、Cdc16、Mos等(图5B)。
2.7 与Npm2基因表达相关的miRNAs的筛选
在差异表达的95个miRNA中,经一个软件预测与Npm2相关的miRNA有12个,分别是miR-21、miR-24-3p、miR-29a、miR-30e-3p、miR-133b、miR-151-3p、miR-219a、miR-323、miR-328、miR-421-3p、miR-1307、miR-2366。经两个软件预测与Npm2相关的miRNA有5个,分别是miR-32、miR-150、miR-296-3p、miR-423-3p、miR-7138-5p。其中,miR-150和miR-7138-5p极显著上调,miR-423-3p和miR-296-3p极显著下调,miR-32显著下调。在5个miRNA中选择miRNA测序结果中自体表达量高且存在极显著下调的miR-423-3p和GV期完全不表达而MⅡ期卵母细胞极显著上调的miR-7138-5p进行qPCR验证,miR-423-3p表达极显著下调(图6A),miR-7138-5p表达上调(图6B),其表达趋势与测序结果一致。
3 讨 论
卵母细胞成熟是通过有序的减数分裂、染色质重塑和细胞质细胞器重组等在形态学、生理学方面发生变化的过程[26-28],体外成熟培养的卵母细胞是进行体细胞核移植研究所需受体卵母细胞的主要来源,其成熟质量与体细胞核移植效率密切相关。卵母细胞中储存的mRNA及蛋白质调控卵子自身的成熟及受精后胚胎的早期发育,包括卵母细胞的极性、卵子的激活、早期细胞分裂、母源mRNA的清除、合子基因组转录激活及胚层的形成和分化等[29]。而在卵母细胞成熟过程中,miRNA的表达丰度呈现动态变化,影响卵母细胞成熟、早期胚胎发育、母源mRNA降解等过程。本研究分析了猪卵母细胞成熟前、后miRNAs表达谱,并筛选出了调控Npm2基因表达的miRNAs,结果为进一步阐明猪卵母细胞体外成熟过程中miRNA的调控机制奠定了基础。
本试验对猪GV期和MⅡ期卵母细胞miRNA测序发现,GV期卵母细胞共预测到367个新miRNAs,MⅡ期卵母细胞共预测到408个新miRNAs。 筛选到差异表达的miRNAs共有95个,其中,37个极显著下调,25个显著下调,28个极显著上调,5个显著上调。宋春雷[30]研究发现,与猪GV期卵母细胞相比,有7个miRNAs在MⅡ期卵母细胞中的表达量下调超过2倍(P<0.001,fold change>2),如miR-210、miR-202-5p、miR-676-3p、miR-15b、miR-27b-3p、miR-769-5p均下调,其中,4个miRNAs在GV期卵母细胞中特异表达,在MⅡ期卵母细胞中无表达;有16个miRNAs在MⅡ期卵母细胞中的表达量上调超过2倍(P<0.001,fold change>2),这些显著上调的miRNAs都只特异性表达于MⅡ期卵母细胞中,在GV期检测不到表达,如miR-486、miR-342、miR-100、miR-10b、miR-10a-5p、miR-183、miR-21均上调。miR-21在牛体外成熟卵母细胞中也表达上调[31]。本研究结果发现,miR-21表达上调,与前人结果相一致,miR-21可下调金属蛋白酶家族成员组织抑制物活性,增加金属蛋白酶活性,促进卵丘细胞扩散和卵母细胞成熟[32]。另外,miR-486表达水平上调,研究结果表明,miR-486可通过磷脂酰肌醇-3-激酶/蛋白激酶B(the phosphatidylinositol-3-kinase/protein kinase B,PI3K-Akt)信号通路促进卵丘细胞增殖,有利于卵母细胞成熟[33]。但miR-342、miR-100、miR-10b、miR-10a-5p、miR-183未发现差异表达,在上调的miRNAs中miR-493-5p和miR-7138-5p只特异性表达于MⅡ期卵母细胞中,在GV期检测不到表达。经预测miR-493-5p的靶基因有11个,其中,SLC7A1是一种精氨酸/赖氨酸转运者,参与哺乳动物胚胎干细胞多能性Nanog信号通路,RIT1参与调控MAPK(mitogen-activated protein kinase)依赖的信号通路,可促进细胞增殖、存活和分化。目前,对于miR-493-5p的研究主要集中于肿瘤,可通过消除胰岛素样生长因子(insulin-like growth factor 2,IGF2)过表达而发挥其肿瘤抑制活性[34],还可以通过磷PI3K-Akt信号通路抑制肿瘤转移[35],但miR-493-5p参与卵母细胞成熟的研究仍未见报道。miR-7138-5p的靶基因有43个,其中,TBX21基因编码一种转录因子,可激活干扰素和趋化因子受体基因,招募包括KDM6B、SWI/SNF复合体和H3K4 me2甲基转移酶在内的染色体重组复合物,建立松散的染色质状态,有益于转录激活。PAQR8为孕激素和脂联素Q受体家族成员,通过G蛋白信号通路参与卵母细胞成熟,在金鱼卵母细胞中注射PAQR8的反义寡核苷酸抑制其表达,可抑制卵母细胞成熟诱导[36],推测miR-7138-5p可能通过作用于上述靶基因参与卵母细胞减数分裂成熟。
另外,本试验检测到miR-210、miR-202-5p、miR-676-3p、miR-27b-3p、miR-769-5p、miR-574等均下调,miR-15b未发现差异表达,在下调的miRNAs 中只有miR-676-5p在GV期卵母细胞中特异表达,在MⅡ期卵母细胞中无表达。miR-676-5p有8个靶基因,其中,CDKN1B编码细胞周期蛋白依赖的激酶抑制剂,可以控制G1期细胞周期进程,CDK依赖的磷酸化会导致CDKN1B蛋白降解,促进细胞周期由沉默状态转变为增殖状态,但miR-676-5p参与卵母细胞成熟的研究未见报道。miR-574可通过靶向作用于透明质酸合成酶2抑制卵母细胞成熟[37]。本研究结果发现,miR-574表达下调,与前人研究结果相一致,说明miR-574下调参与卵母细胞成熟。上述结果表明,miRNAs可能作用于特定的靶基因进而调控猪卵母细胞体外成熟。
对差异表达miRNA的靶基因进行GO和KEGG富集分析,结果表明,靶基因显著富集于代谢通路、PI3K-Akt信号通路、AMPK细胞通路、信号分子和相互作用的细胞黏附、细胞因子-细胞因子受体结合、胰岛素信号通路、细胞活力的肌动蛋白细胞骨架调控等途径。猪卵母细胞中含有大量的脂肪颗粒,脂类的合成和分解可以为卵母细胞成熟和随后的胚胎发育提供必需的能量来源,因此,代谢途径不仅影响卵母细胞质成熟,还会控制卵母细胞核成熟。另外,PI3K/Akt信号通路在细胞增殖、凋亡、DNA修复和蛋白合成中发挥关键的作用,参与原始卵泡募集、颗粒细胞增殖、黄体功能和卵母细胞成熟[38]。PI3K激活可以促进Akt磷酸化,促进细胞增殖、诱导卵泡生长、促进牛卵母细胞成熟并发育到囊胚[39],而Akt又是胰岛素信号传递和葡萄糖代谢的主要调节分子,说明PI3K-Akt信号通路、胰岛素信号通路等在卵母细胞成熟过程中发挥重要的作用。进一步说明,miRNA通过作用于PI3K-Akt、胰岛素等信号通路的靶基因,实现对卵母细胞的成熟调控。
NPM2是卵母细胞特异性的核因子,对促进核重编程和早期胚胎发育至关重要。经MicroInspector预测,miRNA与牛Npm2 mRNA的结合位点在3′UTR区,转染试验表明,在Hela细胞中miR-181a降低NPM2蛋白表达,说明miR-181a会抑制NPM2翻译[27]。本试验在GV期和MⅡ期卵母细胞中未检测到miR-181a,而检测到miR-181c表达,但差异不显著。在差异表达的miRNAs中预测到与Npm2基因相关的miRNA有5个,其中,miR-150和miR-7138-5p极显著上调,miR-423-3p和miR-296-3p极显著下调,miR-32显著下调。miR-150在牛卵母细胞成熟过程中随着成熟进程的推进其表达量降低,可能作用于CALML4基因而影响卵母细胞成熟[40]。但本试验预测CALML4并不是miR-150的靶基因,这可能是由于物种特异性所致。miR-296-3p、miR-423-3p、miR-32研究均集中于肿瘤方面,对卵母细胞成熟调控未见报道,仅Guo等[41]结果表明,miR-32为附植相关miRNAs,在体外受精失败的人类中miR-32会显著下调,也未见关于miR-7138-5p的报道。本研究选择自体表达量高且存在极显著差异的下调miRNA-423-3p和GV期完全不表达而MⅡ期卵母细胞极显著上调的miR-7138-5p进行qPCR验证,其表达水平变化趋势与测序结果相一致,miR-423-3p在诱导细胞周期转换、细胞凋亡、细胞自噬等方面可调控靶基因表达而发挥作用,经预测后miR-423-3p的靶基因除Npm2外还包括ADM基因,该基因编码的肾上腺髓质素在卵泡发育、卵母细胞成熟、胚胎附植和子宫发育过程中均发挥重要的作用。miR-7138-5p的靶基因除Npm2外还包括TBX21和PAQR8基因,推测miR-423-3p和miR-7138-5p可能通过作用于相应的靶基因从而调控卵母细胞成熟,但具体的调控机制仍需进一步深入研究。
4 结 论
本研究成功构建了猪GV/MⅡ期卵母细胞miRNAs表达谱,并筛选出了两个时期卵母细胞中差异表达的miRNAs;同时,结合靶基因预测及GO、KEGG富集分析,推测出差异表达的miRNAs可能通过代谢途径、卵母细胞减数分裂相关的通路、孕激素介导的卵母细胞成熟通路等途径在卵母细胞体外成熟过程中发挥作用;另外筛选出了调控Npm2基因表达的miRNAs。这些结果将为后续研究猪卵母细胞成熟过程中miRNAs对靶基因的调控机制提供科学依据。

