L- 精氨酸基姜黄素衍生物的合成及抑菌性评价
李海鹰,邱明恒,陈健,王桂静,杨文智
(河北大学 药学院,生命科学与绿色发展研究院,河北 保定 071002)
姜黄素(Cur,1,7-双(4-羟基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮),存在于姜科和天南星科植物根茎中,经提取并精制可获其橘黄色粉末.姜黄素具有抗动脉粥样硬化、抗氧化、抗炎、抗病毒、抗肿瘤和抗类风湿等天然活性,一些活性研究已进入临床阶段,该化合物收载于《中华人民共和国药典》,世界卫生组织和FDA批准其为天然食品添加剂[1-2].其中,姜黄素在肿瘤预防方面的研究成为热点,美国国立肿瘤所已将其列为第3代癌化学预防药[3].姜黄素水中溶解度仅11 ng/mL,体内利用率低,限制其在临床应用[4].目前,研究者主要采用2种方案改善姜黄素溶解度和提高其稳定性.其一,采用新型药物制剂递送方法,改善姜黄素溶解度并获得良好的体内生物利用度[5];其二,采用化学方法修饰姜黄素,获得其前体药物,以期获得一系列具有开发价值、具备良好药动学特性和生物活性的新型姜黄素衍生物[6].此外,琥珀酸和体内必需精氨酸,均属于机体内源性物质,参与机体代谢且具有良好水溶性[7].本文参照课题组常用的酯化条件[8-9],以琥珀酸为连接臂,制备改善姜黄素溶解性的精氨酸基姜黄素衍生物,并评价其抑菌性能.
1 实验部分
1.1 仪器与试药
ZF-1三用紫外分析仪(上海驰唐实业有限公司);T6新世纪紫外可见分光光度计(北京普析通用仪器有限公司);FT-IR 8400S傅里叶变换红外光谱仪(日本岛津仪器公司);AVANCEⅢ 600 Hz核磁共振波谱仪(瑞士布鲁克公司);DSC-60 Plus差示扫描量热仪(日本岛津仪器公司);Synergy HT酶标仪(美国伯腾仪器有限公司).
姜黄素、L-精氨酸、琥珀酸酐、EDC·HCl、DMAP均购于国药集团化学试剂有限公司;酵母粉购自北京索莱宝科技有限公司;胰蛋白胨购自北京双旋微生物培养基制品厂;琼脂购自天津市科密欧化学试剂有限公司.
1.2 实验方法
1.2.1 Cur-Sa-Arg的制备
琥珀酸姜黄素(Cur-Sa)的制备:取姜黄素0.494 5 g(1.34 mmol)溶于25 mL二氯甲烷中,分别加入EDC 0.249 2 g(1.3 mmol)和0.037 6 g DMAP,35 ℃恒温水浴搅拌活化1.5 h,然后加入琥珀酸酐0.163 4 g(1.62 mmol),反应48 h,减压蒸馏,取20 mL乙酸乙酯复溶,饱和食盐水洗涤3次.柱层析分离纯化得黄色产物,产量0.262 2 g,产率42%.
L-精氨酸甲酯的制备:-10 ℃下将6.56 g(55.07 mmol)二氯亚砜滴加到20 mL甲醇,加入L-精氨酸4 g(23.0 mmol),35 ℃搅拌过夜,减压蒸馏除去溶剂,加入30 mL乙醚在-20 ℃重结晶,结晶真空干燥,产量4.26 g,产率98%.
L-精氨酸基姜黄素(Cur-Sa-Arg)的制备:取琥珀酸姜黄素(Cur-Sa)0.224 7 g(0.48 mmol),溶于30 mL二氯甲烷中,分别加入EDC 0.092 6 g(0.48 mmol)和DMAP 0.012 7 g(0.096 mmol),于35 ℃恒温水浴反应2 h,加入L-精氨酸甲酯0.112 8 g(0.60 mmol),反应48 h,减压蒸馏,20 mL乙酸乙酯复溶,饱和食盐水洗涤3次,柱层析分离得红褐色产物,产量0.102 5 g,产率33%.Cur-Sa-Arg的合成过程见图1.

图1 L-精氨酸基姜黄素合成路线Fig.1 Synthetic route of Cur-Sa-Arg
1.2.2 Cur-Sa-Arg的表征
UV-Vis分析:样品用四氢呋喃溶解,四氢呋喃为空白,在190~600 nm波长处进行扫描.
FT-IR分析:样品溴化钾压片,在波长240~4 500 cm-1扫描,分辨率为2 cm-1,扫描50次.
1H NMR分析:样品溶于氘代DMSO,置于AVANCE Ⅲ(600 MHz)核磁共振波谱仪中检测.
DSC分析:样品置于差示扫描量热分析仪中检测,升温速度10 ℃ /min,起始温度50 ℃,截止温度为300 ℃,N2气流保护,流速为50 mL/min.
1.2.3 Cur-Sa-Arg溶解度测定
精密称取20 mg姜黄素,无水乙醇定容至10 mL容量瓶中,分别移取姜黄素溶液5、10、20、30、40、50、60、70、80、90和100 μL置于10 mL容量瓶,无水乙醇定容得姜黄素溶液质量浓度分别为1、2、4、6、8、10、12、14、16、18和20 μg/mL.在紫外可见分光光度计190~600 nm处波长扫描,确定姜黄素最大吸收波长为424 nm,在此波长处测定配制姜黄素溶液的吸光度.将Cur-Sa-Arg饱和水溶液,超声30 min,12 000 r/min高速离心10 min,取上清液200 μL,无水乙醇定容至10 mL,得待测样品溶液备用[7].以质量浓度x(μg/mL)对吸光度y作图,得标准方程为y=0.129 5x+0.065,R=0.995 4.测定Cur-Sa-Arg样品中姜黄素吸光度,代入标准曲线公式,计算Cur-Sa-Arg含量,乘上相应稀释倍数得其水中溶解度.
1.2.4 抑菌评价
选择常见敏感菌株大肠杆菌(Escherichiacoli)、铜绿假单胞菌(Pseudomonasaeruginosa)、鼠沙门氏菌(Salmonellaratus)和金黄色葡萄球菌(Staphylococcusaureus)来验证Cur-Sa-Arg化合物抑菌效果.
LB液体培养基配置:按胰蛋白胨∶酵母粉∶氯化钠=2∶1∶2(质量比)加入去离子水摇匀,胰蛋白胨质量分数为1%,调节pH为7.2~7.4,121 ℃下高压蒸气灭菌25 min,备用.
药液配置:精密称取25 mg Cur和Cur-Sa-Arg分别溶于0.5 mL DMSO中,充分溶解摇匀,得到50 mg/mL的药物储备液.精密量取储备液100 μL,加蒸馏水稀释至1 mL,充分摇匀,得其混悬液[10],备用.
菌悬液制备:采用固体斜面活化法传代2次后,用灭菌PBS pH 7.4 磷酸缓冲液3~4 mL反复冲洗固体培养基表面菌株,收集洗液离心,倒掉上清液,保留底部菌沉淀,加无菌缓冲液稀释至1×105CFU/mL摇匀,备用.
抑菌评价:采用微量二倍稀释法,在96孔板每个孔中均加入100 μL灭菌LB液体培养基.测试组:第1孔加入100 μL药物混悬液,反复吹吸混合均匀后,吸取100 μL加入到第2孔,以此类推稀释至第9孔时吸取100 μL打掉,最后加入100 μL菌液;对照组:第1孔加入100 μL空白溶剂,反复吹吸混合均匀后,吸取100 μL加入到第2孔,以此类推稀释至第9孔时吸取100 μL打掉,最后加入100 μL菌液;空白组:加入100 μL无菌缓冲液.每组重复3次.在600 nm处,用酶标仪测定OD值,37 ℃下静置培养18 h,测定OD值.抑菌率计算公式如式1所示,求得Cur-Sa-Arg和Cur的半数抑菌浓度IC50(μg/mL).
抑菌率=(ODR-OD)/(ODR-ODB)×100%,
(1)
其中,OD为实验组测定孔的吸光值;ODR对照组孔的吸光值;ODB为空白组孔的吸光值.
2 结果与讨论
2.1 Cur-Sa-Arg的制备及表征
本研究以琥珀酸作连接臂,通过酯化和酰化反应,将精氨酸键接到姜黄素上,获得L-精氨酸基姜黄素(Cur-Sa-Arg)化合物.产物经UV-Vis、FT-IR、1H NMR和DSC表征,证明成功合成.
图2为反应物与产物的紫外可见光谱图.姜黄素溶液(图2a)最大吸收峰出现在421 nm,琥珀酸酐溶液(图2b)仅在239 nm处有强吸收峰,而合成的琥珀酸姜黄素化合物(图2c)最大吸收峰红移至410 nm,表明琥珀酸酐酯化姜黄素分子上的羟基生成单琥珀酸姜黄素,琥珀酸酐开环,其羧基与姜黄素羟基成酯.姜黄素分子中提供孤对电子的氧原子与琥珀酸羰基形成P-π共轭,羰基吸电子效应使姜黄素共轭体系电子云密度降低,吸收峰发生红移[11].此外,琥珀酸酐开环形成琥珀酰二羧酸,酸酐开环共轭效应减小,使得电子跃迁需要高能量,导致紫外最大吸收峰蓝移至253 nm处.上述变化证明Cur-Sa的成功合成.L-精氨酸甲酯(图2d)紫外最大吸收峰出现在280 nm处,而姜黄素在280 nm处无紫外吸收峰.L-精氨酸基姜黄素(图2e)在281 nm处有强的紫外吸收峰,推测生成Cur-Sa-Arg产物.
反应物及产物的红外图谱见图3.姜黄素(图3a)在3 454 cm-1处出现酚羟基的伸缩振动吸收,1 629和1 506 cm-1处出现苯环CH和C=C的振动吸收峰[12].琥珀酸酐(图3b)在2 974 cm-1处出现亚甲基C—H的伸缩振动峰,1 760 cm-1处为环内酯羰基C=O的伸缩振动峰[13].L-精氨酸(图3c)富含氨基、羟基和胍基,故3 000~3 400 cm-1处出现强红外吸收峰,1 681 cm-1处为酰胺C=O峰,1 620 cm-1处为羧基C=O吸收峰,胍基的弯曲振动吸收在1 544 cm-1处[14].相比姜黄素,琥珀酸姜黄素游离出单羧基,在3 436 cm-1处的吸收峰变强;1 695 cm-1处酯键伸缩振动吸收峰以及2 916与2 842 cm-1的亚甲基和次甲基伸缩振动吸收峰明显变强[14],显示成功合成琥珀酸姜黄素(图3d).与L-精氨酸相比,L-精氨酸甲酯(图3e)的酯羰基峰出现在1 743 cm-1处,而1 620 cm-1处的羧基羰基吸收峰消失,可证明L-精氨酸甲酯合成.与琥珀酸姜黄素(图3d)相比,L-精氨酸基姜黄素形成酰胺键,游离羧基消失,故在3 436 cm-1处吸收峰强度改变,3 070 cm-1处新出现胍基峰,1 749 cm-1处出现L-精氨酸甲酯的酯羰基峰,1 568 cm-1出现强酰胺Ⅱ带吸收峰(图3f).

a. 姜黄素;b. 琥珀酸酐;c. 琥珀酸姜黄素;d. L-精氨酸甲酯;e. L-精氨酸基姜黄素.图2 样品紫外-可见光谱Fig.2 UV-Vis spectra of samples
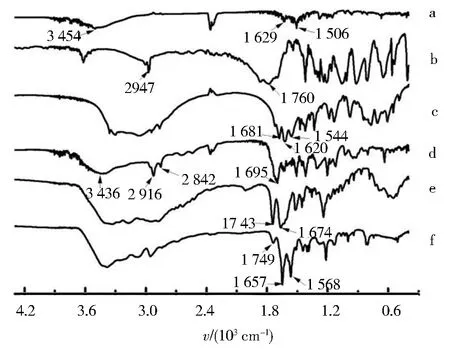
a. 姜黄素;b. 琥珀酸酐;c. L-精氨酸;d. 琥珀酸姜黄素;e. L-精氨酸甲酯;f. L-精氨酸基姜黄素.图3 样品红外光谱Fig.3 FTIR spectra of samples
样品的1H NMR图谱(600 MHz,DMSO-d6)见图4.姜黄素(图4a)中9.78为酚羟基的质子峰,6.84~7.64归属于苯环质子峰,3.63为环上甲氧基质子峰[15].与姜黄素相比,琥珀酸姜黄素(图4b)中的琥珀酸的2个—CH2—质子峰出现在2.42~2.54;此外,12.1处新出现的峰为琥珀酸酐键接姜黄素羟基后游离出的单羧基质子峰[16],证明单琥珀酸姜黄素成功合成.L-精氨酸甲酯(图4c)氨基和胍基质子峰出现在8.69、8.50、7.99、7.89,甲氧基质子峰出现在3.75,氨基酸碳链在1.49~4.06出现多重质子峰[17].L-精氨酸基姜黄素(图4d)中6.74~7.55归属为苯环质子峰,3.62为甲氧基质子峰,在2.41~2.70出现琥珀酸连接臂的2个—CH2—质子峰,3.15~3.83处出现精氨酸甲酯—OCH3质子峰,胍基和氨基质子峰出现在8.21~8.62.上述1H NMR图谱数据显示单琥珀酸姜黄素成功连接精氨酸甲酯.
主要原料及产物的差示扫描量热图(DSC)如图5所示.姜黄素粉末(图5a)的熔融吸热峰出现在183 ℃.琥珀酸酐(图5b)熔点吸热峰出现在125 ℃.L-精氨酸(图5c)分别在223、246 ℃处出现2个吸热峰,与文献报道一致[18].酯化合成的琥珀酸姜黄素(图5d),在167 ℃出现单一熔点吸热峰,佐证琥珀酸姜黄素的合成.L-精氨酸甲酯(图5e)生成新酯键,其熔点吸热峰呈现在193 ℃.L-精氨酸基姜黄素(图5f)新形成的酰胺键,在232 ℃时出现新熔点吸热峰.

a.姜黄素;b.琥珀酸姜黄素;c.L-精氨酸甲酯;d.L-精氨酸基姜黄素.图4 样品核磁图谱Fig.4 1H NMR spectra of samples

a. 姜黄素;b. 琥珀酸酐;c. L-精氨酸;d. 琥珀酸姜黄素;e. L-精氨酸甲酯;f. L-精氨酸基姜黄素.图5 样品的差示扫描量热图Fig.5 DSC thermograms of the samples
2.2 Cur-Sa-Arg中Cur溶解度测定
采用紫外-可见分光光度法考察了Cur-Sa-Arg中姜黄素(Cur)的溶解度.经溶解度实验测得每毫升Cur-Sa-Arg水溶液中含Cur 30.1 μg,文献[4]报道Cur在水中的溶解度为11 ng/mL,制备Cur-Sa-Arg将Cur溶解度提高了约3 000倍.
2.3 Cur-Sa-Arg抑菌评价
采用测定半数抑菌浓度IC50值来评价合成的Cur-Sa-Arg对铜绿假单胞菌、大肠杆菌和鼠沙门氏菌等革兰氏阴性菌以及革兰氏阳性菌金黄色葡萄球菌的体外抑菌活性.
抑菌实验结果显示,与姜黄素相比,Cur-Sa-Arg新化合物对铜绿假单胞菌、大肠杆菌和鼠沙门氏菌等革兰氏阴性菌的抑菌的IC50降低3~6倍,对金黄色葡萄球革兰氏阳性菌抑菌的IC50降低2倍.结果表明,姜黄素衍生物水溶性改善,提高了姜黄素的体外抑菌力.

表1 Cur-Sa-Arg和Cur的半数抑菌浓度IC50测定结果
3 结论
本文选琥珀酸作连接臂,通过酯化和酰化反应,将精氨酸键接到姜黄素上,获得Cur-Sa-Arg化合物.化合物经UV-Vis、FT-IR、1H NMR谱和DSC表征,证明成功合成Cur-Sa-Arg.相比姜黄素,Cur-Sa-Arg化合物可极大改善姜黄素水中溶解度,且化合物呈现更优的抗菌性.

