侧孢短芽孢杆菌S2-31 拮抗下细辛叶枯病菌转录组差异表达分析
刘亚苓 于营 鲁海坤 雷慧霞 隋昕 郭靖
(中国农业科学院特产研究所,长春 130112)
细辛(Asarum sieboldiiMiq.)为多年生草本植物,是我国传统常用中药材[1]。叶枯病是细辛的主要病害,由菌刺孢属(Mycocentrospora)真菌槭菌刺孢(Mycocentrospora acerina)侵染所致,发生普遍且发病严重度高[2]。发生严重时病斑腐烂、穿孔,甚至整个叶片枯萎,严重影响药材的产量。目前,生产上细辛叶枯病的防治主要采用化学方法,但化学防治所造成的环境污染、药物残留等问题日益显现。生物防治具有生态安全、无残留、特应性强等优点,在药用植物病害防治上具有明显的优势。目前,尚未有细辛叶枯病生物防治方法的相关报道,细辛作为传统常用中药材,亟待寻找生态安全的方法防治叶枯病。
侧孢短芽孢杆菌(Brevibacillus laterosporus)作为一种多功能菌,是生物防治研究的热点,对多种植物病害都有广谱的抑制作用[3-4]。目前,对侧孢短芽孢杆菌抑制病原菌机制的研究主要是对其不同代谢产物抗菌活性的研究。多项研究表明,侧孢短芽孢杆菌可产生多种具有抗菌作用的活性代谢产物,其产生的蛋白酶、几丁质酶、抗菌肽等外泌蛋白对立枯丝核菌(Rhizoctonia solani)、尖孢镰刀菌(Fusarium oxysporum)、木贼镰刀菌(Fusarium equiseti)以及小麦赤霉病菌(Gibberella sanbinetti)、水稻稻瘟病菌(Magnaporthe grisea)和辣椒疫霉菌(Phytophthora capsici)等多种植物病原菌均有广谱抑菌作用[3-6]。其在发酵过程中产生的侧孢菌胺,对革兰氏阴性菌和革兰氏阳性菌均有抑制作用[7]。赵璟等[8]筛选出的侧孢短芽孢杆菌A-60,其产生的抗菌肽BL-A60 可抑制辣椒疫霉菌菌丝的生长、孢子囊产生和休止孢子的萌发。任召珍等[9]研究发现,侧孢短芽孢杆菌LH-1 产生的抗菌肽可使菌体细胞膜脂双层外侧发生扭曲,细胞膜发生相变,从而导致菌体死亡。而侧孢短芽孢杆菌抑制植物病原菌的分子机制的研究鲜见报道。
本实验室前期获得一株对细辛叶枯病菌具有较好拮抗效果的侧孢短芽孢杆菌S2-31 菌株,皿内抑菌和盆栽试验的结果证明该菌株对细辛叶枯病具有较好的防治作用[10],而国内外尚未见侧孢短芽孢杆菌拮抗细辛叶枯病菌的相关报道。随着生物信息学和组学技术的发展,转录组学已成为应用最为广泛的研究手段。通过转录组测序(RNA-Seq)可以获得菌株在RNA 水平基因表达的相关信息,从而获得不同处理的基因表达水平的差异。本研究拟通过对侧孢短芽孢杆菌S2-31 菌株拮抗下的细辛叶枯病菌的转录组测序,分析S2-31 菌株抑制病原菌表达的转录组学特征,探究侧孢短芽孢杆菌抑制叶枯病菌的分子机制,旨为侧孢短芽孢杆菌作为细辛叶枯病生防菌的开发奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 供试病原菌 细辛叶枯病菌——槭菌刺孢(Mycocentrospora acerina)由本实验室分离鉴定及保存。将病原菌于PDA 培养基上培养后,备用。
1.1.2 供试培养基 马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖肉汤(PDB)培养基、营养琼脂(NA)培养基和Luria-Bertani(LB)肉汤培养基。
1.1.3 供试拮抗菌 本实验室分离的1 株对细辛叶枯病具有较好拮抗效果的侧孢短芽孢杆菌(Brevibacillus laterosporus),菌株编号为S2-31,现保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号CGMCC No.18015。
1.2 方法
1.2.1 侧孢短芽孢杆菌对细辛叶枯病菌菌丝生长的影响 采用平板对峙的方法,取直径5 mm 的叶枯病病原菌菌饼(PDA 培养基),接种于PDA 平板的中央,在距离中心约2.5 cm 的位置划线接种活化好的侧孢短芽孢杆菌进行对峙培养,每板接种3 次,以只接种叶枯病菌菌饼的平板为对照,每处理重复3 次,25℃恒温培养7 d[10]。观测抑菌效果并取病原菌菌落边缘的菌丝显微镜下进行形态观察。
1.2.2 侧孢短芽孢杆菌发酵液对叶枯病菌基因表达的影响
1.2.2.1 样品制备 将100 mL PDB 液体培养基装入250 mL 锥形瓶中,灭菌后,接入直径5 mm 的叶枯病菌菌饼5 个,160 r/min、25℃条件下振荡培养48 h。同时,将在NA 培养基上活化好的S2-31 菌株接入装有150 mL LB 液体培养基的锥形瓶中,160 r/min、32℃条件下振荡培养48 h,用无菌滤膜过滤除去菌体。取S2-31 的发酵培养滤液50 mL,加入接有叶枯病菌的PDB 液体培养基中(记为S 组),以加入相同体积的蒸馏水为对照(记为CK 组),每处理重复3 次,在160 r/min、25℃条件下振荡培养4 d 后用纱布过滤菌丝体,无菌蒸馏水洗涤,冻干后于-80℃保存,用于提取总RNA。
1.2.2.2 总RNA 提 取、 文 库 构 建 和Illumina 测序 用TRIzol® Reagent(Invitrogen)分别提取S 组和对照组病原菌菌丝总RNA,每处理3 个生物学重复。用DNase I(TaKaRa)去除基因组DNA。用Oligo dT将mRNA 富集后,加入破碎缓冲液(Fragmentation buffer)将mRNA 断裂为小片段,在逆转录酶的作用下利用随机引物(Illumina)合成双链cDNA。根据Illumina 的文库构建协议,对合成的cDNA 进行末端修复、磷酸化和‘A’碱基添加,然后对连接产物进行纯化和片段分选,最后进行PCR 扩增,得到cDNA 文库。构建的文库采用2100 Bioanalyser(Agilent)测定总RNA 的完整性和纯度,并用ND-2000(NanoDrop Technologies,美国)对RNA 样品进行定量,确保样品质检合格(OD260/280=1.8-2.2,OD260/230≥2.0,RIN ≥6.5,28S:18S ≥1.0,>2 μg)后,由上海美吉生物医药科技有限公司进行转录组测序。
1.2.2.3 测序数据的处理 经序列测定后直接获得的原始测序数据(Raw reads)中常含有带接头、质量较差的序列。为保证信息分析的质量,须对 raw reads 进行过滤筛选,得到可供后续分析的 clean reads。参照Grabherr 等[11]提出的方法,将所得clean reads 通过 Trinity 软件(http://trinityrnaseq.sf.net)进行从头拼接组装(de novoassembly),以Trinity 拼接成的非冗余转录组数据作为后续分析的参考序列。采用EdgeR 差异分析软件包计算log2(Fold change)及其统计检验的P值,以|log2(Fold change)|>1 且P<0.05 作为差异表达基因(Differentially expressed gene,DEG)的筛选条件。通过 Blastx 算法(E-value<10-5),将筛选得到的unigene 序列与NCBI、NR(Nonredundant protein)、基因本体(Gene Ontology,GO)、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)等公共数据库中的已知序列进行比对,获得该unigene 的注释信息。同时,利用Goatools 和KOBAS 对unigene 进行GO 功能富集和KEGG 通路分析[12]。
1.2.3 RT-qPCR 验证 为验证转录组测序结果的准确性,从测序获得的差异表达基因中选取7 个差异表达的unigene 进行RT-qPCR 验证。以GAPDH 作为内参基因,利用Primer Premier 5 软件进行引物设计。总RNA 提取参照2.6.2 进行,利用TransScripROne-Step gDNA Removal and cDNA Synthesis SuperMix 和进行cDNA 的合成,统一浓度为100 ng/μL。利用TransStartRTop Green qPCR SuperMix(Transgen Biotech)试剂盒由美国ABI QuantStudio 3 实时荧光定量PCR 系统进行RT-qPCR 反应。反应体系为:2 μL cDNA(100 ng/μL)、0.8 μL 上下游引物(10 μmol/L)、10 μL 2×TransStartRTop Green qPCR SuperMix 和7.2 μL ddH2O。反应程序为:94℃ 30 s;94℃ 5 s;退火温度56℃,共40 个循环,结果采用2-△△Ct法进行数据分析。每个样品3 个平行,3 次生物学重复。
2 结果
2.1 侧孢短芽孢杆菌对细辛叶枯病菌的抑制作用
如图1 所示,对照组的叶枯病菌菌丝粗细均匀,表面光滑;经侧孢短芽孢杆菌对峙培养后,叶枯病菌菌落边缘菌丝出现皱缩、扭曲等现象,并且在对峙培养的菌落边缘产生了大量的厚垣孢子,表明叶枯病菌的菌丝生长受到抑制。

图1 S2-31 对峙培养对叶枯病菌菌丝形态的影响
2.2 测序结果的评估
供试6 个样本过滤掉低质量的序列reads 后得到的序列的clean reads 如表1 所示,满足Q30 标准的碱基数均达到91%以上,GC 含量比例均在35%-65%之间。经de novo拼接组装后,共得到17 069条单基因,其平均长度为3 385.86 bp,N50 为6 120 bp。这表明测序质量较高,适合用于后续分析。
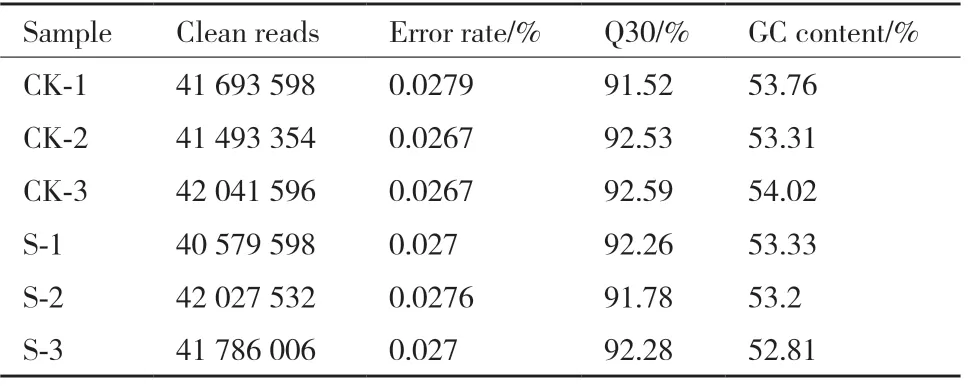
表1 转录组测序数据统计
2.3 差异表达分析
与对照组相比,经侧孢短芽孢杆菌处理后的叶枯病菌(S)中有3 681 个DEGs,其中2 224 个相对上调,1 457 个相对下调(图2)。对其进行聚类分析,S 组与CK 组的基因差异表达情况如图3 所示。
2.4 差异表达基因的GO功能分析
对3 681 个DEGs 进行GO 功能注释分析,得到2 355 个DEGs 的注释信息,其中1 361 个DEGs 为上调表达,994 个DEGs 为下调表达。分别将上调和下调表达的DEGs 按GO 功能分类,注释的前20个GO 生物学功能中,均包括生物过程(Biological process)8 个亚群、细胞组分(Cellular component)8 个亚群和分子功能(Molecular function)4 个亚群(图4)。生物过程大类中,上调表达的DEGs 主要分布在代谢过程(Metabolic process),其次是细胞进程(Cellular process);下调表达的DEGs 主要分布在细胞进程,其次是代谢过程。细胞组成大类中,上调表达的DEGs 在膜(Membrane)、膜组分(Membrane part)中分布较多;下调表达的DEGs 在细胞组分(Cell part)和细胞(Cell)中分布较多。分子功能大类中,上调和下调表达的DEGs 均主要分布在催化活性(Catalytic activity)和结合(Binding)两个亚群中。菌丝生长是菌丝顶端细胞扩张的过程,细胞、细胞组分、膜、膜组分等细胞组成部分和细胞进程等生物过程均与菌丝细胞的生长、扩张密切相关。
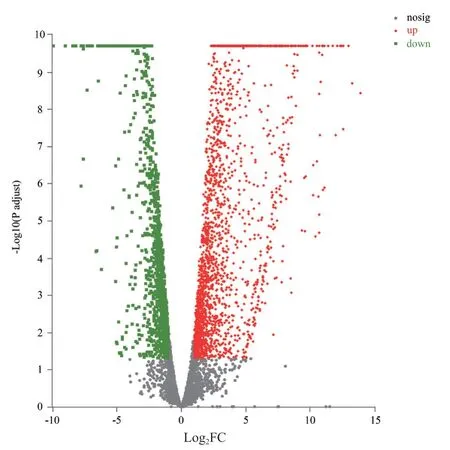
图2 不同处理叶枯病菌DEGs 火山图
2.5 差异表达基因的KEGG富集分析
进一步利用KEGG 富集分析3 681 个差异表达基因,定位到115 条生物学通路,主要包括代谢(Metabolism)、遗传信息处理(Genetic information processing)、细胞过程(Cellular processes)、环境信息处理(Environmental information processing)和生物体系统(Organismal systems)5 大类途径,其中,代谢途径富集的DEGs 最多,主要包括淀粉和蔗糖代谢(Starch and sucrose metabolism)、氨基糖和核苷糖代谢(Amino sugar and nucleotide sugar metabolism)以及糖基磷脂酰肌醇(GPI)锚定生物合成(Glycosylphosphatidylinositol(GPI)-anchor biosynthesis)等通路;其次是遗传信息处理途径,主要包括剪接体(Spliceosome)和RNA 聚合酶(RNA polymerase)等通路;然后是细胞过程途径,主要包括胞吞作用(Endocytosis)和过氧化物酶体(Peroxisome)2 条通路。其中,淀粉和蔗糖代谢、剪接体和胞吞作用富集到的基因数目最多,分别为37、31 和30 个。

图3 不同处理和重复的间DEGs 的聚类热图分析
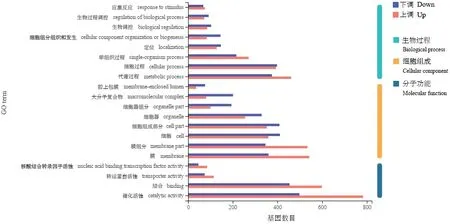
图4 S2-31 差异表达基因的GO 注释
对2 224 个上调表达和1 457 个下调表达的DEGs 分别进行KEGG 富集分析,共有346 个上调表达的DEGs 定位到100 条KEGG 通路中,显著富集的通路有淀粉和蔗糖代谢(Starch and sucrose metabolism)、氨基糖和核苷糖代谢(Amino sugar and nucleotide sugar metabolism)(图5);另有337 个下调表达的DEGs 定位到100 条KEGG 通路中,显著富集的通路有遗传信息处理途径的剪接体通路,细胞过程途径的胞吞作用和过氧化物酶体通路,以及代谢途径的GPI 锚定合成通路(图6)。其中剪接体、过氧化物酶体、胞吞作用等通路均与菌丝生长密切相关,由此推测侧孢短芽孢杆菌可能通过以上通路调控病原菌菌丝的生长。
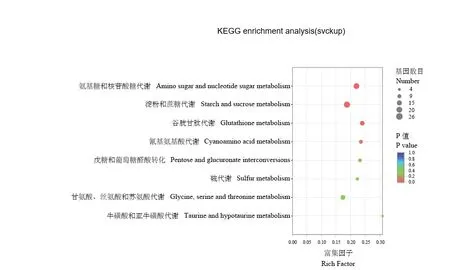
图5 S2-31 处理组上调表达差异基因的KEGG 富集分析

图6 S2-31 处理组下调表达差异基因的KEGG 富集分析
2.6 与菌丝生长相关代谢通路的基因差异表达分析
根据已报道的与菌丝生长发育相关的基因、蛋白及酶类,从显著富集的通路中筛选出差异表达较为显著的相关基因(P<0.01)列于表2。
2.6.1 与过氧化物酶体形成有关的基因 过氧化物酶体中可发生多种生化反应,如脂肪酸的β 氧化为菌丝生长提供能量[13],与病原真菌的生长发育密切相关。参与过氧化物酶体形成和增殖的基因被称为PEX 基因。本研究中,共筛选到30 个与过氧化物酶体有关的DEGs,其中,11 个DEGs 上调表达,19 个DEGs 下调表达,包括参与形成过氧化物酶体的PEX16和PEX19和参与菌丝分解的α/β 水解酶(alpha/beta-hydrolase)的编码基因(表2)。其中PEX16和PEX19显著下调表达(P<0.01),分别为对照组CK 的0.148 和0.317 倍;α/β 水解酶编码基因显著上调表达,上调为对照组的7.412 倍。
2.6.2 与GPI 锚定相关的基因 GPI 锚定蛋白位于真菌的细胞壁,对真菌的形态转换、细胞壁合成具有重要的作用。本研究中,TRINITY_DN4901_c0_g4、TRINITY_DN4400_c0_g1 和TRINITY_DN4854_c1_g10 均参与GPI 锚定生物合成通路中GPI-N-乙酰基-葡萄糖胺转移酶(GPI-N-acetylglucosaminyltransferase,GPI-GnT)复合体的构成,分别编码PIG-A、PIG-C 和PIG-H(图7),且都显著下调。另外,参与GPI 和蛋白连接的GPI:转酰胺基酶(GPI:protein transamidase)的编码基因也显著下调(P<0.01),为对照组的0.291 倍(表2)。
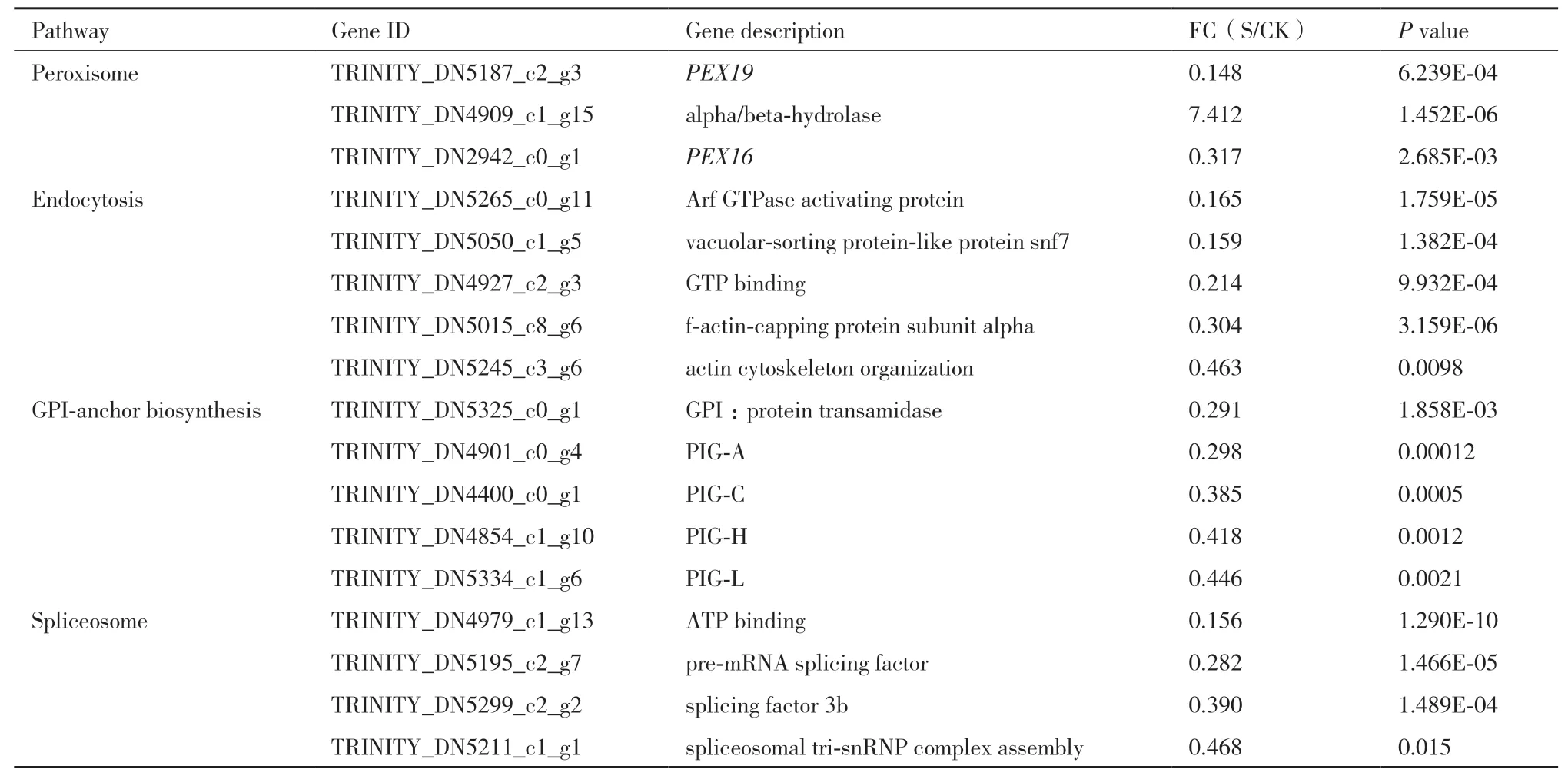
表2 与叶枯病菌菌丝生长相关的差异表达基因
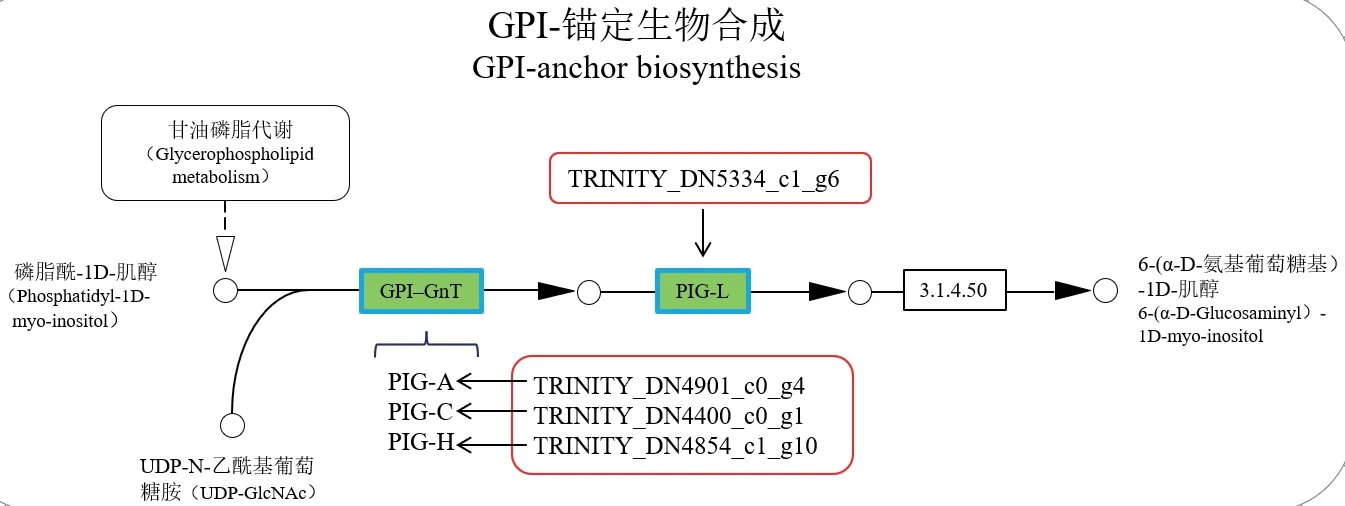
图7 S2-31 处理组GPI 锚定生物合成通路中基因的参与情况
2.6.3 与胞吞作用有关的基因 胞吞作用是一个复杂的质膜运输过程,该过程参与调控真菌菌丝顶端的形态建成和真菌分生孢子的萌发。本研究共筛选到30 个与胞吞作用有关的基因,其中8 个上调表达,22 个下调表达,其中包括编码丝状肌动蛋白亚基和肌动蛋白骨架的基因、肌动蛋白定位等相关的基因,如Arf GTPase 激活蛋白、囊泡分拣蛋白snf7、GTP结合、丝状肌动成帽蛋白α 亚基和肌动蛋白细胞骨架组织均显著下调(表2)。
2.6.4 与剪接体相关的基因 剪接体相关的基因与菌丝的生长和致病性密切相关,在遗传信息处理途径中剪接体通路富集最为显著,根据差异基因的差异显著性进行筛选,ATP 结合和pre-mRNA 剪辑因子的差异更为显著(P值分别达到1.290E-10 和1.466E-09)且表达量下调倍数较大,分别为对照组的0.156 和0.282 倍(表2)。
2.7 RT-qPCR验证
为检验转录组测序数据的准确性,从与菌丝生长相关的DEGs 中选取7 个差异显著的基因进行引物设计(表3),利用RT-qPCR 对转录组数据进行验证(图8),其中3 个上调表达基因,4 个下调表达基因。结果表明,转录组数据和RT-qPCR 的验证结果一致。

表3 RT-qPCR 验证基因及引物设计

图8 叶枯病菌转录组测序结果的RT-qPCR 验证
3 讨论
生防细菌的抑菌机理主要是产生抗菌素[14-15]。侧孢短芽孢杆菌作为重要的生防细菌资源,对多种植物病原微生物都具有广谱的抑菌特性。大量研究表明,侧孢短芽孢杆菌可产生具有抑制多种植物病原微生物生长的代谢产物,赵秀香等[16-17]研究发现,侧孢短芽孢杆菌B8 产生的抗菌蛋白使立枯丝核菌(R. solani)的菌丝断裂、膨大、内容物外渗,并且破坏病菌菌体细胞膜的透性,最终导致菌体细胞壁的消融和菌丝体消解。本研究表明经侧孢短芽孢杆菌与叶枯病菌的对峙培养后叶枯病菌菌落边缘菌丝出现了皱缩、扭曲、膨大等现象,可能是由于侧孢短芽孢杆菌产生的抗菌代谢物质造成了菌丝的畸形,抑制了叶枯病菌菌丝的生长。厚垣孢子是菌丝在不良环境条件下诱导形成的抗性结构[18],经侧孢短芽孢杆菌的对峙培养后的叶枯病菌产生了厚垣孢子,说明S2-31 的对峙培养形成了不利于叶枯病菌生长的环境,诱导其产生了厚垣孢子。
菌丝生长是菌丝细胞顶端延伸管延伸的过程,该过程中细胞的扩张是菌丝生长的主要机制。本实验通过对侧孢短芽孢杆菌抑制后病原菌菌丝的DEGs进行GO 功能注释和KEGG 富集分析。结果表明差异表达基因主要注释到生物过程中的细胞过程,细胞组成中的膜、膜组分、细胞和细胞组分等,菌丝的生长是通过在菌丝尖端凝集新的质膜,因此以上GO term 与菌丝细胞的扩张和生长紧密相关。KEGG富集分析表明差异表达基因主要富集的通路有遗传信息处理途径的剪接体、RNA 聚合酶通路;细胞过程途径的胞吞作用和过氧化物酶体通路;以及代谢途径的GPI 锚定合成通路。且下调表达的DEGs 主要富集在过氧化物酶、胞吞作用、剪接体以及GPI锚定生物合成等通路。根据显著性筛选到的与菌丝生长发育相关的DEGs 同样涉及到这些途径中。
研究表明剪接体通路与菌丝生长密切相关,剪接体通路的ATP 结合蛋白和pre-mRNA 剪接是禾谷镰刀菌(Fusarium graminearum)菌丝生长所必需[19-20]。本研究结果发现侧孢短芽孢杆菌拮抗后病原菌菌丝的ATP 结合和mRNA 前体剪接因子的表达量显著下降,表明菌丝生长受到抑制。
过氧化物酶体通路可参与多种生化过程,过氧化物酶体可在病菌损伤时阻塞菌丝细胞膜上的破损孔洞,起到防止胞质外流的作用[21]。多项研究表明,稻瘟病菌(M. grisea)、瓜类植物炭疽病菌(Colletotrichum orbiculare)、禾谷镰刀菌(F.graminearum)等多种植物病原菌中的PEX 基因都参与过氧化物酶体的形成和增殖[22-25]。本试验结果显示,过氧化物酶体通路被显著富集,通路内的PEX16和PEX19的表达量显著下降,表明菌丝过氧化物酶体的形成过程受阻。同时,在过氧化物酶体中脂肪酸β-氧化产生的乙酰辅酶A 进入乙醛酸循环[13],实现脂肪到糖的转变,进而为菌丝生长提供能量。另外,真菌细胞壁的主要成分几丁质是由乙酰CoA 衍生而来。Bhambra 等[26]研究表明,过氧化物酶体的缺陷阻碍了几丁质的合成,对菌丝细胞壁的完整性造成影响。因此S2-31 可能是通过抑制过氧化物酶体的形成从而抑制脂肪酸β-氧化、乙醛酸循环以及几丁质合成等过程,进而影响能量供应和细胞壁的完整性,造成菌丝生长的缺陷。
GPI-锚定蛋白合成通路中的GPI 锚定蛋白(GPIAPs)对真菌的黏附、形态转换和细胞壁合成等有着重要的影响。Sundstrom 等[27]研究发现,GPI-APs Hwp1 在介导菌丝形成方面发挥重要作用。同时,GPI 锚定序列翻译后,在转酰胺基酶的作用下将GPI 连接到蛋白上,合成GPI-APs。本试验中,编码GPI:转酰胺基酶的基因显著下调,表明GPI-APs的合成受到影响。另外,GPI 锚定合成的第一步由GPI-N-乙酰基-葡萄糖胺转移酶(GPI-GnT)复合体催化,该复合体由PIG-A、PIG-H、PIG-C、PIG-P、GPI1、PIG-Y 和 DPM2 7 个蛋白组成,在本试验中,编码PIG-A、PIG-C 和PIG-H 的基因显著下调,GPI锚定合成受到抑制。李晏等[28]研究发现,破坏GPI锚的结构或阻碍其生物合成,可以阻碍白色念珠球菌(Monilia albican)细胞壁的合成,从而抑制真菌的生长。因此,侧孢短芽孢杆菌可能通过抑制了GPI:转酰胺基酶编码基因的表达和GPI-GnT 复合体的形成,从而抑制了GPI 锚定蛋白的合成,进而影响叶枯病菌细胞壁的形成,最终抑制菌丝的生长。
胞吞作用通路在调控真菌菌丝顶端的形态建成过程中发挥重要的作用,该通路中的肌动蛋白是胞吞点形成和新的细胞骨架的生成重要参与者[29-30]。本研究中,胞吞作用通路中编码丝状肌动蛋白成帽蛋白α 和肌动蛋白细胞骨架组织的基因表达量均显著下调,表明肌动蛋白和细胞骨架的形成受到影响。胞吞作用通路中的Arf GTPase 激活蛋白和囊泡分拣蛋白snf7 与囊泡的形成和运输有有关,在本实验中其编码基因分别下调了0.165 和0.159 倍。刘秀等[31]研究表明,稻瘟病菌(M. grisea)Arf GTPase 缺失突变体的营养菌丝生长减慢,侵染菌丝减少且生长减慢。周晨等[32]研究表明,稻瘟病菌中与囊泡运输相关基因的缺失导致胞吞作用受到不同程度的影响,缺失突变体在分生孢子的产生、萌发及细胞壁完整性等方面存在缺陷。侧孢短芽孢杆菌可能通过引起胞吞作用中与编码肌动蛋白相关和囊泡相关的基因下调表达从而抑制了菌丝的生长。
4 结论
侧孢短芽孢杆菌可以抑制细辛叶枯病菌菌丝的生长;对S2-31 拮抗下叶枯病菌的转录组测序分析发现,病菌生长受阻可能与GPI 锚定、胞吞作用和过氧化物酶体、剪接体等通路的调控相关,但具体的机制还需进一步研究。本研究结果为进一步研究侧孢短芽孢杆菌抑制细辛叶枯病菌的机制及S2-31菌株的开发应用提供依据。

