DCE-MRI定量参数预测胰腺癌组织生物学特征的初步研究
赵娓娓,宦怡,郑敏文,任静,韩志巍
胰腺癌恶性程度极高、起病隐匿,约2/3患者发现时已为进展期,难以I期手术切除, 5年生存率不足5%[1]。然而在胰腺癌的评估中,尽可能明确其“恶性”病理状况,如分期、分化、有无血管侵犯及淋巴转移等,有助于个性化诊断和治疗[2]。由于多数患者无法手术切除,难以获取详细病理信息,而穿刺活检不仅为有创性,且因肿瘤往往存在异质性、穿刺标本不能反映其整体情况。因此,寻求一种可评估病变整体情况的无创性检查方法,对于胰腺癌的精准评估及指导治疗具有重要意义。
动态对比增强MRI(dynamic contrast-enhanced MRI,DCE-MRI)利用药代动力学参数可评估组织及肿瘤的功能特征[3],既往已有将其应用于肿瘤良恶性的评估、术前分期和预后预测等方面的研究[4-6]。本研究旨在分析DCE-MRI药代动力学参数能否准确评估胰腺癌分期、分化、血管侵犯及淋巴转移等。
材料与方法
1.一般资料
将2018年5月-2019年8月来本院就诊的连续41例疑似胰腺癌患者纳入观察。纳入条件:①超声、CT或其它影像学检查怀疑为胰腺癌;②不合并影响胰腺的其它疾病;③无使用山莨菪碱病史,无磁共振扫描禁忌证;④MRI检查前未进行针对胰腺癌的相关治疗。最终纳入符合条件且经手术病理证实的胰腺癌患者21例。其中,女11例,年龄20~74岁,中位年龄52岁;男10例,年龄28~71岁,中位年龄59岁。肿瘤位于胰头区16例,体尾部5例;直径>3 cm者8例,≤3 cm者13例;肿瘤分期为Ⅰ期者5例,Ⅱ~Ⅲ期者16例;低分化肿瘤9例,中~高分化12例;有血管侵犯者8例,无血管侵犯者13例;伴淋巴结转移者9例,无淋巴转移者12例。本研究获得了本院医学伦理委员会的批准。
2.DCE-MRI扫描和图像分析
使用GE Discovery MR750 3.0T磁共振扫描仪和八通道相控阵体部线圈。检查前禁饮、禁食4 h。常规行T1WI平扫和DCE-MRI扫描(肝脏3D容积加速梯度回波序列),扫描参数:TR 3.2 ms,TE 1.5 ms,反转角20°,视野360 mm×360 mm,矩阵260×160,层厚4.0 mm,层数60,带宽83.33 Hz/pixel。DCE-MRI共扫描40期,扫描时间7 s/期。扫描3期后团注对比剂欧乃影,剂量0.1 mmol/kg,流率2.5 mL/s,对比剂注射完毕后立即推注20 mL生理盐水冲管。
使用Research-DCE MRI Tool软件(Omni Kinetics,Version 2.00)进行量化分析。首先配准并载入图像;然后于腹主动脉内勾画感兴趣区(regions of interest,ROI),计算动脉输入函数(arterial input function,AIF);随后,在胰腺癌病灶内手动勾画ROI,尽量包含所有肿瘤组织,避免到达组织边缘并避开血管及主胰管;最后,选择Extended Tofts Linear模型计算药代动力学量化参数(Ktrans、Kep、Ve和Vp)。
3.统计学分析
使用SPSS 17.0软件进行统计学分析。计量资料采用均数±标准差表示,胰腺癌不同组间DCE-MRI定量参数的比较采用独立样本t检验,采用受试者工作特征曲线(receiver operator characteristic curve,ROC曲线)对各项定量参数鉴别胰腺癌不同病理状况的效能进行评估。以P<0.05为差异有统计学意义。
结 果
1.DCE-MRI定量参数的组间比较
本研究中21例胰腺癌的Ktrans、Kep、Ve和Vp值分别为0.113±0.026、0.340±0.088、0.335±0.072和0.076±0.016。胰腺癌患者不同临床和病理特点之间DCE-MRI药代动力学参数的比较见表1、图1。胰头区胰腺癌的Vp值高于体尾部(P=0.014);最大径>3 cm的胰腺癌的Ktrans和Kep值均高于最大径≤3 cm的胰腺癌(P=0.036、0.026);Ⅰ期胰腺癌的Ktrans和Kep值均低于Ⅱ~Ⅲ胰腺癌(P=0.005、0.037);不同性别和年龄分组(>50和≤50岁)之间各项定量参数值的差异均无统计学意义(P值均>0.05)。
低分化胰腺癌的Ktrans、Kep和Vp值均高于中~高分化胰腺癌,低分化胰腺癌的Ve值低于中~高分化胰腺癌;伴血管侵犯的胰腺癌Ktrans、Kep和Vp值均高于不伴血管侵犯者;伴淋巴转移的胰腺癌Ktrans、Kep和Ve值均高于不伴淋巴转移者;上述指标测量值的组间差异均有统计学意义(P值均<0.05)。
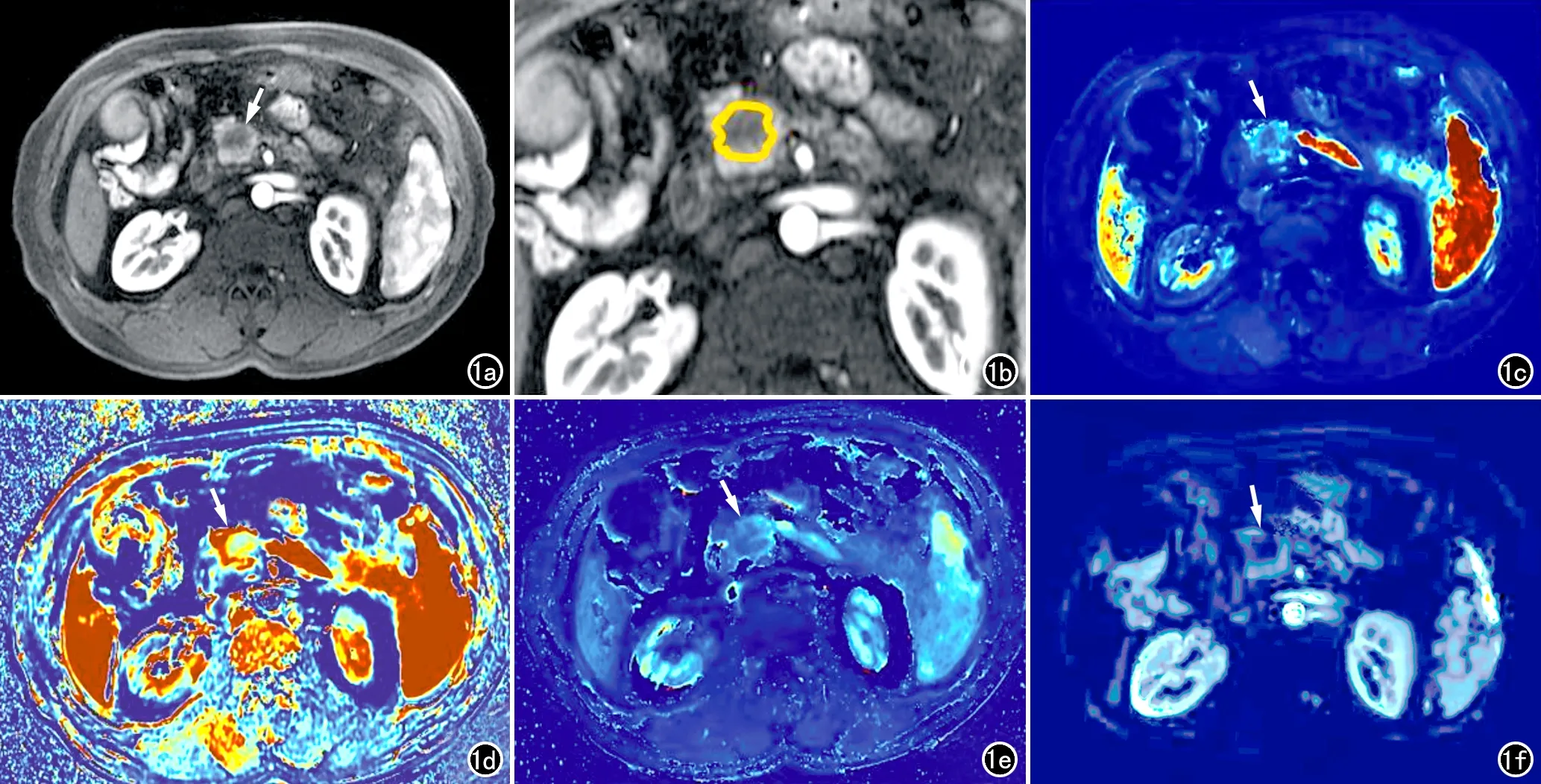
图1 患者,男,57岁,胰头区胰腺癌。a)增强CT显示肿瘤位于胰头(箭),呈不均匀轻度强化;b)CT增强图像,显示癌灶内ROI的勾画(橘色线条);c)Ktrans伪彩图,显示肿瘤的Ktrans值降低(Ktrans=0.121,箭);d)kep伪彩图,显示肿瘤的kep值降低(kep=0.396,箭);e)Vp伪彩图,显示肿瘤的Vp值降低(Vp=0.314,箭);f)Ve伪彩图,显示肿瘤的Ve值降低(Ve=0.074,箭)。

表1 不同临床及病理状况下胰腺癌DCE-MRI药代动力学参数的比较
2.DCE-MRI参数的诊断效能
Ktrans和Kep诊断Ⅱ~Ⅲ期胰腺癌的AUC分别为0.931和0.812(图2a);Ktrans、Kep和Vp诊断低分化胰腺癌的AUC分别为0.829、0.843和0.750(图2b),Ve诊断中~高分化胰腺癌的AUC为0.926(图2b); Ktrans、Kep和Vp诊断有血管侵犯胰腺癌的AUC分别为0.817、0.832和0.875(图2c);Ktrans、Kep和Ve诊断有淋巴转移胰腺癌的AUC分别为0.796、0.801和0.755(图2d)。

图2 DCE-MRI药代动力学参数评估胰腺癌不同病理状况的ROC曲线图。a)Ktrans和Kep诊断Ⅱ~Ⅲ期胰腺癌的ROC曲线的AUC分别为0.931和0.812;b)Ktrans、Kep、Ve和Vp诊断低分化胰腺癌的ROC曲线的AUC分别为0.829、0.843、0.074和0.750;c)Ktrans、Kep和Vp诊断有血管侵犯胰腺癌的ROC曲线的AUC分别为0.817、0.832和0.875;d)Ktrans、Kep和Ve诊断有淋巴转移胰腺癌的ROC曲线的AUC分别为0.796、0.801和0.755。
讨 论
DCE-MRI是应用快速MRI序列连续采集注射对比剂之前、中和后的图像,显示对比剂进入靶组织或靶器官的血管内、然后经毛细血管床后被清除这一过程的信息,不仅可提供组织及病变形态学特征,还可反映组织及病变微循环等功能方面的改变[3]。利用合适的药代动力学模型,可以获得一系列量化参数,如Ktrans、Kep、Ve和Vp等,可对组织和肿瘤的微循环功能状态进行量化分析。目前,DCE-MRI已越来越多的应用于肿瘤特征及疗效的评估,如前列腺癌、乳腺癌、肺癌、头颈部肿瘤和脑胶质瘤等[7-11];也有用于胰腺良恶性肿块鉴别、胰腺癌特征评估及疗效预测的研究[12-15]。但是对于不同分期、不同分化程度、有无血管侵犯和淋巴转移等不同特征下胰腺癌DCE-MRI药代动力学参数之间有无差异的评估鲜见报道,本研究利用DCE-MRI药代动力学参数评估胰腺癌临床及病理状况,为无创精准诊断和治疗提供参考。
本研究发现胰头区胰腺癌的Vp值高于体尾部。Vp代表单位体积内血管所占的容积百分比。胰头部与体尾部血供来源不同[16],且研究发现胰头与体尾部的胰岛毛细血管表面积与体积比值也存在差异[17],另外本团队前期研究也发现健康志愿者胰头部的Vp值高于体尾部[18],以上诸多因素可能是导致胰头区胰腺癌Vp值高于体尾部的原因。本研究中还发现,最大径>3 cm、Ⅱ~Ⅲ期、低分化、伴血管侵犯以及伴淋巴转移的胰腺癌,其Ktrans和Kep值相对较高。Ktrans表示对比剂从血管内扩散到血管外细胞外间隙的速率,Kep表示对比剂从血管外细胞外间隙回流到血管内的速率,这两者均与毛细血管通透性有关,而Ktrans还受组织内血流灌注量及毛细血管表面积的影响。肿瘤的发生伴随着血管的生成,以满足氧、营养物质需求及代谢废物清除的要求[19],由于血管生成过快且不具备正常血管生成的条件,导致许多新生血管不成熟,不成熟血管的增加使得灌注及血管表面通透性增加。病灶越大、分期越低和分化越差的胰腺癌,这种失衡和不成熟血管的生成可能更明显,因此其灌注和血管表面通透性增加更明显,这样的病理基础也更容易引起血管侵犯和淋巴转移。因此可以解释病灶越大、分期越高、分化越差、伴血管侵犯和伴淋巴转移的胰腺癌,其Ktrans、Kep值更高。除此我们还发现,低分化胰腺癌的Ve值明显低于中~高分化胰腺癌。Ve代表血管外细胞外间隙所占的容积百分比,分化越差的肿瘤其细胞异型性越大、排列越密集,不成熟新生血管越多[20],相应其细胞外血管外间隙所占的容积百分比越小。同时我们也发现伴淋巴转移胰腺癌的Ve值高于不伴淋巴转移胰腺癌,推测可能由于伴淋巴转移胰腺癌间质空间越大,越利于肿瘤细胞游走,这需要进一步研究。我们还发现,低分化及伴有血管侵犯胰腺癌的Vp值分别高于中~高分化和不伴血管侵犯的胰腺癌,说明分化程度越差肿瘤新生血管越明显,同时也更容易发生血管侵犯。
本研究结果还显示,胰腺癌DCE-MRI药代动力学参数在区分胰腺癌不同病理状况时具有较高的效能。Ktrans和Kep鉴别Ⅰ期和Ⅱ~Ⅲ期胰腺癌,Ktrans、Kep、Ve和Vp鉴别低分化与中~高分化胰腺癌,Ktrans、Kep和Vp诊断胰腺癌有无血管侵犯,Ktrans、Kep和Ve诊断胰腺癌有无淋巴转移时,其ROC曲线的AUC均大于0.750,部分甚至达0.900以上。以上结果进一步说明DCE-MRI在早期、无创、整体性预估胰腺癌“恶性”特征—病理状况中有较大的潜能。
本研究存在一些不足之处:首先,样本量相对较少,由于胰腺癌发病隐匿、恶性极高,多数患者发现时已无法手术切除,所以收集有手术病理结果的胰腺癌相对较为不易,后续我们会持续该方面的研究,进一步在大样本中验证以上结果;其次, DCE-MRI由于受成像方式、参数、图像后处理等多种因素影响,其获取数据在各机构间可能存在一定的差异,这也是目前DCE-MRI研究面临的共有问题,因此急需开发满足日常工作的通用DCE-MRI标准化软件,或者进行多中心研究,使得获取的研究结果更加可靠和稳定。
总之,DCE-MRI可初步应用于预测胰腺癌的临床及病理状况,其药代动力学参数可用于鉴别不同分期、不同分化胰腺癌,同时有助于评估有无血管侵犯及淋巴转移。

