中华蜜蜂囊状幼虫病毒检测方法研究进展
(重庆师范大学生命科学学院,401331)
1 引言
蜜蜂在维持自然生态平衡和生态农业,供给人类高营养和保健功能蜂产品的过程中扮演重要角色[1]。中华蜜蜂(Apis cerana cerana)是我国独特的蜜蜂资源,具有极强的耐寒性和抗螨性,因此中蜂对于农业生产以及花卉植物的冬季繁殖具有不可替代的作用。但近十年来,由于各种原因,世界各地的蜜蜂大量流失,严重威胁各国的养蜂业、生态平衡和农村农业生产[2]。然而我国中华蜜蜂生存所受到的主要威胁则是中蜂囊状幼虫病,如何减少蜂群的流失已成为各国政府和科学家面临的重要课题[3]。
蜜蜂囊状幼虫病病毒(SBV)是一类正链单股昆虫RNA 病毒,被划入传性软腐病毒科(Iflavirus)、肠道病毒属(EV)。该病毒基因组除去Poly A尾约有8832个碱基,有一个较大编码框(ORF),其编码约有2860个氨基酸残基的Polyprotein[4]。在病毒自身编码的蛋白酶的作用下,Polyprotein的-NH2末端被剪切后加工产生成熟的结构蛋白,-COOH端剪切后加工产生为非结构蛋白。感染SBV的A.cerana.cerana所携带的病原称中蜂囊状幼虫病毒,SBV最早是在西方蜜蜂患病幼虫(Apis mellifera)中报道,但对东方蜜蜂(Apis cerana,Fabricius)(包括A.cerana cerana)的危害更为严重[5]。其主要感染蜜蜂的幼虫,使其不完全蛹化且蛹内充满病毒粒子[6]。当损害严重时,大量幼虫会因感染而死亡,同时成虫为维护蜂群的生存环境而清理病死的幼虫,在清理过程中被感染SBV的成虫虽无症状,但活动能力下降以致种群优势减弱,最终导致种群的灭绝[7]。据报道,SBV先后对泰国、韩国、日本和中国的A.cerana种群及养蜂产业形成无法挽回的损失[8-14],目前A.cerana cerana蜂群囊状幼虫病的发病率仍在50%~70%[15]。
本文主要介绍CSBV检测方面的研究成果,以期为我国中蜂囊状幼虫病的诊断、预防和检疫以及蜂产品病原菌污染的检测提供快速、准确、简便的检测思路。
2 临床诊断方法
临床诊断方法只适用于已感染SBV的幼虫并致幼虫发病的蜂群,其症状表现为蜂箱外侧发现明显的病死幼虫,同时可观察到巢脾内部死亡幼虫逐一被清洁蜂拖出巢房;患病蜂群的巢脾出现明显的“插花子脾”现象[16],同一巢脾且尚未封盖巢房内的幼虫皮下渗出液增多,从患病到死亡体表颜色由白色逐渐变为浅黄色,最后变为棕褐色;病死幼虫水分蒸发后,用镊子夹起会呈现小囊状或袋状外观[17]。然而,临床诊断法适用于幼虫发病的蜂群而成年蜜蜂感染病毒之后没有明显症状,故此法不适用于蜂群隐形感染的情形。
3 电子显微镜检测方法
电子显微镜检测法是较为常见的检测蜜蜂囊状幼虫病毒的手段。杨冠煌以及冯建勋等[18,19]对CSBV提纯后,制备高浓度、高纯度的CSBV,再借助电子显微镜对CSBV进行了观察,发现CSBV粒子直径大约26~30nm的球状病毒粒子。该法操作简单,但实验设备的要求高。
4 PCR检测方法
随着基因组生物学的快速发展,聚合酶链式反应技术(PCR)日益成熟。PCR是一类特定基因或克隆序列的体外酶促扩增技术。近几年来自世界各地的研究人员也对该技术进行了改进,目前已有10余种不同类型的PCR技术广泛应用于生物学的各个领域。
RT-PCR是将RNA的反转录(RT)和cDNA的PCR相结合的技术。该技术目前是鉴定CSBV最常用的方法,RT-PCR技术因其高灵敏度可检测出极低拷贝数的RNA样本。根据NCBI上已发布的CSBV序列,研究人员可设计相应的特异性引物,从疑似受感染蜂群中扩增出对应条带,若扩增出条带所测得序列与CSBV序列一致,则可确诊疑似蜂群感染CSBV。截至目前,已有多名研究人员利用该方法检测CSBV。李明等[20]利用GenBank上已发布的CSBV基因组设计引物,运用RT-PCR技术,检测出辽宁地区的蜜蜂存在CSBV病毒,并将辽宁地区的CSBV部分基因序列与广东的CSBV基因序列进行对比,发现辽宁的CSBV与广东的CSBV基因序列对应区段具有94%的同源性。沈克飞等[16]选取CSBV基因组序列中的RNA依赖的RNA聚合酶基因序列,开发了CSBV半套式RT-PCR检测方法,且特异性较高。周亮等[4]根据SBV全序列设计引物,利用RT-PCR技术检测出该病毒,并将部分基因序列片段与广东的SBV序列进行比对,两者同源性高达96.8%。沈克飞等[21]使用SB14F/SB15R引物运用RT-PCR技术检测了重庆、浙江和云南地区蜜蜂幼虫中SBV的感染率,表明SBV在不同地区对蜜蜂种群的危害程度不同,在重庆地区中华蜜蜂呈流行趋势,而浙江中华蜜蜂、云南西方蜜蜂呈低感染状态。曹兰等[15]使用SB14F/SB15R[22]引物扩增RdRp基因序列,利用该基因片段对SBV进行基因型分析,发现所扩增片段序列与CSBV序列同源性高于95%,与SBV同源性高于89%。该病毒主要分为欧洲型、远东型和南非型3个基因型,揭示SBV总体上按地域分型。Kerstin Wernike等[23]第一次利用TaqMan MGB探针qRT-PCR的方法对SBV进行了检测和定量。宋战昀等[24]针对SBV保守区设计出一对特异性引物和一条探针,开发了快速检测SBV的TaqMan探针荧光定量RT-PCR方法,可对低病毒含量的样品进行准确检测和蜜蜂制品中蜜蜂囊状幼虫病毒污染的检测。马鸣潇等[25]也采用TaqMan PCR检测了CSBV,同样表明TaqMan PCR具有较高的特异性、敏感性和稳定性。根据上述研究人员的工作,本文汇总了RT-PCR技术检测靶标、引物及反应条件(表1)。

表1 RT-PCR引物及条件
4.1 Nested-PCR技术
巢式PCR(Nest-PCR)是一种异化聚合酶链式反应,且在该病感染早期可快速检测SBV。Nested-PCR技术的两对特异性引物分别对靶片段进行扩增而获得目的产物,该检测技术极大降低了非特异性扩增的几率。许益鹏等[26]根据病毒保守区设计套式引物(表2),通过RT-PCR结合Nest-PCR的方法扩增病毒的特征核苷酸区域,将扩增产物序列与该病毒已公布的其他序列进行比对,表明该段序列和我国广东递交的SBV序列的对应区段有90%~95%的同源性;而在氨基酸水平上有97%~98%的同源性。序列分析也表明,不同的地理种群蜜蜂囊状幼虫病毒基因组序列都有所不同。在实际应用中,常用外嵌套引物(F1+R1)和内嵌套引物(F2+R2)做2个反应即足以判断。
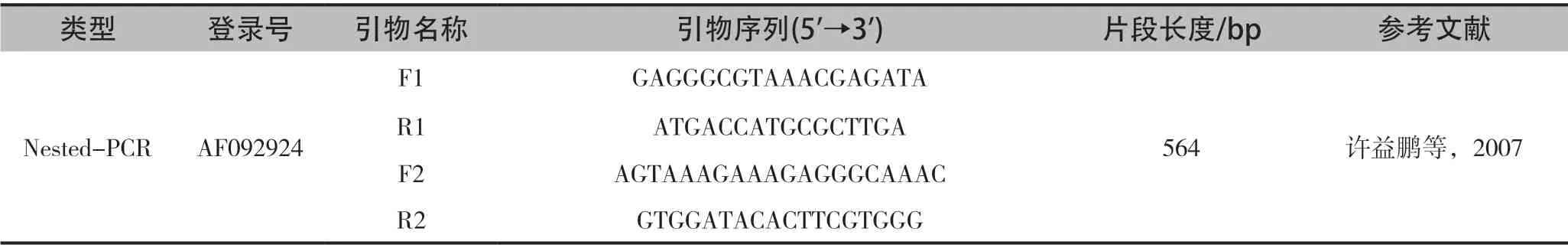
表2 巢式PCR引物及条件

表3 RT-PCR及梯度条带PCR引物
4.2 PCR技术
梯度PCR技术可同时进行多个不同退火温度的扩增反应,短时间内对PCR实验条件优化并确定特定体系相应的最优退火温度。刘新宇等[27]根据GenBank中已知的CSBV序列,针对CSBV分别设计了用于传统RT-PCR技术的4对特异性引物和用于梯度条带RTPCR技术的5对特异性引物(表3)。利用两种技术分别对陕西南部、陕西北部及关中的健康蜂群和CSBV感染蜂群进行染病鉴定,表明针对陕西三个地区检测,传统RT-PCR技术和梯度条带RT-PCR技术鉴定结果相同,且与已知序列CSBV的同源性在93%~96%之间。但与传统的RT-PCR鉴定方法相比,梯度条带PCR方法获得结果直观、鉴定费用少、检测效率高。梯度条带PCR技术在电泳检测阶段即可通过DNA片段的梯度次序确定是否存在病毒,从而加快了病毒在宿主体内的检测周期。
4.3 多重引物PCR
多重引物PCR又称复合PCR,在同一PCR反应体系中加上多种病原微生物的特异性引物进行PCR扩增,可同时检测多种病原体或鉴定出是特异型病原体感染。林丽花等[28]根据GenBank的CSBV全基因组序列设计特异性引物(表4),采用二重PCR对同时感染CSBV和N.ceranae的样本进行鉴定。结果表明,二重PCR扩增序列与已知两物种序列的同源性均在92%~96%,与单一PCR具有相近的灵敏度和精度。
4.4 环介导等温扩增技术
环介导等温扩增技术(LAMP),是一类适用基因诊断的恒温核酸扩增技术。主要是针对靶基因设计特异引物[29],在链置换DNA聚合酶(Bst DNA polymerase)的作用下,在60℃~65℃恒温扩增,较短时间即可实现109~1010倍的扩增倍数,该技术对仪器设备要求低,水浴锅或恒温箱就能实现反应,而且操作简单、特异性强、产物易检测。Smet等[30]基于MLPA技术建立了蜜蜂医生(BeeDoctor)多功能诊断工具,可同时检测10种蜜蜂病毒。杨金龙等[31]采用逆转录环介导等温扩增技术RT-LAMP检测东方蜜蜂囊状幼虫病毒,表明65℃水浴20min就能检测到SBV,并且由于扩增核酸浓度的增加可引起颜色变化,肉眼即可看到阳性扩增反应,实现快速检测。马鸣潇等[29]比较了LAMP和聚合酶PCR方法在31种病蜂样品中的检测效率,LAMP方法的检测限为1pg。王向辉[32]等根据SBV-UK株多聚蛋白基因序列,选保守区域设计4条特异性引物,通过LAMP real-time Turbidimeter仪对SBV的反应体系和条件进行检测和实时监控。表明,在63℃恒温扩增40min后,其特异性与常规PCR检测SBV一致;LAMP体系检测最低浓度为32拷贝/μl;提取的SBV核酸进行LAMP扩增,显示最大扩增速率的重复率均小于10%,表明LAMP检测方法具有良好的重复性和稳定性(表5)。
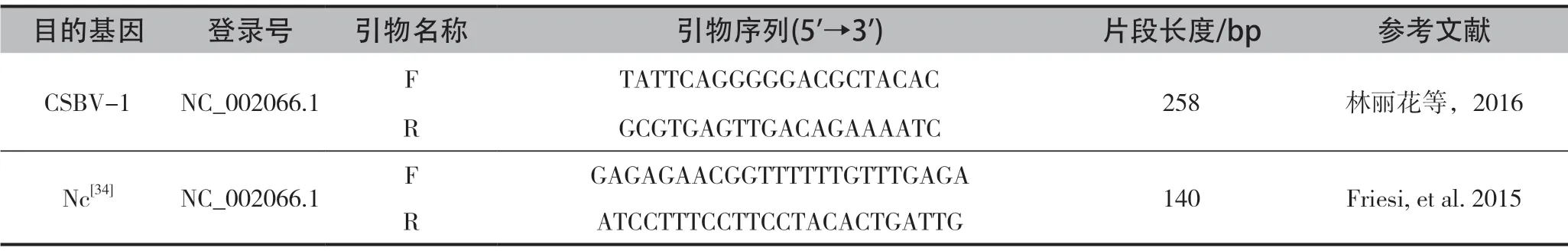
表4 多重引物PCR引物及条件
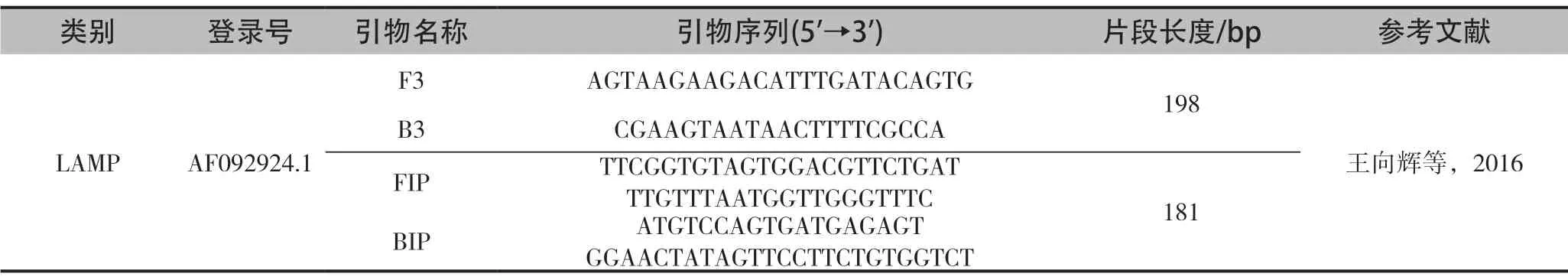
表5 LAMP-PCR引物
4.5 基因芯片技术
2006年10月26日,美国蜜蜂基因测序联盟(HGSC),在《Nature》杂志上公布了意大利蜜蜂基因组的测序结果[33],同时,由Robinson等研制的西方蜜蜂头部cDNA芯片和全基因组寡核苷酸芯片相继问世[34],从此标志着蜜蜂研究进入后基因组时代[35]。Glover等[36]利用寡核苷酸微列阵芯片技术同时检测了西方蜜蜂感染的9种病毒。寡核苷酸微阵列技术已被证明可检测一系列宿主中的多种病原体[37,38]。杨喻晓[39]等利用基因芯片在分子水平上研究中华蜜蜂的抗螨机理,对加快养蜂品种选育,寻找新基因、疾病诊断、药物筛选等均具有重要价值。
5 免疫学诊断方法
免疫学诊断是建立在抗原与相应抗体发生可见反应这一原理的基础上,基于病毒中的蛋白设计表位疫苗、制备相应抗体或是研制血清试剂盒而研发出免疫诊断方案[40]。免疫学方法具有较高的敏感性和特异性,在传染病诊断、病原微生物鉴定以及抗原分析等方面,均有较广泛的应用。目前用于蜜蜂传染病诊断的主要有琼脂免疫扩散法、胶体金免疫快速诊断技术和酶联免疫吸附法(ELISA)[41]。张鹤[42]利用抗CSBV单克隆抗体建立了琼脂扩散的检测方法。夏晓翠等[43]通过原核表达CSBV-RDRP蛋白,并免疫新西兰兔制备其多克隆抗血清,该抗血清能特异结合感染CSBV的A.cerana cerana血淋巴细胞,为进一步研究CSBV在A.cerana cerana其他组织中的分布和定位提供依据。李游等[44]以CSBV江西株为研究对象,制备了针对CSBV的单克隆抗体与多克隆抗体,并在此基础上结合胶体金免疫层析技术,采用单抗与多抗的双抗体夹心法初步研制了针对CSBV的胶体金快速检测试纸,表明所制试纸能检测出幼虫体内的SBV病毒。李芳兵[45]等建立了用CSBV的结构蛋白VP2作为包被抗原替代CSBV病毒对抗CSBV的VP2卵黄抗体进行检测的间接ELISA方法,该方法的建立为CSBV生物制剂的进一步研发以及检测提供了新的思路。李明等[46]以分离到的CSBV基因为基础,筛选出抗原性较好的融合蛋白代替CSBV作为免疫原,制备单克隆抗体,成功研制了双抗体夹心ELISA检测试剂盒,最小检出量为3.675×10t copies/ul,变异系数均小于5%,双抗夹心ELISA检测方法与RT-PCR方法的阳性符合率为88.9%,说明建立的双抗夹心ELISA检测方法具有很好的检测效果。通过免疫注射蛋鸡生产卵黄抗体及从卵黄中提取高纯度的卵黄抗体(IgY),可用于相应疾病的预防和治疗。马鸣潇等[47]则以中蜂囊状幼虫病毒为增殖模型制备了IgY,应用IgY对感染CSBV的蜂群进行治疗,治愈率高达96.25%以上,并且使用方便、特异性强、起效快、不复发、无药物残留。
6 展望
蜜蜂疾病是影响养蜂生产发展的障碍,也是影响蜂产品产量和质量的重要因素。而在蜜蜂的饲养管理工作中,对病原体的鉴定工作是各项防治工作的基础和依据。蜜蜂病毒病是所有攻击蜜蜂的病原菌病中的一种,中蜂囊状幼虫病是由囊状幼虫病毒引起的一种对中华蜜蜂毁灭性危害的病害。该病传播速度极快,危害极大,可造成30%~90%的蜂群损失,是中蜂养殖过程中的主要病害。目前对蜜蜂病害的防治相关研究还停留在临床诊断阶段,随着近几年该病害发病率有回升趋势,由于临床症状在初期不典型或者呈隐性感染,容易误诊,当出现明显症状时,已经造成严重的经济损失。因此,及时了解该病检测的最新方法,有助于及时发现病害减少损失。
针对蜜蜂囊状幼虫病毒的检测方法包括宏观水平的临床诊断技术与电镜检测方法,微观水平的分子生物学检测技术与免疫学检测方法。在宏观水平方面,临床诊断技术可以较为快速、简便、直观观察到感染SBV的幼虫,但该技术一般用于蜜蜂感染晚期的检测,对防治起不了太大作用;电镜检测方法则具有价格昂贵,对设备和操作人员的技术要求较高等缺点,目前主要用于科研方向。在微观水平方面,分子生物学检测技术如RT-PCR、LAMP和实时定量RT-PCR等凭借其特异性强、灵敏度高、操作简便等特点,成为目前进行蜜蜂病毒学研究的主要工具,但蜜蜂的囊状幼虫病毒属于小RNA样正链病毒,这类病毒易变性强,稳定性差,分子生物学检测技术在该类病毒检测方面也仅局限于定量分析。免疫学检测方法多数是用蜜蜂囊状幼虫病毒蛋白进行免疫获取相应的多克隆抗体或单克隆抗体,其具有可行性强、灵敏度高、高效快速等特点,如琼脂免疫扩散法、胶体金免疫快速诊断技术、CSBV双抗夹心ELISA方法建立等,但SBV/CSBV无法在体外大规模化培养,阳性血清比较难获得,使得免疫学检测方法难于被大范围推广。总之,上述方法虽各具优缺点,很难在基层生产上推广。但值得关注的是,在最新的研究中,研究人员已经研制出如胶体金试剂条、双抗体夹心ELISA检测试剂盒等,既快速、简便、高效又能够在基层广泛使用的检测方法,同时,未来的发展趋势可能集中于LAMPPCR技术,因为OmniAmp DNA聚合酶不但比LAMP中的Bst更稳定,更灵敏,不会被粗样品中的成分所抑制,而且价格比Bst更低,大大降低了检测成本。
因此,在蜂业生产过程中及时检测并正确区分疾病病原,对于有效阻断病原传播、保障蜂产品质量具有十分重要的意义。随着囊状幼虫病毒检测技术在诊断蜜蜂疾病上的发展,尤其是对蜜蜂病原核酸序列的破译,将会使病原的快速检测与诊断成为可能。

