感染白粉病烟株典型病级叶际真菌群落结构与多样性分析
黄宇,汪汉成,陈乾丽,陈兴江,向立刚,李忠,谢红炼
1.贵州大学农学院,贵阳市花溪区550025
2.贵州省烟草科学研究院,贵阳市观山湖区龙滩坝路29号550081
3.长江大学生命科学学院,湖北省荆州市荆秘路88号434025
4.长江大学农学院,湖北省荆州市荆秘路88号434025
由高氏白粉菌(Golovinomyces cichoracearum DC)引起的烟草白粉病(Tobacco powdery mildew)是烟草生产中常见的气传真菌性病害[1-3]。通常病原菌先侵染下部叶片,并逐步向上发展,发病初期呈近圆形的白色霉斑,随后病斑逐步扩展至整个叶片,严重时叶片正反两面均覆盖白色粉状霉层,导致叶组织变黄、枯死[2],最终失去烘烤价值,造成烟叶产量和品质损失高达80%[4-5]。在条件适宜的情况下,烟叶从零星出现病斑至全部覆盖粉状霉层,只需短短几天时间,该过程还会引起烟叶叶际真菌群落结构的变化[2]。因此,研究不同发病等级白粉病烟叶真菌群落结构对于指导烟草白粉病的防治具有重要意义。然而白粉病菌作为不可培养的真菌之一,传统分离培养法无法适用于白粉病等不可培养微生物的相关研究,而自然界中可培养微生物只占总体微生物的1%左右,因此传统微生物多样性的研究方法存在一定的局限性[6]。高通量测序技术无需对研究对象进行微生物分离培养,可直接从环境中提取微生物遗传物质,因此可以检测环境中所有可培养与不可培养的微生物,目前已被越来越多的研究者应用于包括肠道[7]、水体[8]、土壤[9]、植物根际[10]和叶际[11]等微生态环境的研究中。
随着人们对于叶际微生物关注度的增加,关于植物叶际微生物的研究也越来越多[12-15]。近年来,有关植物白粉病叶际微生物的研究已有一些报道,Zhang等[11]研究表明,健康黄杨叶际真菌和细菌多样性高于感染白粉病的黄杨;Suda等[16]分析感染黄瓜白粉病的叶际细菌群落组成发现,黄瓜叶片感染白粉病后其细菌数量、多样性和丰富度均增加;Zhang等[12]和罗路云等[15]对感染南瓜白粉病的叶际微生物群落组成的试验表明,南瓜白粉病严重程度越高,其微生物群落物种丰富度越低。对于烟草白粉病除本项目组前期对于感染白粉病叶片的真菌群落结构有研究报道外[17],鲜见其他相关报道。为此,采用Illumina MiSeq高通量测序技术对感染白粉病烟株的典型病级烟叶(3级病级烟叶与9级病级烟叶)叶际真菌种群结构和多样性进行分析,旨在为有效防治烟草白粉病提供依据。
1 材料与方法
1.1 样品采集
试验于2016年在贵州省福泉市烟草基地进行,在烟草白粉病发生严重的烟田(种植品种K326)采集样品,随机选取明显感染白粉病烟株,剪刀经消毒后分别剪取每株烟病情较轻的3级病级叶片和病情较为严重的9级病级叶片(参照国标GB/T 23222—2008[18]),见图1。3级病级烟叶(BFn)样品编号分别为BFn1、BFn2和BFn3,9级病级烟叶(BFl)样品编号分别为BFl1、BFl2和BFl3。将采集的样品存放入低温箱中,迅速带回实验室并置于超低温冰箱中保存,用于后续DNA提取。

图1 不同病级白粉病烟叶样品(a.9级;b.3级)Fig.1 Tobacco leaf samples infected by powdery mildew with different disease severities(a.Grade 9;b.Grade 3)
1.2 试剂与仪器
DNA提 取 试 剂 盒FastDNA®Spin kit for Soil(美国MP Biomedicals公司);超微量核酸定量光谱仪NanoDrop 2000(美国Thermo Fisher Scientific公司);GeneJET胶回收试剂盒(美国Thermofisher公司);PL303称量天平(感量0.001 g,瑞士Mettler Toledo公司)。
1.3 方法
1.3.1 样品DNA提取
参照总DNA提取试剂盒(FastDNA®Spin kit for Soil)说明书进行烟叶样品微生物基因组总DNA的提取。DNA提取完成后,参照刘畅等[19]的方法检测DNA的浓度和纯度。
1.3.2 扩增与测序
以提取样品的DNA为模板,采用引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)对 样 品 的ITS区进行PCR扩增。PCR扩增体系为50μL,包括正反向引物各2μL,DNA模板2μL,ddH2O 19 μL,SYBR ® Premix Ex Taq™Ⅱ25μL,PCR反应程序的设置及PCR产物纯化参照陈乾丽等[20]的方法进行。参照黄宇等[17]的方法将合格的纯化样品送至上海美吉生物医药科技有限公司进行高通量测序。
1.3.3 数据处理
原始数据经处理后,参照刘畅等[19,21]的方法对序列进行操作分类单元(OTU)聚类和物种注释分析,并对样品的Alpha多样性和物种组成进行评估。Alpha多样性分析可反映微生物群落的丰富度与多样性[10],采用软件mothur(version v.1.30.1)计算Alpha多样性指数。通常Sobs、Ace和Chao1指数反映样本真菌群落丰富度,指数值越大丰富度越高。Sobs指数为实际观测到的OTUs数;Ace指数用来估计样本群落中的OTUs数目;Chao1指数是利用Chao1算法估计样本中OTUs数目的指数[22-23]。反映样本真菌群落多样性指数有Shannon和Simpson指数,Shannon指数值越大,则群落多样性越高;而Simpson指数值越大,则群落多样性越低。反映样品覆盖度的指数为Coverage指数,其值越高测序结果的真实性越高[20]。在上海美吉生物医药科技有限公司I-Sanger生物信息云网站平台(http://www.i-sanger.com/project/index.html)上完成数据分析[17]。
2 结果与分析
2.1 数据质控分析
原始序列经优化处理后,3级病级烟叶(BFn)总序列数和总碱基数均高于9级病级烟叶(BFl),序列平均长度均为282 bp,见表1。

表1 测序样品数据质控Tab.1 Data quality control of sequencing samples
2.2 测序深度分析
稀释曲线(Rarefaction curve)用来检查测序结果是否合理,测序深度是否覆盖了试验样品中的所有测序对象[24]。图2中所有样本在测序深度为20 000时趋于平缓,说明测序深度已经足够,测序数据量可满足后续样品间真菌群落结构的比对分析需要。
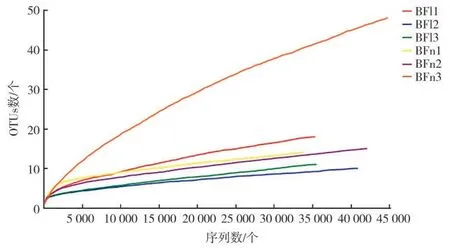
图2 稀释曲线(OTU水平)Fig.2 Rarefaction curve(OTU level)
2.3 OTU聚类分析
从表2看出,3级病级烟叶样品共鉴定到真菌门数量低于9级病级烟叶样品,其他各级分类数量均高于9级病级烟叶样品。Venn图(图3)分析结果表明,在属和OTU水平上3级病级烟叶真菌种类远高于9级病级烟叶。BFn和BFl两组样品间共有的真菌属主要为高氏白粉菌属(Golovinomyces)、镰刀菌属(Fusarium)、毛壳霉属(Chaetomium)、链格孢属(Alternaria)、曲霉属(Aspergillus)等14个;BFn独有的真菌属为平脐蠕孢属(Bipolaris)、漆斑菌属(Myrothecium)、拟盘多毛孢属(Pestalotiopsis)、赤霉属(Gibberella)、红酵母属(Rhodotorula)等31个;BFl独有的真菌属为木霉属(Trichoderma、Periconia)、炭疽菌属(Colletotrichum)、根霉属(Rhizopus)等6个。
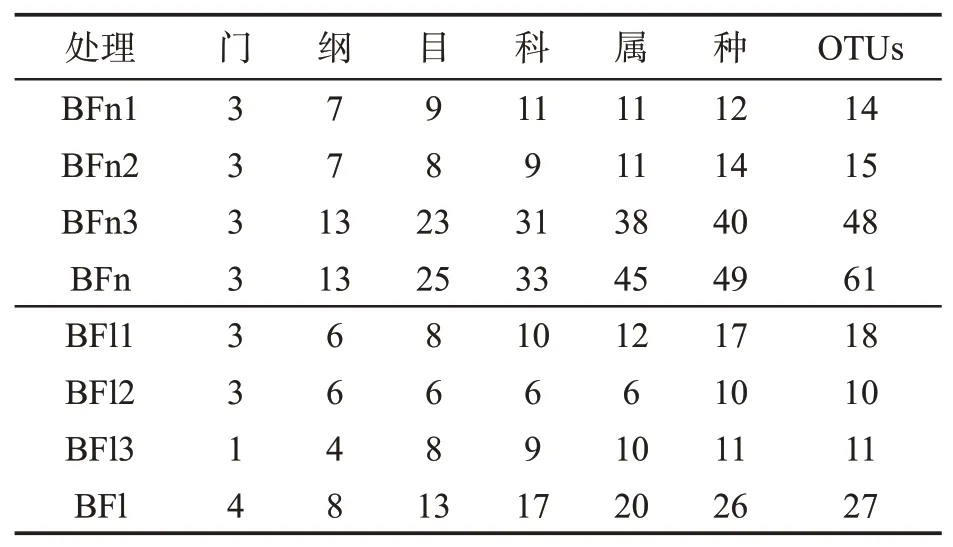
表2 不同病级白粉病烟叶真菌数量比较Tab.2 Total amounts of fungi in tobacco leaves infected by powdery mildew with different disease severities(个)
2.4 真菌多样性指数分析
如表3所示,所有样品的覆盖度指数(Coverage index)均在0.99以上,表明测序结果合理。3级病级烟叶样品中真菌群落的Shannon和Simpson指数与9级病级烟叶的基本一致,而Sobs、Ace和Chao1指数均高于9级病级烟叶,表明3级病级白粉病烟叶真菌群落多样性与9级病级烟叶相近,而真菌群落丰富度高于9级病级烟叶,但差异不显著(P>0.05)。
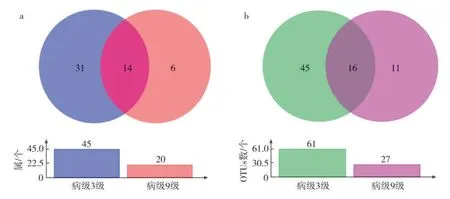
图3 不同病级白粉病烟叶真菌群落Venn图(a.属水平;b.OTU水平)Fig.3 Venn diagram of fungal communities in tobacco leaves infected by powdery mildew with different disease severities(a.genus level;b.OTU level)
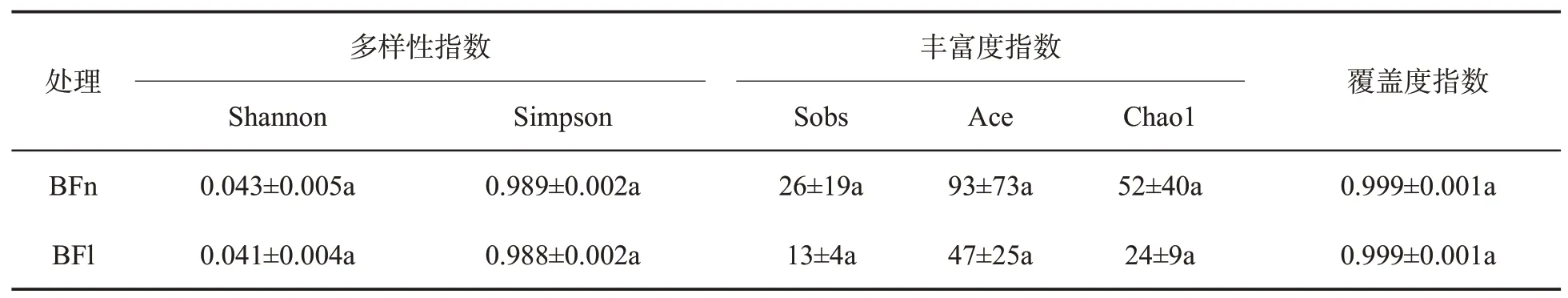
表3 不同病级白粉病烟叶真菌群落Alpha多样性指数①Tab.3 Alpha diversity indexes of fungal community in tobacco leaves infected by powdery mildew with different disease severities
2.5 真菌群落组成与结构分析
在门水平上,3级病级烟叶(BFn)的主要菌门为子囊菌门(Ascomycota,99.76%)和担子菌门(Basidiomycota,0.15%);9级病级烟叶(BFl)的主要菌门为子囊菌门(Ascomycota,99.99%)和担子菌门(Basidiomycota,<0.01%)。在属水平上,3级病级烟叶(BFn)的主要菌属为高氏白粉菌属、曲霉属和链格孢属,相对丰度分别为99.47%、0.16%和0.08%;9级病级烟叶(BFl)的主要菌属为高氏白粉菌属、曲霉属和链格孢属,相对丰度分别为99.43%、0.54%和0.01%,见图4。在3级病级烟叶和9级病级烟叶真菌群落的丰富度前15位的优势属中,红酵母属(Rhodotorula,0.13%)、锈生壳属(Eudarluca,<0.01%)和枝顶孢属(Acremonium,<0.01%)为3级病级烟叶中独有的属,青霉属(Penicillum,<0.01%)和未分类的小戴卫霉科真菌(Unclassified-f-Davidiellaceae,<0.01%)为9级病级烟叶中独有的属,见表4。

图4 不同病级白粉病烟叶在属水平上的相对丰度比较Fig.4 Relative abundances of tobacco leaves infected by powdery mildew with different disease severities at genus level
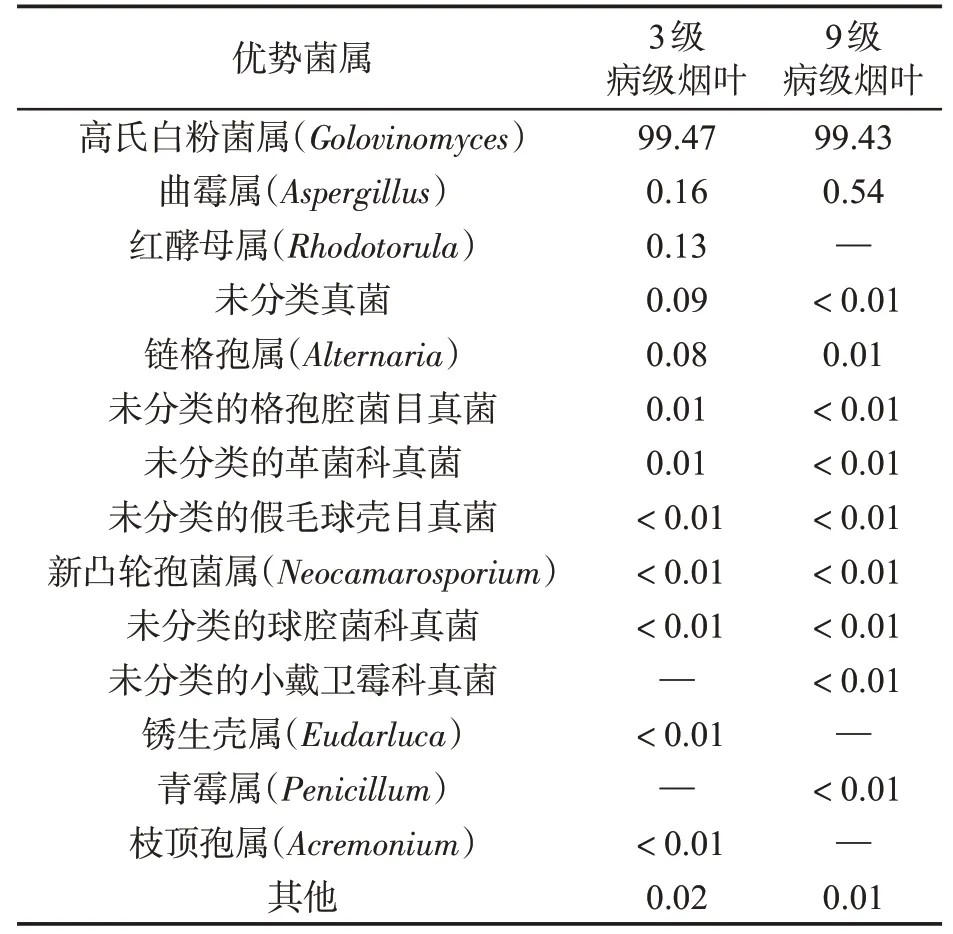
表4 不同病级烟叶叶际真菌菌属相对丰度比较Tab.4 Relative abundances of fungal genera in tobacco leaves with different disease severities (%)
3 讨论
植物叶片是微生物栖息的重要场所,叶际微生物在帮助寄主对抗病原体方面起着至关重要的作用[11]。本研究中3级病级白粉病烟叶样品真菌群落丰富度高于9级病级白粉病烟叶样品,与Zhang等[12]分析的不同病级南瓜白粉病真菌群落和Manching等[25]分析的不同严重度玉米叶斑病细菌群落结构的试验结果一致,3级病级烟叶和9级病级烟叶的真菌群落多样性无明显差异,且二者真菌群落多样性均较低,其原因可能是由于白粉菌是专性寄生菌[26],其吸取寄主营养物质能力较强,当白粉病菌侵染烟叶时,少有其他腐生真菌定殖,导致真菌群落多样性较低。
3级病级烟叶与9级病级烟叶中均存在链格孢属和曲霉属。前人在烟草内生真菌种群多样性的研究中也发现链格孢属和曲霉属为烟草的内生真菌[27],因此本试验测序结果中3级病级烟叶与9级病级烟叶样品中链格孢属和曲霉属的相对丰度较高。链格孢属在白粉病烟株9级病级烟叶和3级病级烟叶的相对丰度分别为0.01%和0.08%;曲霉属在9级病级烟叶和3级病级烟叶的相对丰度分别为0.54%和0.16%;在前期研究白粉病烟株健康烟叶(0级)中发现链格孢属和曲霉属的相对丰度分别为0.31%和0.34%[17]。随着烟草白粉病病害严重度的增加,链格孢属的相对丰度逐渐降低,推测白粉病在与链格孢属真菌共生时具有竞争优势,同时链格孢菌(Alternaria alternata)会引起烟草赤星病的发生[28],推测烟草白粉病的发生会抑制赤星病的发展。由于白粉菌的寄生性较强,在烟叶白粉病发展过程中可能抑制曲霉属真菌的生长繁殖,且曲霉属真菌具有腐生生活习性[29],当病害发生较严重时可能有利于曲霉属真菌的生长繁殖,所以随着病害严重度的增加,曲霉属的相对丰度呈先降低后增加的趋势,但仍有待进一步试验验证。在前期研究白粉病烟株7级发病烟叶时发现,曲霉属和红酵母属的相对丰度分别为0.33%和0.09%[17],随着烟草白粉病病害严重度的增加(3~9级),曲霉属的相对丰度逐渐增加,红酵母属的相对丰度逐渐降低。前人在烤后不同霉变程度烟叶叶际真菌群落组成研究中也发现烟叶霉变程度与曲霉属真菌含量呈正相关,与红酵母属真菌含量呈负相关[20],推测随着烟草白粉病严重度的增加其霉变程度也会提高。
本研究中利用Illumina高通量测序技术对白粉病烟株典型病级烟叶样品进行测序分析,结合前期对白粉病烟株的健康烟叶(病级0级)叶际真菌群落结构及多样性分析发现,不同病害严重度烟叶的微生物群落结构存在一定差异,但前期仅对白粉病烟株的0级病级、3级病级、7级和9级病级烟叶叶际真菌群落结构和多样性进行分析,未能体现叶际微生物群落结构随病情等级变化而变化的规律,因此有关不同病情等级(病级0级、3级、5级、7级、9级)白粉病烟叶样品的叶际真菌和细菌群落结构与多样性还有待进一步试验。
4 结论
感染白粉病烟株病情较轻的3级病级烟叶叶际真菌的主要菌属为高氏白粉菌属(Golovinomyces,99.47%)、曲 霉 属(Aspergillus,0.16%)、红酵母属(Rhodotorula,0.13%)、链格孢属(Alternaria,0.08%);感染白粉病烟株病情较严重的9级病级烟叶叶际真菌的主要菌属为高氏白粉菌属(Golovinomyces,99.43%)、曲霉属(Aspergillus,0.54%)、链格孢属(Alternaria,0.01%)。白粉病烟株的3级病级烟叶与9级病级烟叶的真菌群落结构组成基本相似;3级病级白粉病烟叶样品真菌群落丰富度高于9级病级白粉病烟叶样品,但无显著差异(P>0.05);3级病级白粉病烟叶真菌群落多样性与9级病级烟叶基本相似。

