饲养水平对阿勒泰羊胃肠道发育、瘤胃发酵参数及瘤胃微生物区系的影响
李宏,宋淑珍,高良霜,郎侠,刘立山,宫旭胤,魏玉兵,吴建平,3**
(1.甘肃省农业科学院畜草与绿色农业研究所,甘肃省牛羊种质与秸秆饲料化重点实验室,甘肃 兰州730070;2.甘肃农业大学动物科学技术学院,甘肃 兰州730070;3.西北师范大学新农村发展研究院,甘肃 兰州730070;4.平山湖蒙古族乡畜牧兽医站,甘肃张掖734000)
反刍动物与单胃动物相比有着特殊的消化器官瘤胃,瘤胃是反刍动物发酵、消化和代谢的重要场所,饲料中约有70%~85%可消化物质和50%粗纤维在瘤胃内消化,瘤胃对反刍动物营养物质消化和吸收起着至关重要的作用[1]。而瘤胃微生物是瘤胃发酵必不可缺少的物质[2],对反刍动物的营养生理起着至关重要的作用,微生物区系非常复杂,随饲料种类、营养水平、饲养环境、动物品种和年龄等的不同而发生变化[3-4],瘤胃微生物包括细菌、原虫和真菌,以厌氧性纤毛虫和细菌为主。瘤胃中的挥发性脂肪酸(volatile fatty acid,VFA)、菌体蛋白由瘤胃微生物厌氧发酵而产生,VFA为反刍动物提供70%~80%的能量,这将直接影响动物的生产性能[5-7]。纤维素酶等消化酶由瘤胃细菌所分泌[8],消化酶的活性受饲粮和肠道内环境因素所调控[9]。动物对饲粮营养物质的消化吸收主要依赖于瘤胃中瘤胃微生物和各种消化酶,所以瘤胃发酵和瘤胃微生物对饲粮的利用率及营养物质的消化吸收有着巨大的影响[10]。阿勒泰羊主要分布在新疆北部的阿勒泰地区福海县、富蕴县、清河县等地,因其尾臀合一硕大,又被称为大尾羊或阿勒泰大尾羊[11],为肉脂兼用型绵羊品种。该羊耐粗饲、抗逆性强,以其体型大、肉脂生产性能高而闻名[12-13]。阿勒泰羊在原产地终年放牧[14],由于生态环境保护,牧场资源限制,传统的放牧饲养已不适合现代畜牧业的发展要求,如何有效利用饲粮的营养水平改善瘤胃内环境,调控瘤胃微生物数量,进而调节动物的生产性能及降低养殖成本,促进反刍动物对营养物质的利用和吸收,是反刍动物营养研究的一个重要方向,且饲粮的营养水平对阿勒泰羊胃肠道发育、瘤胃发酵及瘤胃微生物区系的影响鲜有报道,为此本试验旨在探讨短期不同饲养水平对肥臀羊阿勒泰羊胃肠道发育、瘤胃内环境、消化酶活性及瘤胃微生物区系的影响,为通过营养水平调控阿勒泰羊生产提供思路。
1 材料与方法
1.1 试验设计
选取月龄相近(3~3.5月龄)、体重接近(19.16±0.54 kg)、臀型一致、健康状况良好的阿勒泰羔羊30只,随机分为3组,每组10只羊,单栏饲养,自由采食60 d,参照NRC(2007)饲养标准中维持能量(energy for maintenance,Em)需要,3个组分别按1.5(0.75 MJ·kg-1W0.75,1.5Em组)、1.0(0.50 MJ·kg-1W0.75,1.0Em组)和0.5倍Em(0.25 MJ·kg-1W0.75,0.5Em组)饲喂30 d。试验羊每隔10 d称重,调整饲喂量。试验结束后每组选取9只羊按畜类屠宰加工通用技术条件(GB/T 17237-2008)的要求屠宰,并按采样要求收集样品。
1.2 饲养与管理
试验始于2018年7月30日止于2018年11月6日,在甘肃省张掖市平山湖乡种羊场进行,预试期10 d,正试期90 d。试验前一周,打扫清理羊舍,并对羊舍、羊栏、食槽等进行消毒。试验开始前,试验羊逐个称重、打耳标和驱虫(驱虫后48 h内彻底打扫羊舍)。每组10只,单栏饲养,羊栏长3.0 m,宽2.0 m,配置饮水和采食一体的食槽,每天早上8:00、下午5:00分两次饲喂,自由饮水。试验羊舍为彩钢半开放式羊舍,温度、光照、通风等饲养环境条件一致。试验饲粮根据美国NRC(2007)肉用绵羊的需要标准配制,试验期绵羊饲粮的组成、基础饲粮组成及营养水平见表1。

表1 饲粮组成及营养水平Table 1 Composition and nutrient levels of experimental diets(Air-dry basis)
1.3 样品采集
试验结束后,禁食、自由饮水12 h后将试验羊屠宰,屠宰后迅速分离出瘤胃,采集瘤胃内容物及瘤胃液、瘤胃液经4层纱布过滤后,装于灭菌的冻存管-20℃内保存,用于测定瘤胃发酵参数及消化酶活性;瘤胃内容物置于灭菌的冻存管内-80℃冻存,用于瘤胃微生物区系的测定。同时,取出胃肠道测定重量及小肠长度。
1.4 测定指标及方法
1.4.1 胃肠道发育 试验羊屠宰后迅速将瘤胃、网胃、瓣胃和皱胃内容物清理干净,然后称总重,之后将瘤胃结扎分离出来进行称重。将小肠分离后清理内容物进行称重,之后将小肠展开用皮尺测量长度,最后计算瘤胃指数和小肠指数。

1.4.2 瘤胃液pH、氨态氮(NH3-N)、挥发性脂肪酸(VFA) 用便携式酸度计直接测定瘤胃液pH,参照冯宗慈等[16]的方法改进后测定瘤胃液NH3-N含量;利用日本岛津(GC-2010 plus)气相色谱仪测定VFA,采用内标法,内标为2-乙基丁酸(2EB),色谱柱:AT-FFAP(50 m×0.32 mm×0.25μm)毛细管柱。色谱柱程序升温:温度60℃保持1 min,以5℃·min-1升至115℃,不保留,再以15℃·min-1升至180℃,检测器温度260℃,进样口温度250℃。
1.4.3 消化酶活性 瘤胃液中淀粉酶、脂肪酶、胃蛋白酶活性的测定,采用南京建成生物工程研究所试剂盒[淀粉酶(C016-1-1)、脂肪酶(A054-2-1)、胃蛋白酶(A080-1-1)],测定步骤按照试剂盒说明书方法进行,用北京六一生物科技有限公司全自动酶标仪(WD-2102B)测定。
1.4.4 瘤胃微生物区系 瘤胃微生物总DNA利用天根粪便基因组DNA提取试剂盒(DP-328)提取。提取的DNA用1%的琼脂糖凝胶电泳检测完整性和纯度,用超微量分光光度计(Therm Nano Drop-2000)检测OD260/280。微生物特异性引物序列见表2,所有引物均由上海生物工程有限公司合成。利用ABI QuantStudio-5荧光定量基因扩增仪荧光定量PCR(RT-qPCR)比较阈值法测定微生物相对含量。PCR反应体系及反应参数参照天根SuperReal荧光定量预混试剂增强版(SYBR Green-FP205)说明书进行。反应体系20μL,2×SuperReal PreMix Plus 10μL,上下游引物各0.6μL,模板1μL,50×ROX Reference Dye 0.4μL,ddH2O 7.4μL。反应参数为95℃预变性15 min,95℃变性10 s,60℃退火32 s,共计40个循环。

表2 瘤胃微生物引物序列Table 2 The primer sequence of rumen microorganisms
1.5 数据统计分析
采用2-ΔΔct法[20]计算目的菌相对含量,以总细菌为内参基因。用Excel 2010整理数据,然后采用SPSS 21.0统计软件进行单因素方差分析(One-way ANOVA),用Duncan法进行多重比较,结果用平均值±标准差表示,显著性差异判断标准为P<0.05。
2 结果与分析
2.1 饲养水平对绵羊胃肠道发育的影响
随饲养水平的降低,全胃、瘤胃、小肠重逐渐降低,1.5Em组的全胃重、瘤胃重显著高于1.0Em和0.5Em组(P<0.05)。1.5Em组的全胃重分别比1.0Em、0.5Em组高37.74%、55.32%,瘤胃重分别比1.0Em、0.5Em组高39.02%、50.00%。3组间的小肠重量差异显著(P<0.05),1.5Em组分别比1.0Em和0.5Em组高10.91%、41.86%(表3)。1.5Em组瘤胃占宰前活重比例显著高于其他两组(P<0.05),分别高于1.0Em、0.5Em组44.17%、38.40%。0.5Em组的小肠占宰前活重比例及小肠长度显著低于其他两组(P<0.05)。
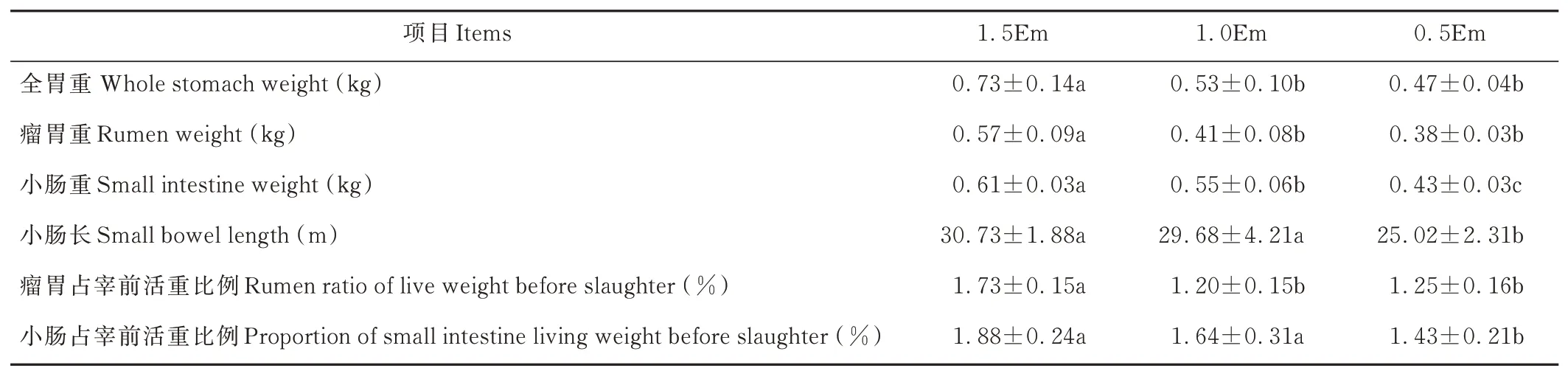
表3 饲养水平对绵羊胃肠道发育的影响Table 3 Effect of feeding level on the development of the gastrointestinal tract in sheep
2.2 饲养水平对绵羊瘤胃发酵参数的影响
随饲养水平的降低,绵羊瘤胃液pH先升高后降低,且1.5Em组显著低于1.0Em和0.5Em组(P<0.05),分别降低了8.48%、6.69%(表4)。NH3-N含量随饲养水平的降低逐渐降低,但3组间差异不显著(P>0.05)。1.0Em组的乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、总酸及乙酸/丙酸均最低,且1.0Em组的丙酸含量与其他2组相比差异显著(P<0.05),分别低于1.5Em、0.5Em组24.49%、24.70%。

表4 饲养水平对绵羊瘤胃发酵参数的影响Table 4 Effect of feeding level on rumen fermentation in sheep
2.3 饲养水平对绵羊瘤胃消化酶活性的影响
随饲养水平的降低,α-淀粉酶活性先降低后升高并且3组之间的差异显著(P<0.05),1.5Em组分别比1.0Em、0.5Em组高102.07%、53.35%(表5)。脂肪酶活性和胃蛋白酶活性均随饲养水平的降低而逐渐降低,且1.5Em组显著高于其他两组(P<0.05),1.5Em组脂肪酶分别比1.0Em、0.5Em组高76.45%、108.36%;胃蛋白酶分别比1.0Em、0.5Em组高63.20%、122.74%。
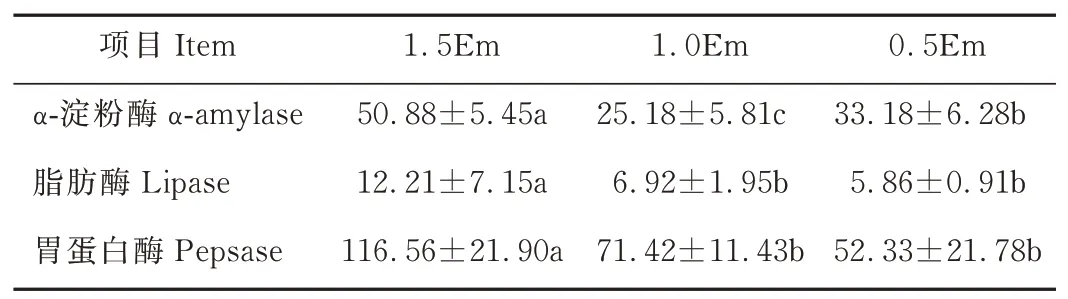
表5 饲养水平对绵羊瘤胃消化酶活性的影响Table 5 Effect of feeding level on the activity of the digestive enzymes in the rumen
2.4 饲养水平对绵羊瘤胃微生物区系的影响
饲养水平对阿勒泰羊瘤胃微生物区系具有显著影响(表6),瘤胃内容物中真菌、原虫的相对含量1.5Em组显著高于1.0Em和0.5Em组(P<0.05),1.0Em和0.5Em组之间差异不显著(P>0.05)。1.5Em组的真菌相对含量分别比1.0Em、0.5Em组高197.0%、228.9%,原虫相对含量分别比1.0Em、0.5Em组高392.5%、212.7%。1.5Em组的产琥珀酸丝状杆菌、白色瘤胃球菌的相对含量与1.0Em组相比差异显著(P<0.05),但与0.5Em组相比差异不显著(P>0.05),3组间的黄色瘤胃球菌相对含量差异均不显著(P>0.05)。

表6 饲养水平对阿勒泰羊瘤胃微生物区系的影响Table 6 Effect of feeding level on rumen microbial flora in Altay sheep
3 讨论
3.1 饲养水平对绵羊胃肠道发育的影响
反刍动物的胃肠道发育程度对动物的生产性能具有决定性作用[21],胃肠道的发育受遗传因素和环境因素的影响,相对而言环境作为后天调控胃肠道发育的主要因素,更易于调控。瘤胃和小肠是反刍动物消化系统中最重要的器官,饲粮进入瘤胃经过充分的发酵,微生物消化后,送入小肠进行吸收,发育良好的胃肠道对促进饲粮消化吸收、提高饲粮转化利用和充分发挥动物生产潜力具有重要的意义[22]。田丰等[23]报道,饲粮的营养水平显著影响巴美肉羊的胃肠道和内脏器官发育,高营养水平显著提高了巴美肉羊的瘤胃及小肠重。祁敏丽等[24]的研究表明,随饲粮营养水平的降低,湖羊羔羊的内脏器官、胃肠道发育质量及占宰前活重指数均显著降低,且显著抑制了瘤胃的发育。吕小康[25]以不同营养水平的饲粮饲喂海门山羊羔羊,结果发现随饲粮营养水平的升高,山羊羔羊瘤胃重及瘤胃占复胃及宰前活重的比例均随饲粮营养水平的升高而逐渐升高。本试验中随饲养水平的降低,阿勒泰羊胃肠道重及其占宰前活重的比例均降低,这与前人的研究结果一致,这说明饲养水平显著影响阿勒泰羔羊胃肠道发育。这可能是高饲养水平下动物所摄取的饲粮营养水平较高,进入消化道后促进了瘤胃及小肠肌肉的发育而使得其重量增大[26],也可能是在高饲养水平下饲粮的消化与代谢产生的刺激使消化道的重量增加并促进消化道肌肉的发育[27]。
3.2 饲养水平对绵羊瘤胃发酵参数的影响
瘤胃是反刍动物独有的消化器官,稳定的瘤胃内环境对反刍动物至关重要。pH、氨态氮(NH3-N)、挥发性脂肪酸(VFA)是评价瘤胃内环境的主要指标,也反映了瘤胃的健康水平与发酵状况[28]。pH是直观反映瘤胃发酵情况的重要参数指标,瘤胃正常发酵的pH范围为5.5~7.5[29]。本试验中瘤胃pH为6.69~7.31,均在正常范围内,其规律为随饲养水平的下降pH先升高后降低,说明饲养水平显著影响瘤胃发酵情况,这与白大洋[30]在西门塔尔牛上的研究结果一致。这可能是因为随饲粮营养水平的提高,瘤胃中乙酸、丙酸比例升高进而导致瘤胃pH下降。瘤胃中NH3-N主要来源于饲粮中的蛋白质、非蛋白氮、微生物蛋白以及尿素循环,其浓度高低主要反映瘤胃中微生物氮的供应状况[31]。过高和过低的NH3-N浓度,都不利于瘤胃微生物的生长,过高造成氮浪费,甚至引起动物氨中毒,过低会阻碍瘤胃微生物分解纤维素的效率[32],动物生产性能降低。Thao等[33]研究表明,促进微生物繁殖生长的NH3-N适宜浓度为5~30 mg·dL-1,本试验中瘤胃NH3-N含量为5.88~7.61 mg·dL-1,均在正常范围内,适于瘤胃微生物的生长。反刍动物70%~80%能量由瘤胃中的VFA提供[34],而乙酸、丙酸、丁酸是最主要的VFA,占VFA的95%左右,当瘤胃液pH≥7时,瘤胃上皮对VFA的吸收快慢依次为乙酸、丙酸、丁酸,反之则相反[1],这也可能是1.0Em、0.5Em组瘤胃液乙酸、丁酸含量显著低于1.5Em组的原因之一。而1.0Em组的VFA含量最低,可能是在1.0Em饲养水平下瘤胃上皮对其吸收效率最佳。王尧悦[35]报道,饲粮的营养水平显著影响VFA的含量。王桂超等[36]在对蒙古羔羊进行营养限制后瘤胃中的VFA、异丁酸、丁酸、戊酸含量也显著降低。夏传齐[37]的研究也表明,高营养水平饲粮显著提高荷斯坦奶公牛瘤胃液VFA、乙酸、丙酸、丁酸含量,本试验结果与上述报道相一致,这表明营养水平对反刍动物瘤胃发酵具有调控作用,显著影响瘤胃发酵。
3.3 饲养水平对绵羊瘤胃消化酶活性的影响
动物品种、年龄、饲粮营养水平、消化道部位、外源酶制剂以及神经和体液[38]是影响消化酶活性的重要因素,家畜对所摄入的营养物质的消化程度与消化酶活性直接相关[39],动物的生长发育和生产与摄入的营养水平密切相关,而动物胃肠道所产生的消化酶活性及其分泌量与动物对营养物质消化吸收程度呈正相关[40]。陈军强等[41]报道,对小尾寒羊进行营养限饲后,瘤胃中纤维素酶的活性越低,并且限饲程度愈高,纤维素酶的活性降低程度越大。景小平等[42]对冷季补饲藏羊进行研究表明,藏羊冷季补饲量越大,瘤胃及小肠的消化酶活性越强,从而提高了藏羊的生长性能。本试验中除动物所摄入的营养水平不同外,其他因素均相同,其结果表明,试验羊随采食量水平的降低,瘤胃酶活性逐渐降低,也进一步说明采食量水平与消化酶活性显著相关。
3.4 饲养水平对绵羊瘤胃微生物区系的影响
反刍动物出生后,随着与母畜及周围环境接触,逐渐建立瘤胃微生物区系并不断完善,瘤胃中微生物主要有细菌、真菌和原虫,瘤胃微生物结构和组成对于维持瘤胃内环境稳态、促进饲料消化吸收和动物的健康具有重要的作用[43],因此,调控瘤胃微生物区系在反刍动物营养研究中占有举足轻重的作用。瘤胃微生物区系的组成受诸多因素的影响,其中饲粮是最重要的因素。产琥珀酸丝状杆菌、白色瘤胃球菌、黄色瘤胃球菌是主要的纤维降解菌[44],针对瘤胃中主要的纤维降解菌,前人研究结果并不一致。王尧悦等[45]研究报道,随饲粮营养水平的提高,滩羊瘤胃中黄色瘤胃球菌的数量均显著升高。王斌星等[46]报道,随饲粮能量水平的提高,育肥牦牛黄色瘤胃球菌的数量有降低的趋势,但对产琥珀酸丝状杆菌和白色瘤胃球菌无显著影响。而另一方面,瘤胃原虫含量在营养调控方面具有极大的负面效应,原虫会阻碍纤维物质的利用率,也会大大降低瘤胃中整个微生物蛋白质的有效合成[47]。有研究结果表明,饲粮中添加大蒜油和植物提取物可显著降低瘤胃原虫含量[48-49],显著提高反刍动物对饲粮的利用率[50]。本试验结果发现,随营养水平的降低,真菌、原虫相对含量显著降低。黄色瘤胃球菌的相对含量3组之间无显著差异,但1.0Em组相对含量最高,且原虫含量最低,这表明1.0Em饲养水平可使动物对营养物质的利用效率达到最佳。本试验是以控制饲粮采食量水平为基础,而使动物所摄入的营养水平不同对瘤胃微生物区系进行调控,3组之间的瘤胃微生物相对含量各不同的原因可能是,在本试验条件下3组试验羊所摄入的营养水平不同,进而影响了瘤胃微生物区系。
4 结论
在本试验条件下,绵羊瘤胃发酵参数中的pH先升高后降低、NH3-N含量逐渐降低,在1.0Em饲养水平下瘤胃对VFA的吸收最佳,真菌、原虫的相对含量显著降低有效改善了瘤胃微生物区系。

