PEG胁迫下紫花苜蓿幼苗内源激素对NO的响应
张小芳,魏小红*,刘放,朱雪妹
(1.甘肃农业大学生命科学技术学院,甘肃 兰州730070;2.甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州730070;3.甘肃省干旱生境作物学重点实验室,甘肃 兰州730070)
紫花苜蓿(Medicago sativa)是世界范围内广泛种植的牧草,其营养价值高,富含各种维生素和矿物质,纤维素和粗蛋白含量较高,且其粗壮的根系能够改善土壤结构并增强土壤肥力,素有“牧草之王”的美称[1-3]。但长期以来,干旱一直是限制西北地区紫花苜蓿产业化发展的重要因素,因气候变化和降水量的减少,紫花苜蓿的生产受到制约,直接影响了畜牧养殖业的规模化发展。因此,深入研究紫花苜蓿抗旱的分子机制,提高苜蓿的产量和质量,对于推动西北地区畜牧业经济发展具有极其重要的意义[4]。
一氧化氮(nitric oxide,NO)是一种多功能的气态自由基,可以轻易地透过细胞膜,作为信号物质参与细胞的生理生化过程并调控植物的生长发育。通常植物体内NO合成主要来源于一氧化氮合酶(nitric oxide synthase,NOS)和硝酸还原酶(nitrate reductase,NR)途径[5]。研究表明,NO可通过调控碳水化合物代谢来缓解干旱胁迫对紫花苜蓿造成的损伤[6]。同时,NO介导的Ca2+信号可增强紫花苜蓿种子萌发和幼苗生长过程中的抗氧化酶活性来提高抗旱性[7]。NO能够与其他内源激素互作调控植物生长发育[8],如生长素(indole-3-acetic acid,IAA)、脱落酸(abscisic acid,ABA)、赤霉素(gibberellin,GA3)和水杨酸(salicylic acid,SA),都是植物体内主要的激素,在逆境胁迫中扮演着很重要的角色[9]。作为干旱胁迫反应的应激激素,ABA与茉莉酸(jasmonic acid,JA)和NO相互作用,以促进气孔闭合;同时,方华等[10]研究表明,ABA在提高月季(Rosa hybrida)的抗氧化酶活性过程中需要NO的参与。IAA和NO都可以促进植物根系的发育,且有研究发现NO作为信号分子在IAA的下游发挥重要作用[11]。单长卷等[12]研究发现,外施SA处理可以增加PEG胁迫下玉米(Zea mays)幼苗根系中NO的含量,但是清除根系中的NO会加剧干旱胁迫,表明干旱胁迫下在水杨酸的信号转导过程中,NO可能发挥着重要的作用。
尽管NO在紫花苜蓿抗旱性方面已经有一些研究,但是NO对PEG胁迫下紫花苜蓿中4种内源激素的研究还未见报道,因此,本试验以紫花苜蓿为材料,通过外源喷施一氧化氮释放剂硝普钠(sodium nitroprusside,SNP)和清除剂(carboxy-PTIO,cPTIO),采用液相色谱/质谱联用(liquid chromatography/mass spectrometry,LC/MS)的方法分析4种内源激素,研究PEG胁迫下紫花苜蓿叶片和根系中内源激素对NO的响应,进一步了解NO与激素互作调控紫花苜蓿抗旱性的作用机制,为紫花苜蓿在西北干旱地区的推广种植提供理论指导和技术支撑。
1 材料与方法
1.1 试验材料与处理
试验于2019年3-6月在甘肃农业大学生命科学技术学院植物生理实验室进行。供试紫花苜蓿品种为“三得利”(Medicago sativa“Sandili”),购买于甘肃省农业科学院种子公司。
选取籽粒饱满且无病虫害的紫花苜蓿种子,经0.1% HgCl2消毒5 min后,用去离子水冲洗5~6次,然后用蒸馏水浸泡24 h。选取露白一致的种子,均匀点播于装有高压灭菌营养土的花盆(直径11 cm,高10 cm)中,每盆50粒,再覆盖0.5 cm的土,轻轻压实,花盆表面喷洒少量蒸馏水,在(25±1)℃下,14 h光照/10 h黑暗,光照强度6000 lx进行培养,每隔2 d使用称重法补充水分,培养50 d后每盆挑选长势一致且发育状况良好的紫花苜蓿幼苗进行处理,具体试验设计为T1(CK,蒸馏水)、T2(10% PEG)、T3(0.1 mmol·L-1SNP+10% PEG)、和T4(200 μmol·L-1cPTIO+10% PEG)。分别量取5 mL蒸馏水、SNP溶液、cPTIO溶液(cPTIO处理液中加入附着剂tween20)喷施于叶面进行处理,每24 h喷施1次;土壤中干旱处理浇40 mL 10% PEG溶液进行处理,对照加等量蒸馏水,连续处理8 d。在胁迫后第2、4、6、8天时取紫花苜蓿幼苗叶片和根系测定内源NO和内源激素(ABA,IAA,SA,GA3)含量,重复3次。
1.2 测定指标与方法
1.2.1 内源NO含量测定 采用分光光度法(由苏州科铭生物公司提供的NO试剂盒)测定NO含量,标准曲线回归方程:Y=0.016X-0.0103,R2=0.9986。
1.2.2 内源激素含量测定 称取4种植物激素(ABA、IAA、GA3、SA)对照品(购自Sigma公司)各10 mg,通过色谱甲醇溶解于10 mL容量瓶,得到浓度为1 mg·mL-1的对照品溶液,然后逐级进行稀释,得到浓度为1.0、2.0、5.0、10.0、20.0、50.0、100.0和500.0 ng·mL-1的混合标准溶液。
参照钟冬莲等[13]的方法进行样品前处理,稍做修改。称取1 g的样品材料,加入液氮迅速研磨后,转移到50 mL的离心管,加入10 mL冷却的体积比为99∶1的甲醇-甲酸溶液,放置5 min后于4℃冰箱浸提24 h,离心10 min(10000 r·min-1)得上清液。吸取1 mL上清液,加入4 mL水,混匀振荡,过HC-C18小柱(事先分别用6 mL甲醇活化和5 mL 80%甲醇平衡小柱),上柱后,用10%甲醇溶液淋洗C18小柱,甲醇-甲酸溶液洗脱,收集洗脱液,用氮吹仪吹干后,用甲醇-甲酸溶液定容至1 mL,通过0.22μm滤膜进行过滤后,上机待测。
液相色谱-质谱联用仪(Agilent 1290-6460,美国安捷伦科技有限公司),分辨率可达0.4 amu(原子质量单位),扫描范围5~3000 m·z-1,可对复杂基质中痕量目标化合物进行分离、测定。流动相:A溶液为甲醇,B溶液为0.1%的甲酸水溶液,流速300μL·min-1,柱温35℃,进样量5μL。液相洗脱条件见表1。
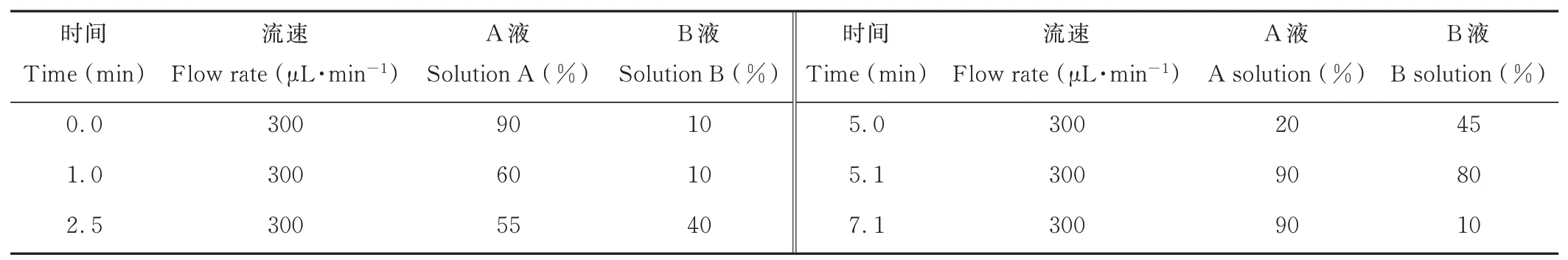
表1 植物激素的液相洗脱条件Table 1 Liquid phase elution conditions of plant hormones
质谱参数:在MRM模式下,用ESI负离子模式,毛细管电压为4 kV,干燥器流量为11 L·min-1,干燥器温度为350℃,物化压力为15 psi(pounds per square inch,磅·平方英寸-1),质谱参数见表2。

表2 不同内源激素在MRM模式下的MS参数Table 2 MS parameters of different endogenous hormones in MRM mode
1.2.3 4种激素的标准曲线 以质量浓度为纵坐标(C),峰面积为横坐标(X)制作标准曲线,得到4种内源激素含量的线性方程(表3)。
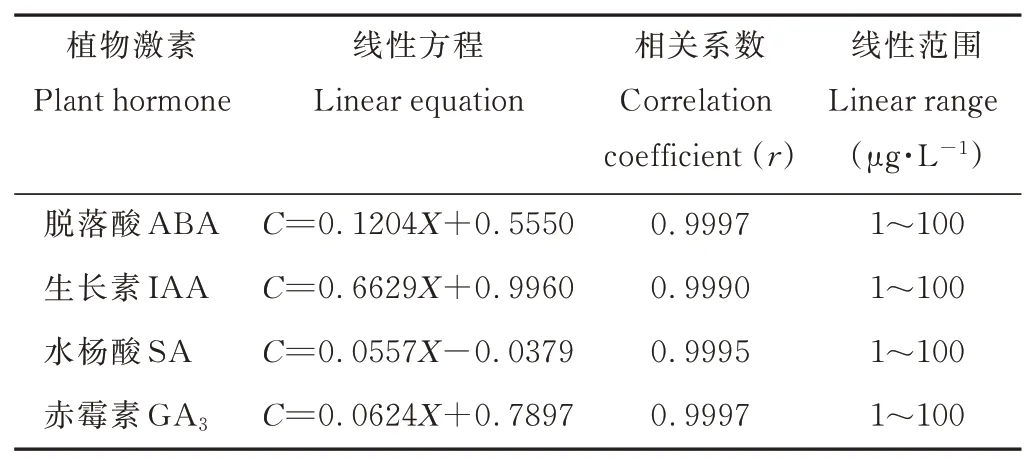
表3 植物激素的标准曲线Table 3 Standard curve for plant hormones
1.2.4 植物激素含量 参照邓文红等[14]的分析方法,按照下列公式计算:

式中:C为内标曲线上激素的浓度(ng·mL-1);V为样品的定容体积(mL);W为样品鲜质量(g)。
1.3 数据分析
采用Microsoft Excel 2016进行数据整理和作图,同时用SPSS 21.0软件比较差异显著性。
2 结果与分析
2.1 不同处理下紫花苜蓿幼苗叶片和根中NO含量的变化
随胁迫处理时间的延长,紫花苜蓿叶片中PEG处理的NO含量先升高后降低并在第6天达到最大值(图1);PEG+SNP处理的NO含量呈先升高后降低的变化趋势,并在第6天达到最大值(P<0.05),与PEG+cPTIO处理相比升高了2.87倍;PEG+cPTIO处理的NO含量在胁迫初期降低,胁迫后期差异不显著(P>0.05)。紫花苜蓿根中PEG处理的NO含量在整个胁迫时期呈先升高后降低的变化趋势,并在第6天达到最大值,与其他时间呈显著性差异(P<0.05);PEG+SNP处理的NO含量在整个时期逐渐增加;除第6天外,PEG+cPTIO处理的NO含量在整个时期也逐渐增加,在胁迫处理的第8天各处理间的NO含量无极显著差异。
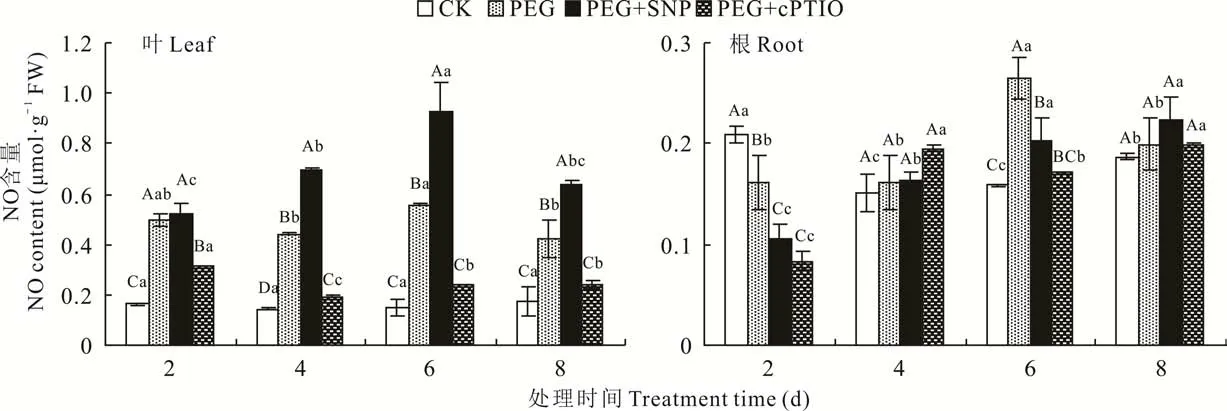
图1 不同处理下紫花苜蓿幼苗叶片和根系中NO含量的变化Fig.1 Changes of NO content in leaf and root of alfalfa seedlings under different treatments不同小写字母表示相同处理下不同处理天数间差异显著(P<0.05),不同大写字母表示相同处理天数下不同处理间差异极显著(P<0.01),下同。Different lowercase letters indicate significant differences among different treatment days under the same treatment(P<0.05),and different uppercase letters indicate extremely significant differences among different treatment in the same treatment days(P<0.01),the same below.
2.2 PEG胁迫下紫花苜蓿幼苗叶片和根中ABA含量对NO的响应
随胁迫处理时间的延长,苜蓿叶片中PEG处理的ABA含量逐渐升高(图2),在胁迫处理的第8天,达到最大值(P<0.05),与PEG处理相比,PEG+SNP处理的ABA含量升高了22.73%(P<0.01),PEG+cPTIO降低了61.76%;在整个胁迫时期,PEG+SNP和PEG+cPTIO处理的变化趋势一致,在胁迫的第8天达到最大值。紫花苜蓿根系中各处理的ABA含量显著低于叶片,在整个胁迫时期,PEG处理在第8天时达到最大值,与其他时间呈显著差异(P<0.05);PEG+SNP处理先降低后升高,在第2天达到最大值;PEG+cPTIO与PEG+SNP处理变化趋势相反,在第8天时PEG+cPTIO处理降低到最小值,与PEG+SNP处理无极显著差异。
2.3 PEG胁迫下紫花苜蓿幼苗叶片和根中IAA含量对NO的响应
紫花苜蓿叶片中各处理的IAA含量均呈先升高后降低再升高的变化趋势(图3),在胁迫处理的第8天,PEG处理的IAA含量达到最大值,与其他时间呈显著差异(P<0.05),与PEG+SNP和PEG+cPTIO处理相比,PEG处理的IAA含量升高了2.53和2.95倍(P<0.01);PEG+SNP处理的IAA含量在第4天达到最大值,与PEG+cPTIO处理的变化趋势一致,且PEG+cPTIO比PEG+SNP处理的IAA含量降低了62.32%;紫花苜蓿根中PEG处理的IAA含量在第4天达到整个时期的最大值,并且根中PEG处理的IAA含量高于叶片中;PEG+SNP处理的IAA含量先降低后升高,而PEG+cPTIO处理的IAA含量先升高后降低,在胁迫的第8天,与PEG+SNP处理相比,PEG+cPTIO处理IAA含量降低了91.67%(P<0.01)。
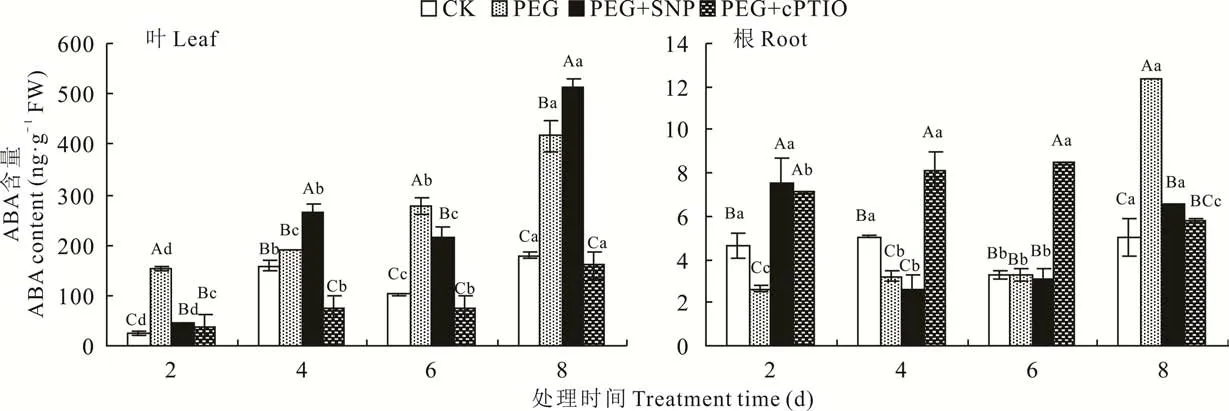
图2 PEG胁迫下紫花苜蓿幼苗叶片和根中ABA含量对NO的响应Fig.2 Response of ABA content in leaf and root of alfalfa seedlings to NO under PEG stress

图3 PEG胁迫下紫花苜蓿叶片和根中IAA含量对NO的响应Fig.3 Response of IAA content in leaf and root of alfalfa seedlings to NO under PEG stress
2.4 PEG胁迫下紫花苜蓿幼苗叶片和根中SA含量对NO的响应
随胁迫时间的延长,苜蓿叶片中PEG处理的SA含量在胁迫后期逐渐减少(图4);PEG+SNP和PEG+cPTIO处理逐渐增加,除第2天外,PEG+cPTIO处理在整个胁迫时期都高于其他处理,在胁迫的第8天达到最大值(P<0.05),且PEG+SNP处理比PEG+cPTIO降低25.96%。苜蓿根中PEG处理的SA含量逐渐增加,到第8天时开始降低;PEG+SNP和PEG+cPTIO处理的变化趋势不同,在胁迫处理的第8天,PEG+SNP处理增加,而PEG+cPTIO处理降低,与PEG+SNP处理相比,PEG+cPTIO降低了88.69%(P<0.01)。
2.5 PEG胁迫下紫花苜蓿幼苗叶片和根中GA3含量对NO的响应
随胁迫处理时间的延长,PEG处理的GA3含量先降低后升高(图5),在整个胁迫时期,除CK外,其他处理的苜蓿叶片均在第2天达到最大值,与PEG和PEG+cPTIO处理相比,PEG+SNP处理分别升高了50.33%和54.49%;在胁迫的第4天和第6天时,各处理间之间无极显著差异,PEG+cPTIO处理逐渐降低。苜蓿根中PEG处理的GA3含量在第6天与其他处理呈极显著差异(P<0.01);PEG+SNP处理的GA3含量在第2天达到最大值,胁迫后期下降后缓慢升高,但是差异不显著(P>0.05);而PEG+cPTIO处理与PEG+SNP处理的变化趋势相反,其GA3含量先升高后降低并在第4天达到最大值,与其他处理间呈极显著差异(P<0.01)。

图4 PEG胁迫下紫花苜蓿幼苗叶片和根中SA含量对NO的响应Fig.4 Response of SA content in leaf and root of alfalfa seedlings to NO under PEG stress

图5 PEG胁迫下紫花苜蓿幼苗叶片和根中GA3含量对NO的响应Fig.5 Response of GA3 content in leaf and root of alfalfa seedlings to NO under PEG stress
3 讨论
3.1 不同处理下紫花苜蓿幼苗叶片和根系中NO含量的变化
在植物生长过程中,干旱胁迫会对细胞质膜造成损伤,打破离子的动态平衡,从而影响植物体的生长和发育[15]。NO作为第二信使,在植物的生长发育和逆境胁迫中起到很重要的作用(图6),本研究发现,PEG胁迫下,苜蓿叶片中NO含量先升高后降低,并在第6天达到最大值;外源喷施SNP能够增加苜蓿叶片中NO含量,而喷施NO清除剂cPTIO能够抑制NO含量的增加,已有研究表明,外源施加NO处理会促进干旱条件下小麦(Triticum aestivum)根系和地上部的生长[16],同时,邵瑞鑫等[17]研究发现外源NO预处理后,玉米幼苗中的NO含量会增加,进而改善了玉米植株的生长。PEG胁迫下添加SNP处理时苜蓿根系的NO含量逐渐增加,可能是根系生物量和生理生化代谢等方面发生一系列变化,以适应干旱逆境,而NO可以通过调节植物根系离子吸收速率[18]和抗氧化酶活性等来增强植物对胁迫的响应。
3.2 PEG胁迫下NO对紫花苜蓿幼苗叶片和根系中ABA含量的影响
ABA是一种在植物逆境胁迫中变化最为明显的激素,是评价植物抗旱性的重要指标[19]。NO可以与ABA互作共同参与植物的防御反应。本试验研究发现,除对照外,PEG胁迫下苜蓿叶片中各处理ABA的含量整体呈上升的趋势,并在第8天达到最大值,此时PEG+SNP处理的ABA含量明显高于PEG+cPTIO处理,Ruan等[20]研究发现,盐胁迫下,外源加施NO会促进小麦幼苗叶片中内源脱落酸的合成,并且NO和ABA信号分子在此诱导过程中不存在累积效应,同时,叶片中ABA含量的增加也可以达到促进气孔关闭以增强植株抗旱能力的效 果[21]。与叶片相比,根 中PEG+SNP处理的ABA含量在胁迫期间先降低后升高,并在第2天达到最大值,Desikan等[22]推测,渗透胁迫下植物体内合成的NO可能会激活根细胞质膜相关的离子通道,促进K+快速积累,通过ABA调节植物根系细胞水势,可以改善渗透胁迫下植物的适应性生长;PEG+cPTIO处理的ABA含量逐渐增加,到第8天含量降低,可能是因为根系合成的ABA转运到植物叶片,促使叶片中PEG+cPTIO处理的ABA含量第8天达到最大值。
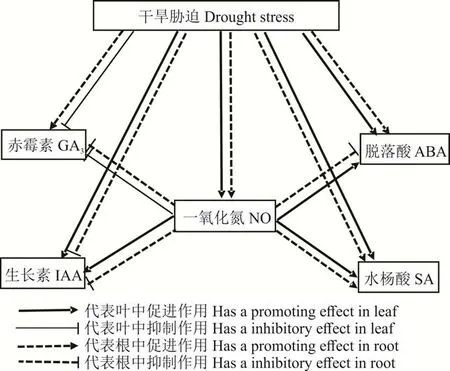
图6 PEG胁迫下NO诱导紫花苜蓿叶片和根系内源激素的调控网络Fig.6 NO-induced regulation network of endogenous hormones in leaf and root of alfalfa under PEG stress
3.3 PEG胁迫下NO对紫花苜蓿幼苗叶片和根中IAA含量的影响
植物根系发育过程中合成的IAA不是停留在固定部位,而是通过极性运输到特定部位才能发挥作用[23-24],其他植物激素多通过与IAA协同或拮抗的作用来共同调控根系发育[25]。沈宏伟等[26]研究发现外源SNP处理可以增加IAA含量从而促进种子萌发;在拟南芥(Arabidopsis thaliana)幼苗形态改变的信号转导过程中,NO与IAA在Cu2+胁迫下存在负调控关系[27],此外,也有研究表明,在拟南芥中NO作为信号分子在生长素的下游起作用[28],因此,NO与生长素在植物生长过程中的关系较为复杂。本试验结果表明,除第6天外,PEG胁迫下苜蓿叶片的IAA含量增加,并在第8天达到最大值,闫志佩[29]观察到干旱使小麦叶片的IAA氧化酶活力下降,进而IAA含量增加,本研究结论与其一致。苜蓿叶片中PEG+SNP和PEG+cPTIO处理的IAA含量快速上升,在第4天达到最大值,并且PEG+SNP处理的IAA含量显著高于PEG+cPTIO处理,PEG胁迫下苜蓿叶片中IAA含量增加时,PEG+SNP处理的IAA含量相应的也会增加,表明NO可能作用于IAA信号通路的下游。
苜蓿根中PEG+SNP处理的IAA含量在胁迫前期下降,一方面是因为NO在生长素诱导根系生长过程中作为下游信号分子发挥作用[30];另一方面是因为苜蓿根系中的IAA转运到叶片中,从而使叶片中PEG+SNP处理的IAA含量在第4天达到最大值。胁迫后期PEG+SNP处理的IAA含量上升,与PEG+cPTIO处理的变化趋势相反,Correa等[31]研究表明,在正常条件下,外源添加NO供体能促进番茄(Lycopersicon esculentum)侧根原基的形成和侧根的伸长,而外源添加NO清除剂cPTIO则能显著抑制侧根伸长,这与胁迫后期苜蓿根系添加SNP和cPTIO的研究结论一致,表明PEG胁迫下NO在植物根系中也可以起到相同的作用。
3.4 PEG胁迫下NO对紫花苜蓿幼苗叶片和根中SA含量的影响
SA是植物体内普遍存在的一种生长调节物质,在逆境胁迫响应等方面具有重要作用[32-36],研究发现,植物体内的SA可通过增强植物抗氧化系统活性来增强植物的抗旱性[37]。施加外源SA可拮抗干旱对小麦根鲜重及根中可溶性糖的影响,来增强小麦的抗旱性[38-39]。本试验研究表明,PEG胁迫下苜蓿叶片中外源SNP处理的SA含量逐渐增加,并在第8天达到最大值,研究发现,外源添加NO会使烟草(Nicotiana tabacum)叶片中的内源SA含量增加[40],并且SA诱导拟南芥中NO合成的过程中,在一定范围和时间内NO合成量随SA浓度升高而增加[41],表明SA与NO的信号应答途径并非孤立,二者在抗旱反应中存在交互作用[42],本研究结论与其一致。PEG+cPTIO处理的SA含量在胁迫期间逐渐增加并高于其他处理,一方面是因为PEG胁迫下清除植物体内NO含量会促使苜蓿受到双重胁迫,而SA含量的增加可以缓解干旱胁迫的损伤,这是一种应激反应的体现;另一方面,刘新等[43]推测NO的减少在短时间内刺激了NOS产生更多NO,促进气孔关闭,增强了叶片的抗旱能力。与叶片相比,苜蓿根系中PEG+SNP处理的SA含量先降低后升高,在第8天达到整个胁迫时期的最大值;而PEG+cPTIO处理SA含量总体呈下降趋势,在第8天达到最小值,可能的原因是根中SA转运到叶片使得叶片中PEG+cPTIO处理的SA含量达到最大值。
3.5 PEG胁迫下NO对紫花苜蓿幼苗叶片和根中GA3含量的影响
GA3是一种双萜类化合物激素,能促进细胞分裂和伸长。已有研究表明干旱胁迫会影响水稻(Oryza sativa)根中与赤霉素代谢相关基因的表达[44]。本研究结果显示,PEG胁迫下苜蓿叶片GA3含量先下降后缓慢上升,这可能与GA3在植物逆境胁迫下扮演着减缓生长的负调控信号有关[45]。叶片和根系中PEG+SNP处理的GA3含量(除第8天外)在整个胁迫时期先下降后缓慢上升,表明叶片和根系中外源添加SNP对GA3含量的增加有抑制作用,Beligni等[46]研究表明,NO可作为一种抗氧化剂减缓大麦(Hordeum vulgare)糊粉层的细胞程序性死亡(programmed cell death,PCD),本研究结论与其一致。苜蓿根系中PEG+cPTIO处理的GA3在第4天达到最大值,可能的原因是根尖合成的GA3在外源添加cPTIO后,阻止GA3向叶片中运输,从而积累到根系中,所以第4天根系中GA3含量达到最大值,叶片中GA3含量降低。并且根系中GA3含量的最大值大于叶片中,表明根系中合成的GA3较多。
4 结论
PEG胁迫下加施外源NO能促进紫花苜蓿叶片和根系中NO含量的增加,其清除剂明显降低了紫花苜蓿叶片中的NO含量;随着胁迫处理时间的延长,叶片和根中的ABA和SA含量逐渐增加,但根系中ABA和SA含量的增加晚于叶片;NO会在短期内诱导叶片和根系中IAA和GA3含量增加。综上所述,NO可通过诱导紫花苜蓿IAA、ABA、GA3和SA 4种激素的代谢水平及根中的相互转化调控植物的生长与抗逆,尤其是ABA和SA的调节最为明显。

