重组抗菌肽HIP/PAP的表达、纯化及抗菌功能鉴定
杨怀玺,陈 林,苏妍卓,王雪峰,丁大勇
(吉林大学中日联谊医院 胃肠结直肠外科,吉林 长春130033)
随着肠道免疫功能研究的深入,肠道黏膜分泌的一系列具有抗菌作用的短肽受到了高度重视。这些短肽在胃肠道中对一定种类的有害病原体具有抑制或杀灭作用,对肠道正常菌群干扰较小,参与人体肠道黏膜屏障的功能。在既往研究中,本课题组利用生物工程技术重组表达、纯化了小鼠抗菌肽Reg3γ,掌握了该蛋白在大肠杆菌中表达的合适条件。HIP/PAP是其同源的由人肠道潘氏细胞分泌的抗菌肽,本文利于该技术进一步表达和纯化了HIP/PAP,并对其抗菌作用进行了鉴定。
1 材料与方法
1.1 材料
载体质粒pET-30b(+)购自Novagen公司;限制性内切酶、DNA聚合酶购自TaKaRa公司;真核表达菌株E.coli B21购自Agilent公司;感受态细胞DH5α,购自TaKaRa公司;粪肠球菌(E.faecalis)和大肠杆菌(E.coli)由本实验室保存的菌种;透析袋购自Spectrum Laboratories公司;阳离子交换柱及凝胶柱购自GE Healthcare公司。
1.2 方法
1.2.1真核表达载体的构建 HIP/PAPmRNA引物设计序列:上游引物:5’- ATTGCGAGGCATATGGAAGAACCACAAAGAGAACTGC-3’;下游引物:5’-CTATGGTGATCACTAGTCAGTGAACTTGCAGACATAGGGTAA-3’,引物上下游分别包含NdeI酶切位点和BclI酶切位点。PCR反应条件为:94℃2 min;94℃20 s、60℃30 s、72℃30 s行30个循环,72℃5 min。
将HIP/PAP PCR产物和原核表达载体为pET-30b(+)质粒行NdeI和BclI双酶切。酶切后的目的片段和载体通过DNA连接酶将连接成pET-30b(+)-HIP/PAP。常规扩增抽提重组质粒pET-30b(+)-HIP/PAP。对扩增的质粒行双酶切鉴定及测序。将重组的pET-30b(+)-HIP/PAP转化真核表达载体E.coli B21-CodonPlus(DE3)在含有卡那霉素(30 μg/mL)和氯霉素(50 μg/mL)的LB培养基培养,低温保存真核表达载体。
1.2.2重组蛋白的表达及纯化 根据既往研究Reg3γ的实验条件表达重组蛋白。将真核表达载体E.coli B21-CodonPlus(DE3)挑菌到20 mL含卡那霉素和氯霉素的LB液体培养基,小规模制备。明确实验条件后,将培养过夜的工程菌液加入500 mL LB液体培养基内,37℃摇床培养4 h,使用0.5 mM/L IPTG诱导表达5 h。低温6 500 g离心15 min,留取沉淀。以超声细胞破碎器将细菌破碎后使用清洗缓冲液重悬沉淀。将重悬液低温10 000 g离心10 min,留取沉淀。再次重悬清洗沉淀部分。将重悬液缓慢滴入复性缓冲液中,4℃缓慢搅拌24 h。
室温下10 000 g离心复性液30 min,弃沉淀,将上清液装入透析袋。透析缓冲液置于4℃透析24 h。同样条件透析两次。使用阳离子交换柱及凝胶柱进一步纯化重组HIP/PAP蛋白。
1.2.3SDS-PAGE及考马斯亮蓝染色 将重组HIP/PAP蛋白样品20 μL沸水中煮5 min,轻度离心后上样。以5%浓缩胶和15%分离胶行SDS-PAGE电泳。电泳后的凝胶置入考马斯亮蓝染色液中震荡染色30 min。加入脱色液,振荡过夜。
1.2.4重组蛋白的体外酶切及体外抗菌实验 用胰蛋白酶消化4 μg表达纯化的HIP/PAP重组蛋白 (胰蛋白酶:重组蛋白比例为1∶200,37℃水浴,反应1 h)。酶切产物及对照行SDS-PAGE及考马斯亮蓝染色。
使用平板计数法(CFU)检测重组HIP/PAP抗菌活性。对数生长期细菌低温 5 000 g离心留取沉淀。沉淀细菌重悬后,进行梯度稀释。计算各浓度的菌落数。梯度浓度的重组蛋白和细菌数100 到 300 CFU/mL之间浓度的菌液混合培养2 h,涂BHI平板培养过夜。CFU计数,以HIP/PAP蛋白/对照组CFU为统计变量,重复5次,制散点图。
1.2.5统计方法 数据均用SPSS23.0软件分析。采用t检验。P<0.05被认为有统计学意义。
2 结果
通过PCR进行扩增的目的基因HIP/PAP经双重酶切后纯化,行电泳显示扩增出的条带大小与理论值(474 bp)相符(图1)。扩增的HIP/PAP DNA与质粒通过DNA连接酶连接成为重组质粒pET-30b(+)-HIP/PAP,其双酶切鉴定结果如图2。重组蛋白HIP/PAP在工程菌E.coli B21-CodonPlus(DE3)大量表达,其包涵体在复性液的作用后产物经透析滤除中小分子杂质。以SP Sepharose Fast Flow 阳离子交换柱纯化后仍含有大分子杂质,行SephacrylTMS-200 HR凝胶柱进一步纯化重组HIP/PAP蛋白(图3,图4)。纯化的重组HIP/PAP蛋白行胰蛋白酶切。重组HIP/PAP蛋白质被Trypsin水解为略小的约15 kD的蛋白质(图5)。
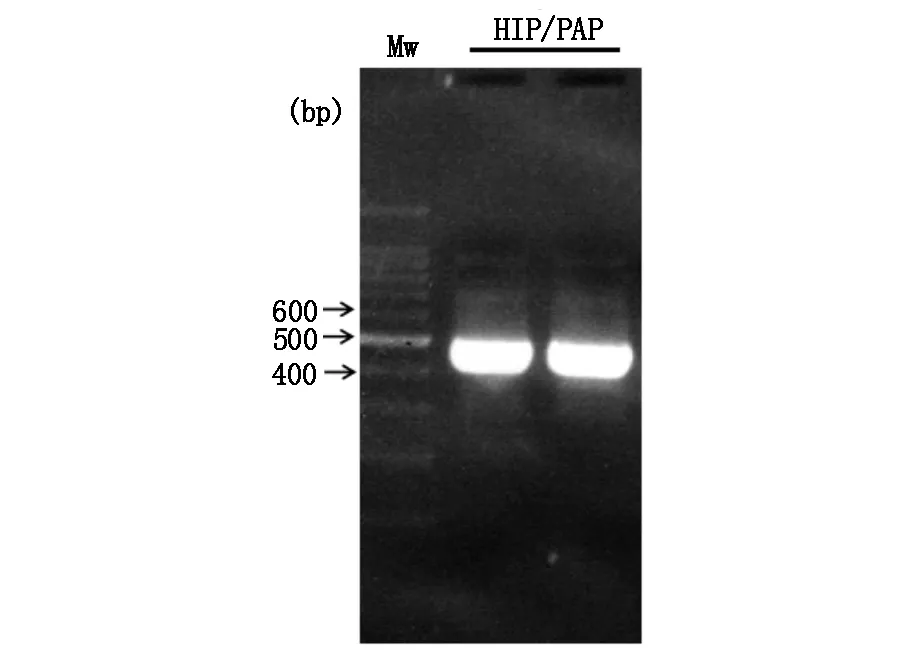
图1 HIP/PAP基因PCR产物琼脂糖凝胶电泳MW为DNA marker。
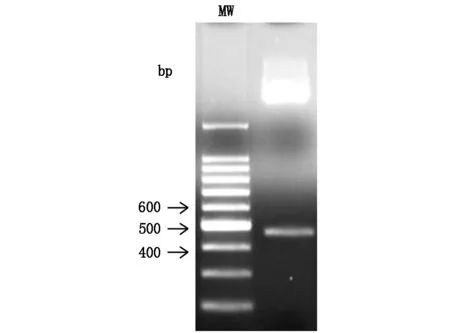
图2 pET-30b(+)-HIP/PAP酶切结果MW为DNA marker。

1.未加IPTG诱导菌液;2.IPTG诱导后菌液;3.超声碎裂后离心上清;4.包涵体研磨清洗后离心上清;5.复性蛋白质经离子交换层析柱纯化后。M为蛋白质marker。
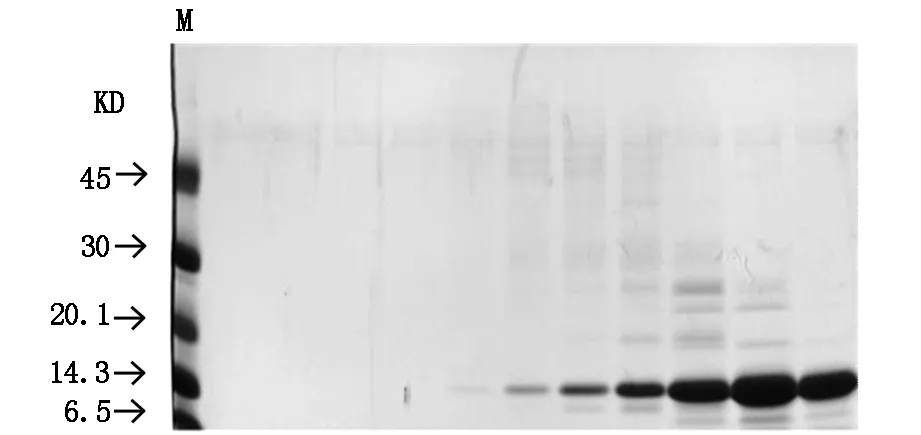
M为蛋白质marker
不同浓度HIP/PAP及酶切的HIP/PAP蛋白对粪肠球菌的CFU进行测定,发现HIP/PAP蛋白对粪肠球菌具有明显的体外抑制作用,该作用随着HIP/PAP浓度的升高而强化,而且HIP/PAP在被酶切后抗菌作用增强(图6)。同样方法研究HIP/PAP对大肠杆菌的抗菌作用,发现HIP/PAP及酶切产物对大肠杆菌无体外抗菌作用(图7)。

1.HIP/PAP;2.HIP/PAP+trypsin
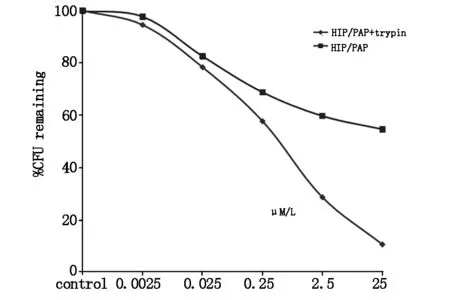
图6 重组蛋白HIP/PAP和酶切的重组蛋白HIP/PAP+trypsin对粪肠球菌的抗菌作用
3 讨论
研究表明HIP/PAP是小肠paneth细胞分泌的C-型凝集素抗菌肽,具有调节肠道内细菌和宿主之间的内环境稳定的作用[1]。本课题组曾利用生物工程技术重组表达并纯化了小鼠Reg3γ[2]。在此基础上,本研究重组表达并纯化了抗菌肽HIP/PAP,并且通过CFU法证明了重组HIP/PAP对粪肠球菌有体外抗菌活性。而且,本研究发现HIP/PAP被胰蛋白酶酶切后体外抗菌活性明显增强。HIP/PAP对粪肠球菌的体外抗菌活性与细菌培养时间相关。然而,研究结果也发现HIP/PAP对大肠杆菌无体外抗菌活性。大肠杆菌和粪肠球菌为肠道内常见的革兰氏阴性杆菌和革兰氏阳性球菌。革兰氏阴性细菌的肽聚糖位于细胞壁内层,其外侧有脂多糖成分。HIP/PAP对革兰氏阴性的大肠杆菌无抗菌作用,分析HIP/PAP杀菌功能可能是通过与细菌细胞壁肽聚糖结合来实现的。HIP/PAP蛋白N端有1个11肽的段,可以被胰蛋白酶水解切除[3]。为了解HIP/PAP及酶切蛋白的体外抗菌活性,本研究进行了抗菌实验,发现重组HIP/PAP被胰蛋白酶酶切后体外的抗菌活性明显增强。
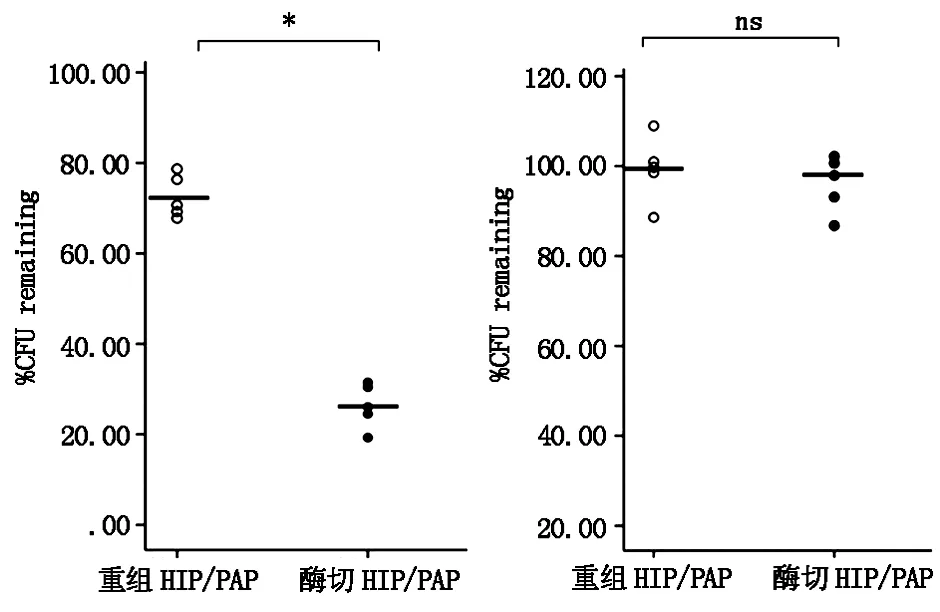
(a)对粪肠球菌CFU的影响 (b)对大肠杆菌CFU的影响

