环孢素A用于银屑病治疗的血药浓度监测追溯分析Δ
江 丽,龚春燕,李新宇
(1.中国医学科学院&北京协和医学院皮肤病医院药剂科,江苏 南京210042; 2.中国医学科学院&北京协和医学院皮肤病研究所药物研究室,江苏 南京 210042)
银屑病是皮肤科的常见疾病,是一种由环境和遗传共同引发的慢性免疫性疾病,临床表现为局部或全身的鳞屑性红斑或斑块,其病程长、反复发作,常罹患终身,使患者的身心健康受到严重的影响,还背负了沉重的经济负担。《中国银屑病诊疗指南(2018完整版)》[1]推荐环孢素A(cyclosporine A,CsA)用于治疗银屑病。环孢素对各类型银屑病均有效,尤其是对中重度银屑病的治疗[2-3]。由于CsA不良反应多、治疗窗窄且体内代谢差异大,故用药的同时需要进行血药浓度监测。本研究追溯分析中国医学科学院皮肤病医院161例银屑病住院患者的CsA血药浓度监测数据,探寻患者一般情况、联合用药等与CsA血药浓度之间的关系,为临床用药和预测不良反应的发生提供参考。
1 资料与方法
1.1 资料来源和方法
选取 2018—2020年中国医学科学院皮肤病医院使用CsA治疗并进行血药浓度监测的住院银屑病患者161例。采用追溯性方法统计患者CsA血药浓度监测结果,观察CsA血药浓度与年龄、性别、日剂量及联合用药之间的关系。
1.2 血药浓度测定方法
CsA血样均取自患者规律口服CsA 7~8 d后下次服药前,即为谷浓度。采取超高效液相色谱法测定全血中 CsA的谷浓度[4]。
1.3 统计学方法

2 结果
2.1 患者CsA血药浓度监测结果
161例患者接受CsA血药浓度监测288例次,平均1.79次/例;平均CsA血药浓度为(123.23±49.72) ng/ml,见表1。
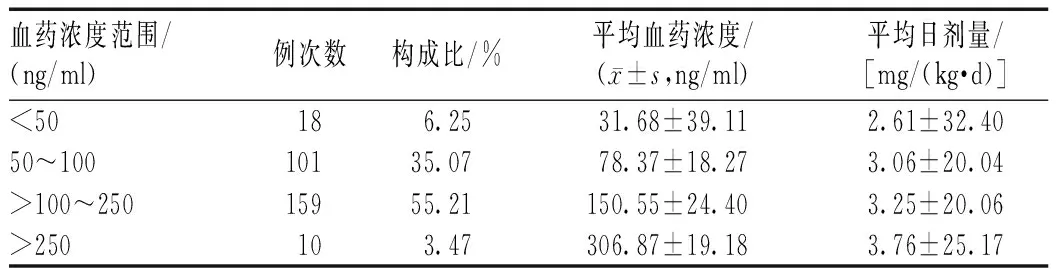
表1 患者CsA血药浓度监测结果Tab 1 Blood concentration monitoring of CsA
2.2 不同性别患者CsA血药浓度监测结果
161例患者中,42例女性患者接受CsA血药浓度监测82例次,平均1.95次/例,平均CsA日剂量为(3.32±21.25) mg/kg,平均CsA血药浓度为(114.86±40.62) ng/ml;119例男性患者接受CsA血药浓度监测206例次,平均1.73 次/例,平均CsA日剂量为(3.09±21.75) mg/kg,平均CsA血药浓度为(126.57±52.15) ng/ml。女性平均CsA日剂量显著高于男性患者,差异有统计学意义(P=0.013);男女患者平均CsA血药浓度的差异无统计学差异(P>0.05)。
2.3 不同年龄患者CsA血药浓度监测结果
161例患者的年龄范围为5~76岁。<18岁患者的平均CsA血药浓度显著低于其他年龄段患者,差异有统计学意义(P<0.001);>65岁患者的平均CsA血药浓度显著高于<18、18~<45岁患者,差异有统计学意义(P<0.05);18~<45岁患者的平均CsA日剂量显著高于45~65、>65岁患者,差异有统计学意义(P<0.05),见表2。
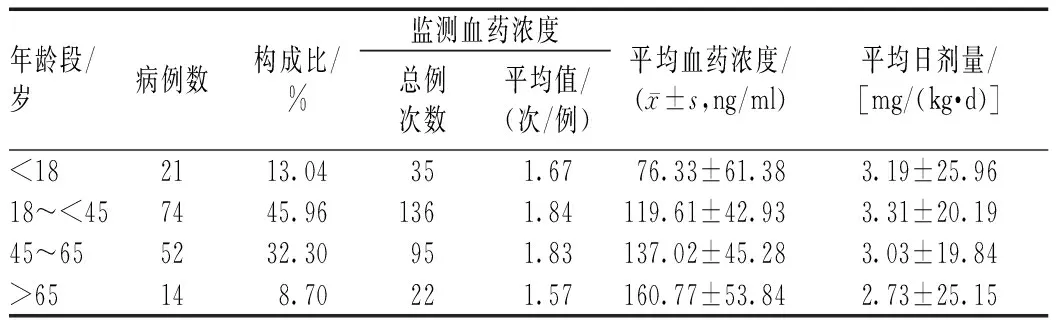
表2 不同年龄段患者CsA血药浓度监测结果Tab 2 Blood concentration monitoring of CsA in patients with different ages
2.4 CsA日剂量对血药浓度的影响
对CsA的日剂量和血药浓度进行相关性分析,结果显示,两者有正相关性(P<0.001),相关系数r=0.282,相关性弱。
2.5 不同类型银屑病患者CsA血药浓度监测结果
将161例患者按照银屑病类型分为关节病型银屑病、红皮型银屑病、脓疱型银屑病和寻常型银屑病四组(其中有6例因2次不同时间入院,分型诊断不同,故合计167例次)。不同类型银屑病患者CsA血药浓度的差异无统计学意义(P>0.05);寻常型银屑病患者的平均CsA日剂量显著低于红皮型银屑病和脓疱型银屑病患者,差异有统计学意义(P<0.05),见表3。
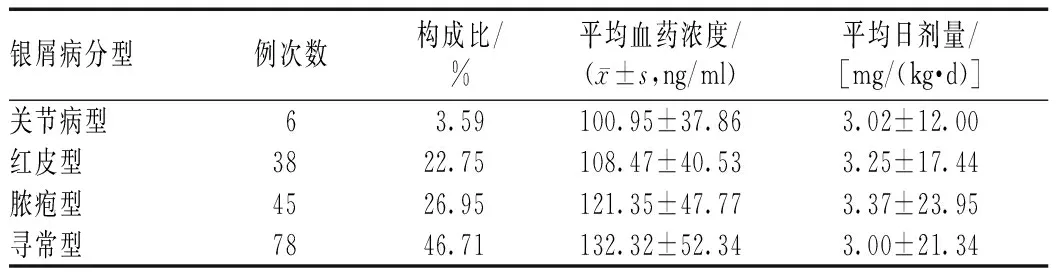
表3 不同类型银屑病患者CsA血药浓度监测结果Tab 3 Blood concentration monitoring of CsA in patients with different disease types
2.6 联合用药情况及其对CsA血药浓度的影响
本研究统计了每次监测CsA血药浓度时患者口服与静脉联合应用的药物品种和使用次数,共涉及85种药品;每次监测CsA血药浓度时联合使用其他药品1~12种,平均(4.02±50.02)种。与CsA联合应用的药物种类分布见表4。由表4可以看出:(1)与CsA联合应用最多的药物为调节免疫功能药物,主要为复方甘草酸苷注射液、雷公藤多苷片、白芍总苷胶囊和雷公藤片。复方甘草酸苷的主要成分为甘草酸苷,具有糖皮质激素样作用,还有免疫调节、抗炎、抗过敏和保肝作用,用于银屑病的辅助治疗[5]。雷公藤制剂和白芍总苷具有较强的免疫调节和抗炎作用,对角质形成细胞增生具有显著的抑制作用,可有效提高银屑病的治疗效果[6]。(2)其次为抗组胺药。使用例次数排序居前10位的药品中有3种抗组胺药,分别为盐酸左西替利嗪片、富马酸酮替芬片和盐酸奥洛他定片。抗组胺药的应用主要为缓解银屑病患者的瘙痒。(3)与CsA联合应用的抗微生物药主要为注射用乳糖酸阿奇霉素。上呼吸道链球菌感染可诱发和加重急性点滴状银屑病、儿童银屑病等,可通过应用大环内酯类抗菌药物控制感染,发挥治疗作用[7]。此外,阿奇霉素还具有抗炎作用,能抑制角质形成细胞的过度增殖,减少树突状细胞、中性粒细胞和CD4、CD8 T细胞在皮损中的聚集,减少白细胞介素(IL)17、IL-22和IL-23等与银屑病发病机制相关的细胞因子的表达[8]。(4)与CsA联合应用的维A酸类药物主要为阿维A胶囊。维A酸类药物联合CsA治疗银屑病,具有协同作用,可减少2种药物的剂量,以减少不良反应的发生,同时避免CsA减量时皮损复发加重。(5)盐酸多塞平属于三环类抗抑郁药,同时对H1和H2受体具有较强的拮抗作用,还是肾上腺素受体、胆碱能受体阻断剂,能抑制组胺的释放,也能缓解银屑病患者的焦虑[9]。
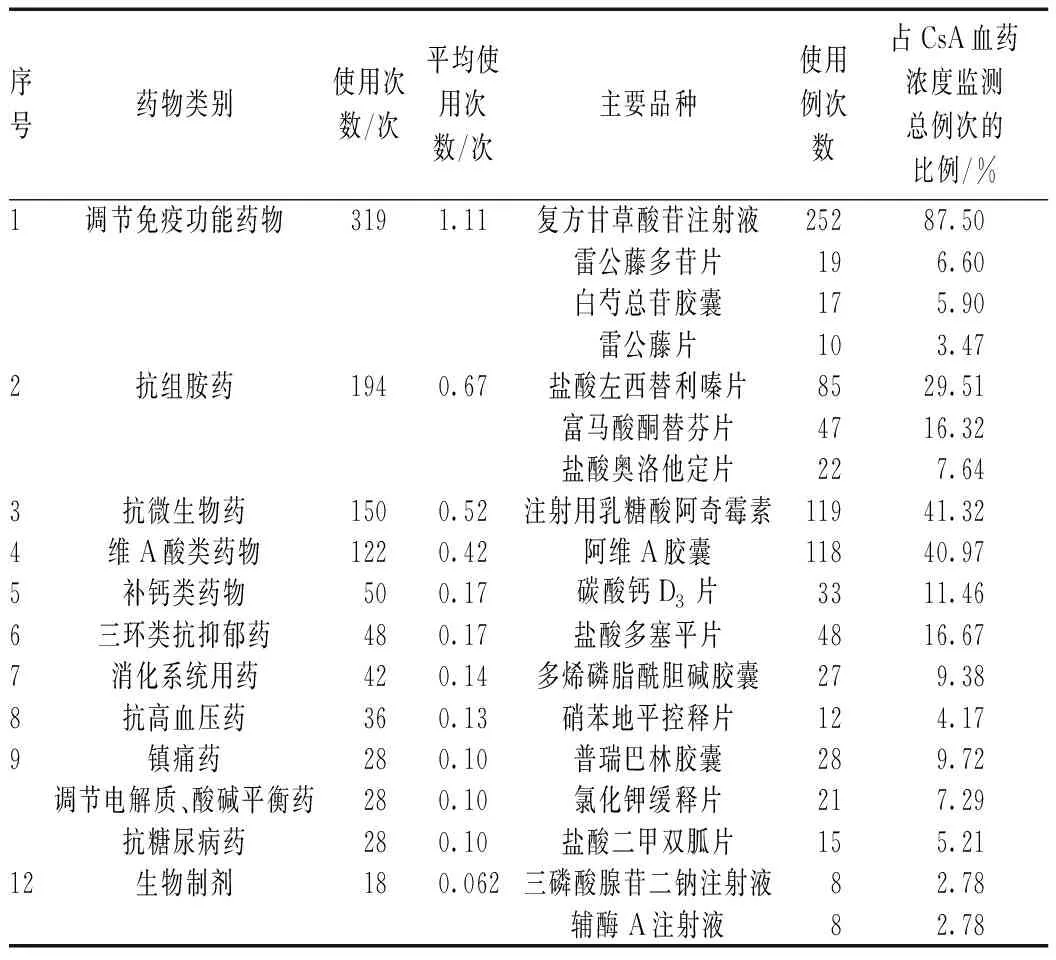
表4 与CsA联合应用的药物种类分布Tab 4 Distribution of drugs used in combination with CsA
对联合用药的品种数与CsA血药浓度进行相关性分析,结果显示,两者无显著相关性(P>0.05)。男性患者平均联合用药(4.04±61.00)种,女性患者平均联合用药(3.95±57.48)种,两者的差异无统计学意义(P>0.05)。寻常型银屑病患者联合用药品种数显著低于红皮型银屑病患者,差异有统计学意义(P=0.02)。
2.7 局部用药的使用情况及其对CsA血药浓度的影响
银屑病患者治疗时需根据皮损的特点和患者的需求选择不同剂型的外用药物,可选择的药物有外用糖皮质激素、维A酸类药物、维生素D3衍生物、润肤剂、钙调磷酸酶抑制剂和角质促成剂等。住院患者多数使用我院自制制剂,包括复方维A酸软膏、复方咪康唑软膏、哈西奈德溶液、复方尿囊素洗剂、硼砂软膏和硫柳软膏等。不同作用机制的外用药物联合应用可以获得协同治疗效果。本研究统计了患者使用外用药物的品种数,每次监测CsA血药浓度时联合使用其他外用药物2~11 种,平均(6.73±36.41)种。对联合应用的外用药物品种数与CsA血药浓度进行相关性分析,结果显示,两者无显著相关性(P>0.05)。男性患者平均联合应用外用药物(6.60±47.14)种,女性患者平均联合应用外用药物(6.88±35.20)种,两者的差异无统计学意义(P>0.05)。寻常型银屑病患者使用外用药物品种数显著高于红皮型、脓疱型银屑病患者,差异有统计学意义(P<0.05)。
3 讨论
3.1 CsA血药浓度与剂量、疗效的关系
CsA治疗再生障碍性贫血的成人口服剂量为3~5 mg/(kg·d),目标血药浓度(谷浓度)为100~200 ng/ml[10];治疗肾病综合征初始治疗期的剂量为3 mg/(kg·d),血药谷浓度为100~150 ng/ml[11]。在银屑病治疗中,CsA初始剂量为3~5 mg/(kg·d),没有明确的谷浓度范围。
本研究中,161例患者进行CsA血药浓度监测288次,90%患者的CsA血药浓度在50~250 ng/ml范围内。银屑病患者使用CsA的剂量与再生障碍性贫血、肾病综合征初始剂量一致,通过临床观察认为CsA血药浓度<50 ng/ml 属于浓度较低,除儿童、老年患者外,可增加CsA剂量以提高疗效,同时加强血药浓度监测,避免发生不良反应。
由于CsA药动学个体差异较大,且CsA血药浓度受联合用药、食物等影响,其剂量与血液浓度的相关性较弱。
3.2 性别对CsA血药浓度的影响
本研究中,男性和女性患者的平均CsA血药浓度相近,男性患者的平均CsA日剂量略低于女性患者。关于性别对CsA血药浓度的影响,文献报道不一,可能存在样本量差异的原因[12-13]。
3.3 年龄对CsA血药浓度的影响
本研究结果显示,年龄对CsA血药浓度有显著影响。>65岁患者的平均CsA血药浓度比18~<45岁患者高(P<0.05),且>65岁患者的平均CsA日剂量最小。这与老年患者分布容积小、药物清除率低的特点有关,且与老年患者的各项器官功能减退、体内脂蛋白水平偏高有关[14]。
161例患者中,<18岁的患者有21 例,其中年龄最小者5岁,平均年龄14.31岁,平均CsA血药浓度为(76.33±61.38)ng/ml,均低于其他年龄段患者,差异有统计学意义(P<0.001)。同时,<18岁患者的平均CsA日剂量与18~<45岁患者相近(P>0.05)。由于银屑病患儿使用CsA治疗时血药谷浓度无明确参考范围,且儿童身体、各器官均在发育生长期,临床可先以低剂量用药,并积极开展CsA血药浓度监测,在达到治疗目的的同时避免因不良反应导致的机体损伤。对银屑病患儿进行治疗的同时,关注其心理健康也非常重要。因为银屑病的损容性和反复性会对患儿的生活质量产生负面影响,因此,及时与患儿和家长沟通,使其及时了解病情的发展、预后、用药以及平时生活护理的注意事项,对疾病的治疗有着积极的意义[15]。
3.4 联合用药、食物对CsA血药浓度的影响
对多次进行血药浓度监测的患者,本研究分析了其联合用药情况,发现14例患者因联合用药影响了CsA血药浓度。其中7例患者联合应用阿奇霉素,其CsA血药浓度为联合用药前的1.79~2.79倍;2例患者联合应用罗红霉素,其CsA血药浓度为联合用药前的2.60倍;1例患者联合应用硝苯地平,其CsA血药浓度为联合用药前的2.60倍;1例患者联合应用更昔洛韦,其CsA血药浓度为联合用药前的2.42倍;2例患者联合应用塞来昔布,其CsA血药浓度为联合用药前的2.05~2.35倍。其中,大环内酯类抗菌药物和钙通道阻滞剂为CYP3A酶抑制剂,可增加CsA的吸收并抑制其代谢,使CsA血药浓度升高[16-17]。而CYP3A酶诱导剂则会使CsA血药浓度降低。
同时,不可忽视中药的影响。本研究中,有1例患者因联合应用脉管复康片,CsA血药浓度升高1.4倍。可能由于脉管复康片中含有丹参,其主要成分隐丹参酮、丹参酮Ⅰ、原儿茶醛和丹参素均可抑制CYP3A酶[18]。其他中药大黄、五味子都可通过CYP3A酶影响CsA血药浓度。此外,食物对CsA血药浓度也有影响。曾有1例门诊患者服用CsA的同时食用大量柚子,导致CsA血药浓度升高。
临床用药中可通过评估联合用药之间的影响,利用药物相互作用使CsA血药浓度升高,在降低CsA剂量的同时获得满意的治疗效果,还能减少不良反应的发生,减少患者治疗支出。
患者的遗传因素如CYP3A5基因型的差异对CsA的代谢也有影响,进而可对CsA的血药浓度产生影响[19-20]。本研究未反映银屑病患者的遗传因素与CsA血药浓度的关系,需进一步开展银屑病患者遗传因素对CsA血药浓度影响的研究,为制定CsA的个体化给药方案提供参考依据。
综上所述,剂量、年龄、联合用药以及食物都可能影响CsA血药浓度。临床应用CsA治疗银屑病的过程中,应加强CsA血药浓度监测,并充分考虑上述影响因素,为银屑病患者的个体化给药提供参考依据,促进CsA使用的安全性和有效性。

