DANCR通过AKT-GSK3β-Cyclin D1信号通路调控黑素瘤细胞活性机制的研究
李程彬 徐威龙 李婷 陈佳 舒茂国 贾晶
[摘要]目的:探索长链非编码(Long non-coding,Lnc)RNA DANCR(Anti-differentiation nc RNA)在黑素瘤组织中表达及其对黑素瘤细胞的作用及其作用机制。方法:检测黑素瘤和瘤旁组织中DANCR表达,及其与患者临床预后的关系。在敲低DANCR的黑素瘤细胞株A375和B16中通过MTT和克隆形成实验检测敲低DANCR对细胞活性影响,通过Western-blot实验检测p-AKT,p-GSK3β和Cyclin D1表达,并通过细胞流式检测细胞周期分布。通过过表达DANCR检测其是否通过AKT/GSK3β调控细胞活性。结果:DANCR在黑素瘤组织中表达上调,并与黑素瘤不良临床预后相关;敲低DANCR可抑制黑素瘤细胞活性,下调p-AKT、p-GSK3β和Cyclin D1表达;抑制AKT或GSK3β均可减弱DANCR过表达对细胞活性上调作用。结论:DANCR在黑素瘤中表达上调,激活AKT-GSK3β-Cyclin D1信号通路上调细胞活性,促进黑素瘤进展。
[关键词]LncRNA DANCR;黑素瘤;细胞活性;增殖;AKT;GSK3β;Cyclin D1
[中图分类号]R739.5 [文献标志码]A [文章编号]1008-6455(2021)03-0086-04
DANCR was Upregulated in Melanoma Tissues and Promoted Cell Viability Via AKT-GSK3β-Cyclin D1 Signaling
LI Cheng-bin,XU Wei-long,LI Ting,CHEN Jia,SHU Mao-guo,JIA Jing
(Department of Plastic,Cosmetic and Maxilofacial Surgery,the First Affiliated Hospital of Xian Jiaotong University,Xian 710061,Shaanxi,China)
Abstract: Objective To investigate the expression of long non-coding RNA DANCR in melanoma tissues, and the role and potential mechanism of DANCR in melanoma development. Methods Detecting the expression of DANCR in melanoma and the adjacent tissues to analyze the relation of DANCR expression and clinical prognosis. Knocking DANCR down in melanoma cell lines, A375 and B16. Cell viability was detected using MTT and colony formation assays. Western blot assay detected the expression of p-AKT, p-GSK3β and Cyclin D1. Flow cytometry assay analyzed the distribution of cell cycle. DANCR-overexpressed cells were used to confirm that DANCR regulated cell viability via AKT/ GSK3β signaling. Results DANCR expression was upregulated in melanoma tissues compared with the adjacent tissues, which was associated with poor clinical prognosis. Knocking DANCR down repressed cell viability and diminished expression of p-AKT, p-GSK3β and Cyclin D1. Inhibiting both p-AKT and p-GSK3β reversed DANCR overexpression induced enhancement of cell viability. Conclusion DANCR was upregulated in melanoma cells and enhanced melanoma cell viability via modulating AKT-GSK3β-Cyclin D1 signaling.
Key words: LncRNA DANCR; melanoma; cell viability; proliferation; AKT; GSK3β; Cyclin D1
惡性黑素瘤(Melanoma)是恶性度最高的皮肤肿瘤。近年来,黑素瘤在我国发病率成倍增长[1]。一直以来,其易转移,易复发的特点,加之目前并无针对性的治疗方案,导致黑素瘤的愈后极差。小分子靶向药物和免疫治疗等新兴疗法延长了黑素瘤患者生存时间,但仍存在耐药现象[2]。因此,深入研究黑素瘤发生发展分子机制以寻找新的治疗靶点十分迫切。前期研究表明DANCR功能复杂,如对抗上皮组织细胞分化[3];抑制牙源干细胞和成骨细胞分化[4-5];在一定程度上与结肠癌不良预后相关[6]。此外,DANCR还可增加肝癌组织细胞干性,促进细胞生长和转移[7-8]。敲低DANCR可明显抑制乳腺癌细胞转移[9]。本研究以DANCR为研究对象,初步探索DANCR在黑素瘤中的作用及其可能作用机制。
1 材料和方法
1.1 材料:胎牛血清为HyClon产品;DMEM为中国碧云天产品;第一抗体:抗p-AKT(#9611),抗AKT(#4685),抗p-GSK3β(#5558),抗GSK3β(#12456)和抗Cyclin D1(#2978)购于CST(Cell Signaling Technology)科技公司。黑素瘤细胞株A375和B16购于美国ATCC;双抗(青霉素和链霉素)、EDTA,二甲基亚砜(DMSO)和四氮唑蓝(MTT)购于Invitrogen公司(美国)。LY294002(L9908)和LiCl(L4408)购于美国Sigma-Aldrich公司。
1.2 方法
1.2.1 细胞培养和稳定RNA干扰:人黑素瘤细胞株A375和B16分别培养于含有10%血清的DMEM培养基和高糖DMEM培养基中。细胞培养在适当湿度的培养箱中,温度恒定于37℃。复制缺陷慢病毒用作转染载体。其中包含了用于构建稳定敲除DANCR或过表达DANCR的shRNA或DANCR基因片段。慢病毒感染A375和B16细胞以构建稳定敲除DANCR或过表达DANCR的细胞株。实时定量PCR(qRT-PCR)技术用于检测转染效率。
1.2.2 RNA提取和实时定量PCR(Quantitative real-time PCR,qRT-PCR)检测:总RNA提取试剂盒(上海飞捷生物技术有限公司)用于提取细胞中总RNA。1μg总RNA通过Superscript Ⅲ转录酶用于反转录(购于赛默飞)。所得反转RNA继续和SYBR Green共同用于qRT-PCR检测,以分析靶基因的表达。甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)用作内参。
1.2.3 Western blot检测:RIPA细胞裂解液中加入蛋白酶抑制剂,之后用于裂解细胞。所提取的细胞裂解液离心留取蛋白溶解液,用Bradford法检测蛋白浓度。之后每组吸取30μg蛋白加入12%的SDS-聚丙烯酰胺凝胶进行电泳分离。待蛋白完全分离后,转移分离开的蛋白条带至硝化纤维素(Nitrocellulosefilter,NC)膜上。用5%的脱脂牛奶室温孵育NC膜1h以封闭膜上非特异性结合位点。之后用特异性一抗在4℃孵育NC膜过夜。反复清洗NC膜,之后用辣根过氧化物酶二抗孵育NC膜,用成像仪观察蛋白条带。
1.2.4 组织获取和激光捕获微检测:该研究所用标本为2014年6月-2017年9月在西安交通大学第一附属医院行手术切除的黑素瘤患者肿瘤标本。该研究经过西安交通大学第一附属医院伦理委员会批准,并全程遵循相关规定。标本收取和使用前,与患者进行了充分的沟通并签署相关知情同意书。该研究遵循了1964年赫尔辛基公告及其之后的修订。在病理医生指导下,激光捕获法分别切取黑素瘤组织和瘤旁组织。切割下的组织进行裂解并提取RNA,经反转录后行qRT-PCR检测相应基因表达情况。
1.2.5 克隆形成实验:细胞种于6孔板中(1 000细胞/孔),连续培养约两周至单个克隆细胞数量约50细胞。弃去培养基,以4%多聚甲醇固定培养板中细胞,结晶紫染色约10min后,PBS洗涤培养板三遍,最终摄像并计数每孔中细胞克隆数量。
1.2.6 四氮唑蓝(MTT)比色检测:MTT检测用于检测细胞活性。5×103细胞种于96孔板中,培养箱中培养24h后改用无血清培养基继续培养,或者用不同抑制剂处理。不同处理后细胞更换新鲜无血清培养基,加入MTT试剂(0.5mg/ml)在37℃培养4h。之后小心移除培养基,再加入150μl的DMEM,轻柔震动使结晶充分溶解,在490nm波长下使用微盘分析仪读取各孔结晶浓度。每组设置5个重复孔。
1.2.7 流式细胞仪检测细胞周期:当细胞培养至密度为60%~80%时即用胰酶/EDTA消化细胞以获取细胞。获取的细胞用PBS洗涤后,重悬于预冷的70%甲醇中,继续在-20℃环境中放置24h。检测前,离心以去除甲醇,继续用冷PBS清洗两次。之后再细胞中加入RNAse A (0.5μg/ml)和碘化丙啶(50μg/ml),继续在室温下培养于黑暗中。30min后用流式细胞仪检测细胞周期。
1.2.8 统计学分析:本研究使用GraphPad prism 5软件进行作图和统计分析,Students t检测用于两组之间差异的统计分析。对于三组及以上各组间差异分析,用SPSS 17.0软件通过单因素方差分析(ANOVA)和Fisher最小显著性差异进行分析比较。P<0.05被定义为差异有统计学意义。
2 结果
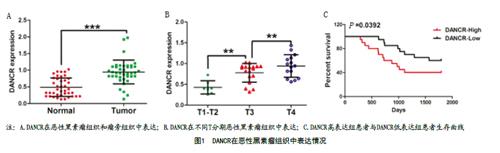
2.1 DANCR在恶性黑素瘤患者组织中表达情况:恶性黑素瘤患者中DANCR表达明显高于瘤旁组织(P<0.05),见图1A。进一步分析可知,DANCR的表达水平会随着T分期升高而呈现表达上调,见图1B。将黑素瘤患者按照DANCR表达水平分为两组,分析其生存时间可知:DANCR高表达组生存预后较DANCR低表达组差,见图1C。
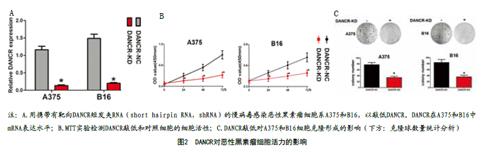
2.2 敲低DANCR抑制恶性黑素瘤细胞活性:为进一步阐述DANCR在黑素瘤细胞中高表达所发挥的作用,使用携带靶向DANCR的short hairpin(sh)RNA慢病毒轉染细胞处理A375和B16,从而得到DANCR含量较低的目标细胞株,见图2A。通过MTT检测可见,敲低DANCR可抑制A375和B16的细胞活力,见图2B。同样,克隆形成实验进一步支持了这一观点:敲低DANCR可抑制其克隆形成能力,见图2C。
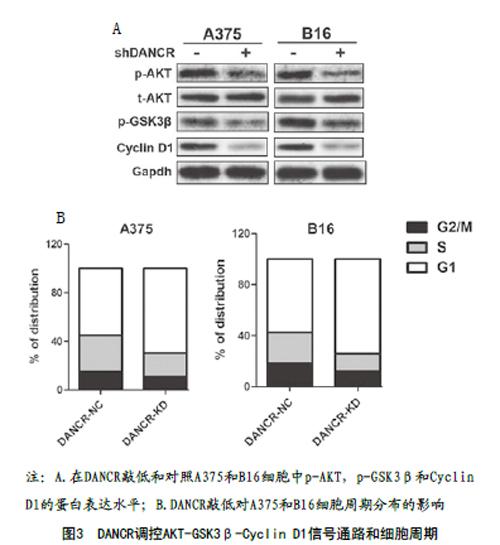
2.3 敲低DANCR下调AKT-GSK3β-Cyclin D1信号通路并抑制细胞周期:为了探索DANCR调控A375和B16细胞活性的潜在分子机制,用Western-Blot检测了目标细胞中相关蛋白表达水平的变化。结果表明:敲低DANCR的A375和B16细胞中p-AKT,p-GSK3β和Cyclin D1蛋白水平均出现了不同程度的下降,见图3A。此外,细胞周期检测分析可见,敲低DANCR可抑制细胞周期向S期和G2/M期转换,更多细胞停留于G1期,见图3B。
2.4 DANCR通過AKT-GSK3β-Cyclin D1信号通路调控黑素瘤细胞活性:为了证实AKT-GSK3β-Cyclin D1信号通路在DANCR调控细胞活动中所发挥的作用,用慢病毒为载体构建了DANCR过表达的细胞模型并检测转染效果,见图4A。Western-Blot检测可见,DANCR过表达上调p-AKT,p-GSK3β和Cyclin D1蛋白表达。而用LY294002在DANCR过表达细胞中抑制p-AKT活性后,可见p-AKT,p-GSK3β和Cyclin D1蛋白表达下调,见图4B。DANCR过表达也可促进A375和B16细胞活性,同样,LY294002可抑制DANCR过表达所引起的细胞活性增加,见图4C。与其相一致的是,克隆形成实验显示DANCR过表达可促进克隆形成,而LY294002可减弱该促进作用,见图4D。用LiCl抑制GSK3β以验证其在DANCR调控细胞活性中的作用。Western-Blot实验结果显示,抑制GSK3β可有效逆转DANCR过表达诱导的Cyclin D1上调,见图4E。同样,抑制GSK3β也可下调DANCR过表达引起的细胞活性增加(见图4F)和克隆形成增强(见图4G)综上所述,图4结果证实了AKT-GSK3β-Cyclin D1信号通路在DANCR调控细胞活性中所发挥的重要作用。
3 讨论
近年来,关于黑素瘤相关分子机制的研究取得了巨大的进展[10],由于黑素瘤具有高度的侵袭性和强烈的致死性,黑素瘤患者仍不能逃离复发和死亡的命运[11]。因此,深入理解黑素瘤发生发展的分子机制,将帮助挖掘新的靶点,为改善黑素瘤患者临床预后提供可能性。
随着非编码RNA在生物进程中的重要作用被不断揭示,其功能研究和其表观遗传调控机制研究为攻克黑素瘤提供了新的方向。LncRNAs是一组内源性非蛋白编码RNA(Long non-coding RNA,LncRNA),其在黑素瘤发生发展中不同层面所发挥的作用也被不断报道[12]。研究表明,很多LncRNA,如HOTAIR,MALAT1,BANCR,ANRIL,SAMMSON和SPRY-IT1,在黑素瘤细胞增殖、分化、侵袭迁移中发挥重要作用[12]。前期研究证实,LncRNA DANCR在多种肿瘤的进展作用重要,但目前关于DANCR在黑素瘤进展中作用尚不清楚。发现DANCR在黑素瘤组织中较瘤旁组织表达上调,与黑素瘤患者不良临床愈合密切相关。介于黑素瘤往往带来较差的临床结局,以及其对传统治疗反应性较差,早期发现和诊断黑素瘤,进而早期进行临床干预,就显得尤为重要。因此,DANCR有望作为黑素瘤的一个新的诊断指标或成为黑素瘤治疗后临床进展的检测指标。
PI3K/AKT信号通路在多种皮肤癌症的发生发展中发挥着重要作用。因此,很多靶向PI3K/AKT的药物被不断挖掘出来,并证实可用于癌症治疗[13]。PI3K/AKT信号通路通过靶向相应靶基因调控细胞增殖、粘附、侵袭迁移和血管生成。已有研究证实,PTEN缺失和PI3K/AKT信号通路激活可见于大多黑素瘤[14],而靶向抑制PI3K/AKT及其下游分子也可抑制黑素瘤进展[15]。本次研究结果提示,DANCR在黑素瘤中表达上调,通过PI3K/AKT信号通路促进细胞增殖和细胞周期。GSK3β是AKT信号通路的重要下游分子,在肿瘤进展中作用重要[16]。研究发现,DANCR上调GSK3β表达,而用LiCl抑制GSK3β可有效逆转DANCR过表达所有诱导的细胞活性上调。
目前靶向PI3K/AKT信号通路的靶向药物不断问世,但前期临床实验显示其效果仍欠理想[17]。而研究中所揭示的DANCR-AKT-GSK3β信号通路调控Cyclin D1表达影响黑素瘤细胞周期,有望为其治疗提供新的靶点。此外,PI3K/AKT信号通路在癌细胞侵袭迁移中同样作用重要;而DANCR也可促肿瘤侵袭迁移。考虑黑素瘤强侵袭迁移特性,靶向DANCR有望成为黑素瘤临床治疗的一个靶标。
本研究结果显示,DANCR在黑素瘤组织中表达上调,可激活AKT-GSK3β-Cyclin D1通路发挥作用。这一发现为DANCR作为黑素瘤临床治疗补充靶点或作为黑素瘤诊断和预后的分子指标提供了一定的理论基础。
[参考文献]
[1]李荟元.国外美容医学最新研究与进展(九)-恶性黑色素瘤[J].中国美容医学,2017,26(11):148-149.
[2]Barquet-Munoz SA,Leitao M,Perez MM,et al.Vulvar melanoma: management of primary disease and repeated recurrences[J].Int J Gynecol Cancer,2019,29(6):1077-1081.
[3]Kretz M,Webster DE,Flockhart RJ,et al.Suppression of progenitor differentiation requires the long noncoding RNA ANCR[J].Genes Dev,2012,26(4):338-343.
[4]Jia Q,Chen X,Jiang W,et al.The regulatory effects of long noncoding rna-ancr on dental tissue-derived stem cells[J].Stem Cells Int,2016,2016:3146805.
[5]Jia Q,Jiang W,Ni L.Down-regulated non-coding RNA (lncRNA-ANCR) promotes osteogenic differentiation of periodontal ligament stem cells[J].Arch Oral Biol,2015,60(2):234-241.
[6]Liu Y,Zhang M,Liang L,et al.Over-expression of lncRNA DANCR is associated with advanced tumor progression and poor prognosis in patients with colorectal cancer[J].Int J Clin Exp Pathol,2015,8(9):11480-11484.
[7]Ma X,Wang X,Yang C,et al.DANCR acts as a diagnostic biomarker and promotes tumor growth and metastasis in hepatocellular
carcinoma[J].Anticancer Res,2016,36(12):6389-6398.
[8]Yuan SX,Wang J,Yang F,et al.Long noncoding RNA DANCR increases stemness features of hepatocellular carcinoma by derepression of CTNNB1[J].Hepatology,2016,63(2):499-511.
[9]Li Z,Hou P,Fan D,et al.The degradation of EZH2 mediated by lncRNA ANCR attenuated the invasion and metastasis of breast cancer[J].Cell Death Differ,2017,24(1):59-71.
[10]秦琴,寧花兰,陈小燕,等.miR-let-7b通过调控相关细胞周期蛋白影响皮肤黑色素瘤的增殖和凋亡[J].中国美容医学,2018,27(7):79-82.
[11]高正君,谢沛霖,司小强,等.不同来源黑色素瘤BRAF V600E基因突变分析[J].中国美容医学,2018,27(1):74-76.
[12]Yu X,Zheng H,Tse G,et al.Long non-coding RNAs in melanoma[J].Cell Prolif,2018,51(4):e12457.
[13]张斌斌,王湘琦,赵超然,等.阻断PI3K/AKT/mTOR通路增强顺铂诱导的人皮肤黑素瘤细胞株A375凋亡的机制研究[J].中国美容医学,2019,28(8):72-76.
[14]地里夏提·库尔班,陈召.Notch1调控PI3K/AKT信号通路促进黑素瘤细胞发展的研究[J].中国美容医学,2019,28(1):93-96.
[15]Lim HN,Baek SB,Jung HJ.Bee venom and its peptide component melittin suppress growth and migration of melanoma cells via inhibition of PI3K/AKT/mTOR and MAPK pathways[J].Molecules,2019,24(5):929.
[16]Wickenden JA,Watson CJ.Key signalling nodes in mammary gland development and cancer. Signalling downstream of PI3 kinase in mammary epithelium: a play in 3 Akts[J].Breast Cancer Res,2010,12(2):202.
[17]Vahidnezhad H,Yousse FAL,Uitto J.Molecular genetics of the PI3K-AKT-mTOR pathway in genodermatoses: diagnostic implications and treatment opportunities[J].J Invest Dermatol,2016,136(1):15-23.
[收稿日期]2020-03-16
本文引用格式:李程彬,徐威龙,李婷,等.DANCR通过AKT-GSK3β-Cyclin D1信号通路调控黑素瘤细胞活性机制的研究[J].中国美容医学,2021,30(3):86-90.

