脊柱手术后深部切口感染患者多次清创的危险因素
周柏林,李危石,孙垂国,齐 强,陈仲强,曾 岩
(北京大学第三医院骨科,北京 100191)
脊柱外科手术因其创面大、手术时间长、内置物多导致切口感染风险高,发生率约为 0.7%~15%[1-2]。尤其是一旦发生深部切口感染,患者往往需要进行清创术,延长静脉使用抗生素时间,导致住院日延长,增加患者的经济负担和心理负担。随着医疗技术和管理水平的提高以及抗生素药效的改进,脊柱外科医生能够在早期发现切口感染,及时行清创术,并根据细菌培养结果合理选择抗生素,加强术后护理,使得绝大多数感染在单次清创术后即可被有效控制,取得较好的预后。但据文献报道,仍有18.8%~45.1%的患者由于各种内在和外在因素,在接受单次清创术后感染无法得到有效控制,需再次甚至更多次的清创术[3-4]。
目前,国内外关于探索脊柱手术后切口感染危险因素的研究表明,年龄、合并糖尿病、体重指数、术前诊断、手术持续时间、手术部位、手术入路、手术创伤程度、术前体表细菌定植等多种因素有可能影响术后切口感染率[5],但较少见探索脊柱手术后切口感染接受多次清创术危险因素的研究。
相比接受单次清创术的患者,接受多次清创术的患者不但住院日、医疗费用明显增加,而且还面临着取出内置物、继发其他并发症的风险。取出内置物后可能导致矫形效果丢失、内固定失败、假关节形成等,影响患者脊柱的支撑、维持形态、屈伸活动等功能[6-8],因此,导致多次清创术的危险因素更应引起医生的警觉。
本研究通过对脊柱手术后发生深部切口感染并进行单次或多次清创术的患者资料进行回顾,总结脊柱手术后深部切口感染的二次清创率及相关临床特点,探索多次清创术的危险因素,并回顾目前国内外对其相关危险因素的认识及可行的预防措施。
1 资料与方法
1.1 一般资料
回顾性分析北京大学第三医院骨科2012年1月至2017年12月接受脊柱手术的患者资料,按照如下纳入与排除标准,共纳入84例脊柱手术后发生深部切口感染并进行清创术的患者。
纳入标准:(1)年龄大于18岁的接受脊柱手术的患者;(2)符合美国疾病预防控制中心(Centers for Disease Control,CDC)手术部位感染(surgery site infection,SSI)诊断标准中深部切口感染诊断标准[9];(3)发生于手术后30 d内的切口感染;(4)药物治疗、充分引流等保守治疗失败,伴有严重或进行性加重的神经功能损害,于手术室行清创术的患者。排除标准:(1)原发脊柱感染手术患者;(2)开放性骨折患者;(3)行经口咽入路的上颈椎手术患者;(4)进行单次清创术但感染并未控制,有二次清创术指征,但拒绝行二次清创术的患者;(5)感染证据不充分,临床表现不典型,诊断为切口内积液、切口愈合不良或脂肪液化的患者。
84例中包括脊柱肿瘤2例、脊柱创伤7例、脊柱退行性疾病75例。其中单次清创组60例,包括男性36例、女性24例,年龄36~77岁,平均(57.2±10.45)岁;多次清创组24例(14例2次清创,6例3次清创,1例4次清创,2例5次清创,1例6次清创),包括男性17例、女性7例,年龄21~70岁,平均(49.5±11.3)岁。
1.2 切口感染处理
对于脊柱手术后考虑或怀疑切口感染的患者,首先留取伤口分泌物行细菌培养和药敏试验,同时经验性静脉途径应用广谱抗生素,待检验结果回报后选择细菌敏感的抗生素。除非有充分的证据表明感染为浅表感染或静脉应用抗生素、充分引流后症状和体温明显改善,所有患者均在手术室行手术部位探查及清创术。如患者出现严重的或进行性加重的神经功能损害,则尽早进行手术治疗。拆除手术缝线,沿原切口切开皮肤后逐层探查切口,探查过程中采集分泌物送细菌培养及药敏试验;清除脓性分泌物、积液、坏死组织。若术中探查发现内固定装置松动、断裂,或清创术次数达到2次或以上仍难以控制感染时,考虑拆除固定装置及植骨。依次以足量过氧化氢、稀碘伏溶液、大量无菌生理盐水序贯冲洗伤口,于筋膜层与肌层腔隙内对口放置2~4根引流管作为术后持续灌洗用。关闭手术切口,术后将位于切口一端的引流管作为入水管,位于切口另一端的引流管作为出水管,用生理盐水以每天3 000~6 000 mL的流速持续冲洗1周左右,然后每隔2~3 d行引流液细菌培养,培养结果为阴性后逐渐降低冲洗速度,再次细菌培养阴性后停止持续冲洗并拔除入水管,保留引流管。如果连续第3次细菌培养为阴性,24 h引流量小于50 mL时考虑拔除引流管,根据切口愈合情况决定拆线时间。治疗期间根据细菌培养及药敏结果及时调整抗生素使用方案,在连续细菌培养阴性,患者体温、血象正常后考虑停止使用抗生素。如果患者全身、局部症状不缓解,血液化验指标改善不理想,引流液仍然浑浊或细菌培养仍然阳性,可在缝合后经综合评估再次行清创术。
1.3 统计学方法
采用SPSS 19.0对数据进行分析,比较单次清创组和多次清创组数据。两组间单因素分析采用卡方检验,将单因素分析中有统计学意义的变量纳入二元Logistic回归模型进行多因素分析。单次清创组和多次清创组间取出内置物比例和行皮瓣移植比例之间差异采用Fisher精确检验,住院日的差异采用独立样本t检验。所有统计学检验均为双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
纳入的84例患者二次清创率为28.6%。单次清创组和多次清创组累计住院时间分别为(40.4±31.5) d和(82.4±46.3) d(P=0.018);单次清创组中4例取出内置物,多次清创组中6例取出内置物(P=0.049);单次清创组无病例行皮瓣移植,多次清创组有7例行皮瓣移植术修复创面(P<0.001)。细菌学检验结果阳性62例:甲氧西林敏感金黄色葡萄球菌17例、耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)8例、表皮葡萄球菌6例、阴沟肠杆菌5例、大肠埃希菌4例、粪肠球菌4例、肺炎克雷伯菌4例、产酸克雷伯菌3例、铜绿假单胞菌3例、粘质沙雷菌2例、阿氏肠杆菌1例、克氏库克菌1例、克氏柠檬酸杆菌1例、鲁氏不动杆菌1例、奇异变形杆菌1例、培养阴性但涂片示革兰阴性杆菌1例。
2.2 单因素分析结果
单次清创组与多次清创组相关变量及单因素分析结果见表1。单次清创组原始手术时间大于3 h的有16例(26.7%),多次清创组有13例(54.2%),二者间差异有统计学意义(P=0.017)。单次清创组原始手术出血量大于400 mL的有24例(40.0%),多次清创组有17例(70.8%),二者间差异有统计学意义(P=0.011)。单次清创组10例伴有糖尿病(16.7%),多次清创组9例伴有糖尿病(37.5%),二者间差异有统计学意义(P=0.039)。将细菌学检验结果分为3类:MRSA、甲氧西林敏感革兰阳性菌和其他结果,分析显示两组之间差异有统计学意义(P=0.002)。单次清创组伴有远隔部位感染(包括泌尿系统、呼吸系统、菌血症等)10例(16.7%),多次清创组伴有远隔部位感染10例(41.7%),二者间差异有统计学意义(P=0.015)。

表1 单次清创组与多次清创组相关变量及单因素分析结果(n)Table 1 Basement characteristics and univariate analysis between single and multiple debridement groups (n)
2.3 多因素分析结果
将原始手术时间大于3 h、原始手术出血量大于400 mL、伴有糖尿病、细菌学检验结果、伴有远隔感染5项变量纳入二元Logistic回归模型,结果显示原始手术时间大于3 h(OR=3.60,P=0.032)、合并糖尿病(OR=3.74,P=0.041)、细菌检验结果为MRSA(OR=16.87,P=0.003)与多次清创术密切相关(表2)。
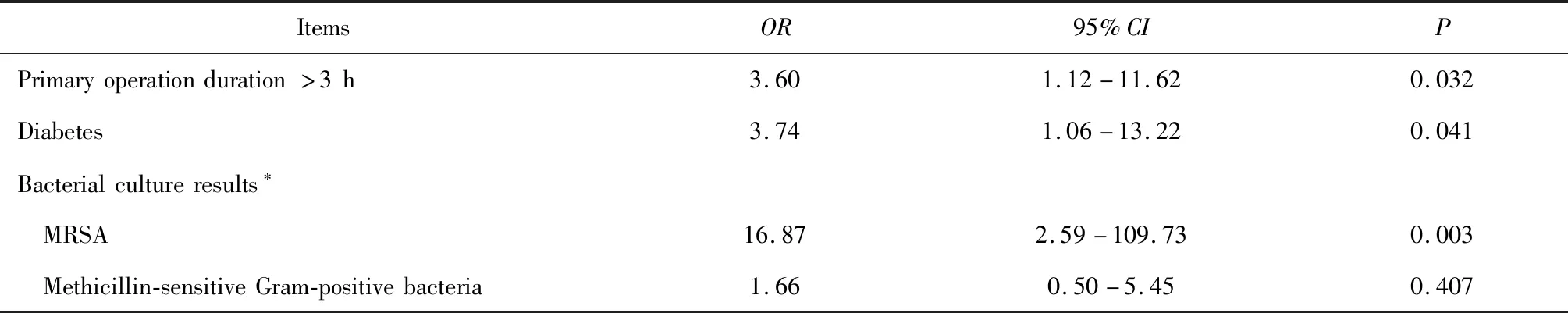
表2 脊柱手术后切口感染行多次清创术的多因素分析Table 2 Multivariate analysis of risk factors of multiple debridement
3 讨论
3.1 脊柱手术后切口感染的诊断
目前,国际上没有针对脊柱手术后切口感染的明确、规范的诊断标准,相关研究所采用的诊断标准也并不一致,经归纳主要有如下几种:(1)CDC制定的SSI诊断标准。该标准广泛应用于外科领域SSI的诊断,其结合了临床表现、细菌培养结果和医生的主观诊断,并将SSI分为浅表切口感染、深部切口感染、累及器官和脏器的感染,具有较强的实用性。我国国家卫生健康委员会制定的SSI标准基本参照了CDC的诊断标准,而且近半数脊柱手术后切口感染的相关研究也选择了此标准,但此标准中关于“脓性引流(purulent drainage)”或“脓肿(abscess)”的用词在临床实际中并不明确,“浑浊积液”(turbid effusion)与“脓”(pus)之间也存在一定的判断灰度区。虽然CDC标准中加入了“依照临床医生的经验进行诊断”的内容,增加了实际应用中的灵活性,但是在我国绝大多数临床医生不会倾向于将“疑似SSI”,甚至是“高度疑似SSI”诊断为SSI,即使在治疗上已采取了切口感染的治疗流程。(2)以细菌培养阳性作为诊断标准。细菌培养阳性是诊断脊柱手术后切口感染的金标准,并可根据药敏结果指导治疗。但有研究表明,对于高度怀疑切口感染的患者,细菌培养阳性率只有65%~86%[10-11],因此,建议在取材时避免杂菌污染,并多处、多次取样。本研究84例患者中有62例(73.8%)细菌培养结果阳性,我们认为,其余患者细菌培养阴性的原因可能有:进行外科干预时局部感染尚处于早期阶段,细菌浓度相对较低;某些细菌在离体培养环境中不易生存,检出率低;取材技术不理想。(3)以接受清创术作为诊断标准。从“临床诊断”意义而言,此标准在敏感性和特异性上都有缺陷,该标准不仅可能遗漏一部分行敞开切口换药和应用抗生素治疗后感染得到控制的患者,而且还可能增加假阳性率,因为对于可疑切口感染的患者,临床上多采取较为激进的清创术策略,以避免因延误引起的细菌定植、感染扩散,导致后续处理难度增大,预后不良。但该标准的优点在于,有一个明确的判定结局发生的决策事件,而且暴露切口进行清创术是明确感染诊断、评估感染情况的前提。CDC制定的SSI诊断标准中也包括“当医生认为切口可能感染、存在拆除缝线清创的必要性并确实拆除了缝线”这一判断内容。(4)其他,包括以术后使用抗生素治疗作为感染诊断标准,未明确说明切口感染标准,以及不同诊断标准相互组合补充等。
浅表切口感染不累及内置物,多采取敞开创面换药的治疗方法,深部切口感染处理较为棘手,目前多采取尽早行清创术并合理应用抗生素的治疗方法,但疗效仍不十分理想,应该成为临床关注的重点。本研究根据研究目的,主要纳入符合CDC深部切口感染诊断标准并接受清创术的患者。
3.2 多次清创术的危害
随着内固定材料、手术技术等的进步,脊柱外科领域有了显著的发展,但术后切口感染仍是不容忽视的并发症。对于发生术后切口感染的患者,如果能及时发现,必要时进行充分的探查清创,加上合理的抗生素使用、完善的术后切口护理,大多数患者通过单次清创术即可治愈,获得满意的预后。但部分患者在单次清创术后感染无法有效控制,需二次甚至更多次清创术,这些患者的经济负担、心理负担显著增加,住院时间明显延长,有可能面临内置物取出、皮瓣移植修复,甚至死亡的风险。
感染发生早期,内置物表面由细菌产生的多糖蛋白膜尚不成熟,此时彻底清创,消除周围的炎性组织,联合敏感抗生素使用,手术部位的细菌和毒素浓度会显著减少,炎症因子得到引流,感染情况会逐渐好转、消退,内置物可成功保留。但如果清创术后感染持续得不到控制,迁延不愈,局部细菌在一定浓度持续存在,生物膜可能会逐渐成熟、扩展、增厚,抗生素难以通过,而且可逃逸宿主的免疫反应,使病原体难以根除,此时不得不考虑移除内置物以控制感染[12]。本研究共有10例样本在清创术中移除内固定,其中单次清创组4例取出内置物,多次清创组6例取出内置物(P=0.049)。单次清创组中3例术中探查发现内固定有明显松动或断裂,1例感染时间长(28 d)且术前伤口分泌物培养结果为MRSA,考虑患者为多重耐药菌感染且内固定处有较多脓液,遂移除内固定以利于控制感染。多次清创组中除有1例为探查发现内固定松动后移除内固定外,其余5例均为多次清创术后感染仍未得到有效控制,遂移除内固定,包括2例第3次清创术时移除内固定,2例第5次清创术时移除内固定,1例第6次清创术时移除内固定。以上病例在移除内固定后感染均得到有效控制,未再行进一步清创术,术后随访半年内未复发。因此,对于反复多次清创术后感染仍难以获得控制的病例,移除内置物后抗炎可能是有效的治疗手段,但移除内置物后可能出现畸形进展、局部假关节形成等,影响手术效果。因此,对于治疗早期的深部SSI,很少需要移除内置物,但对于已获得稳定融合的迟发性感染,可以考虑移除内置物且不会影响治疗效果。本研究有5例患者经多次保留内置物的清创术后仍无法控制感染,最终移除内置物,其中4例在移除内置物后半年随访内未发现医源性腰椎不稳,另1例患者第5次清创手术移除内置物后感染得到控制,但术后出现持续性腰痛,考虑与术后腰椎不稳有关,遂在末次清创手术后第5个月行翻修术并再次植入内置物,术后症状改善明显。
感染灶持续时间越长,对软组织的破坏越严重,再加上清创术本身对软组织的损伤,多次清创术的患者更有可能需要接受皮瓣移植填充缺损,修补创面。
3.3 多次清创术的危险因素
对于脊柱手术术后发生切口感染的患者,应该尽可能地通过彻底、有效的清创术消除感染,以控制病情,减少痛苦,力争不再次进行清创术,但此时患者的客观感染情况已经形成,而且目前国内外并没有明确的研究表明某种针对脊柱手术后切口感染的治疗方法可以更有效地控制感染,降低再次手术风险,所以分析多次清创术的危险因素的意义更多在于警惕和预防。
多项研究表明,糖尿病是显著影响包括脊柱手术在内多种手术发生术后切口感染的危险因素[13-16]。通过本研究的分析,糖尿病也显著增加多次清创术的风险(OR=3.74)。血管中的高糖状态会干扰一氧化氮介导的血管舒张作用,导致炎症因子增加,还会促进糖化低密度脂蛋白的氧化过程引起血管斑块不稳定。C反应蛋白和凝血因子的升高、血小板的高反应性增强了促凝作用。这些因素共同作用促进了血管的粥样硬化过程,导致微血管和大血管病变[17]。此外,高糖状态还会影响白细胞的功能和反应性[18-19]。脊柱手术对软组织剥离多,损伤大,糖尿病患者的血管病变和免疫细胞改变会影响组织血供、切口愈合以及对感染的抵抗能力。对于糖尿病患者,脊柱外科医生应在围手术期予以特别的重视,积极控制血糖,对可能增加术后感染的潜在风险提高警惕、积极干预。
术后感染的病原体种类对患者是否会接受多次清创术具有重要影响,在多因素分析中,MRSA感染的患者进行多次清创术的风险明显高于其他类型细菌感染。自20世纪60年代英国检测出首例MRSA以来,MRSA在世界范围内的感染率逐年升高。由于其对多种抗生素耐药,在医院内传播迅速,危害严重,引起了医疗行业的广泛关注并成为院内感染防控的重点。Kim等[20]对7 019名骨科择期手术患者行术前鼻腔MRSA检测,其中1 588例(22.6%)携带金黄色葡萄球菌,309例(4.4%)携带MRSA,对这些患者使用莫匹罗星软膏涂抹鼻腔,氯己定沐浴,术后切口感染率为0.19%,较既往(0.45%)明显降低;术前携带MRSA的患者术后切口感染率为0.97%,明显高于非携带者(0.14%)。Thakkar等[21]对519例脊柱手术患者术前行鼻腔MRSA检测,其中25例(4.8%)阳性,MRSA阳性组术后切口感染发生率高于MRSA阴性组和甲氧西林敏感金黄色葡萄球菌阳性组(12%vs. 5.73%vs. 1.82%,P=0.01),MRSA阳性组中8%发生由MRSA感染引起的切口感染,而MRSA阴性组仅为 0.61%。其他相似的研究也表明,患者术前携带MRSA与术后MRSA引起的切口感染有关,术前进行MRSA检测并对携带者使用消毒剂进行鼻腔清理、全身擦浴等去定植化措施有可能降低术后由MRSA引起的切口感染风险[21-26]。Tomov等[11]发现在脊柱手术中使用1 g万古霉素粉末结合稀碘伏冲洗可以降低术后切口感染风险,而且细菌培养结果也表明,MRSA的感染率明显下降,使术后感染患者的处理难度有所降低。考虑到MRSA感染会明显增加脊柱手术患者接受多次清创术的风险,所以对于高危患者,可以考虑术前使用消毒剂进行鼻腔清理、全身擦浴,术中局部应用万古霉素粉末等方法进行预防。
既往研究表明,脊柱手术时间越长,术后感染风险越高[27-28]。本研究显示,原始手术时间大于3 h提示脊柱手术后感染患者面临接受多次清创术的风险要明显高于手术时间小于3 h的患者(OR=3.599)。手术区长时间暴露可能增加了病原菌进入人体的机会,组织的长时间牵拉会影响局部血供,不利于术后切口愈合,但造成手术时间延长的因素很多,其中可能包含影响切口感染的混杂因素。
3.4 本研究局限性
由于脊柱手术后切口感染发生率相对较低,本研究时间跨度较大,更为可靠的结论有待多中心、更大样本的研究进一步揭示。本研究为回顾性研究,发生切口感染后缺乏相对规范、系统的资料搜集流程,下一步研究可以考虑探索降钙素原、白细胞介素-6、白细胞酯酶等指标对多次清创的影响。此外,本研究样本中含有部分细菌培养阴性的病例,在以后的研究中应注意规范取材、改进细菌培养方法、采用如聚合酶链反应等新型检测技术提高病原学诊断率。在患者随访中应关注切口感染对患者术后功能恢复的影响,尤其是取出内置物的患者。

