荧光猝灭法测定梨小食心虫性诱剂含量以及田间应用
窦 蕊,杜少芳,王 洋,荆小院,马瑞燕,刘金龙*
(1.山西农业大学基础部/化学生态研究所,太谷 030801;2.山西农业大学植物保护学院,太谷 030801)
随着我国农业产业结构调整,果树的种植品种增多,数量增加,果园作为新型产业逐渐兴起,与此同时,果园害虫的侵害情况也日趋严重,其中为害最为严重的是梨小食心虫。梨小食心虫GrapholithamolestaBusck又名梨小蛀果蛾、东方果蠹蛾、桃折梢虫等,简称“梨小”,属鳞翅目Lepidoptera 卷叶蛾科 Tortricidae,是一种世界性的果树害虫,主要以幼虫蛀食梨、桃、苹果、油桃、樱桃等多种仁果类和核果类果树的果实或新梢[1,2]。近年来,利用昆虫性引诱剂来防治害虫的方法受到广泛推崇[3-5]。昆虫性引诱剂可以用来监测、诱杀和干扰交配等[6-8],具有高效、无毒、无污染、不伤害天敌昆虫等优点[9-13],昆虫性信息素的相关研究和应用倍受国内外学者重视[14]。
在利用性引诱剂防治梨小食心虫的工作中[15-17],使用较多的是载有性引诱剂的反口橡皮塞诱芯。诱芯中的主要活性成分是顺-8-十二碳烯醇乙酸酯(Z8-12:Ac),该化合物易挥发且不易溶于水[18],其挥发量易受风速、温度、天气状况等外界条件的影响。性引诱剂的挥发量会直接影响到诱虫量[19,20],影响诱捕效果。为了获得较好的诱捕效果和精确的监测信息,必须要了解性诱芯在实际应用中活性成分的残留量与释放速率。目前对诱芯中性引诱剂含量的测定主要依靠气相色谱法[21,22],少有文献报道其他有效的分析方法。
本文试图建立一种新方法,可用于测定梨小诱芯中Z8-12:Ac的含量。因为在碱性条件下,荧光物质中性红(NR)与β-环糊精(β-CD)形成包合物[23],使得中性红的荧光强度增强,又因为在相同条件下,β-CD也可与Z8-12:Ac形成包合物[24],而且预试验证明β-CD与Z8-12:Ac的包合能力强于其与NR的包合能力,所以会产生竞争包合作用而导致荧光猝灭现象。基于以上包合竞争原理,本文在 NaH2PO4-Na2HPO4缓冲溶液中首先形成β-CD-NR包合物,接着加入一定量的Z8-12:Ac溶液,测定荧光猝灭程度。根据荧光猝灭程度和Z8-12:Ac浓度间的关系,利用荧光猝灭法来测定Z8-12:Ac的含量,并将其应用于田间诱芯活性成分的测定。本文可为虫情监测预报的精确性以及性诱芯的诱杀效果提供技术手段,避免因活性成分衰减而导致测报信息出现偏差。
1 材料与方法
1.1 仪器试剂
RF5301PC型荧光分光光度计(日本岛津公司);PHS-3C型精密酸度计(上海雷磁仪器厂);SK5200H超声波清洗器(上海科导超声仪器有限公司);AR224CN型电子天平(上海奥豪斯仪器有限公司)。
β-环糊精(β-CD,上海金穗生物科技有限公司),经沸水重结晶两次;中性红(NR,上海金穗生物科技有限公司);梨小食心虫性诱剂 Z8-12:Ac(本实验室自主合成,色谱检验质量分数为 92%[25]);乙醇(体积分数95%);梨小食心虫诱芯(中国科学院动物研究所研制生产,含96个单体的橡胶板,单个约重0.300~0.5000 g),其他试剂均为分析纯。
1.2 荧光测定方法
依次准确移取7.0 mL 0.2 mol/L的NaH2PO4-Na2HPO4缓冲溶液(pH 7.4)、1.0 mL 1.0×10-3mol/L中性红溶液、5.0 mL 1.0×10-2mol/Lβ-CD溶液于25.0 mL容量瓶中,摇匀静置10 min后,加入一定量的5.0×10-3mol/L Z8-12:Ac溶液,或5.0 mL待测试液,双蒸水定容,摇匀,在超声波清洗器中超声反应20 min,然后放置于冰箱中冷却到4 ℃,待上机测定。
在激发波长为460 nm,发射波长为580 nm,在此条件下分别测定各试液的荧光强度F,以及Z8-12:Ac空白荧光强度F0,经ΔF=F0—F计算出荧光猝灭值。激发和发射光谱通带宽度均为5.0 nm。
1.3 诱芯样品液的制备
分别取未使用的和在室外放置14 d的梨小食心虫诱芯各7个,用刀片把每个诱芯切成厚度约1 mm的碎片,并分别转移到具塞三角瓶内,加入30.0 mL乙醇(95%,分析纯),摇匀后在30 ℃水浴中放置2 h,使诱芯中的Z8-12:Ac尽可能溶解到溶剂中[26]。提取完毕后,移液管抽取上层清液,经0.45 μm微孔滤膜过滤转移入样品瓶中,标记为样品液1和样品液2,旋紧瓶盖避光保存待测。
1.4 加标回收试验方法
按1.2的方法分别配制β-CD-NR体系溶液于两个容量瓶中,均加入5.0 mL的样品液1,向其中一份加入5.0 mL 1×10-4mol/L的Z8-12:Ac标准溶液,均定容至25.0 mL,分别测定其荧光强度猝灭值ΔF,由线性关系计算浓度。根据下式计算加标回收率。样品液2用同样的方法处理。加标回收率=(加标试样测定值—试样测定值)/加标量×100%
1.5 田间试验
田间诱蛾试验地点选在山西省太谷县西山底村的桃园。试验树种为桃树,树龄 20~25年生,株行距为 4 m×4.5 m。诱捕器为三角形诱捕器(24 cm×18 cm×18 cm)[27]。在诱捕器内部底面平铺一块长方形(23 cm×17 cm)粘虫板,将梨小食心虫诱芯以细铁丝固定后悬挂于粘虫板上方。诱捕时,将诱捕器由铁丝从上棱穿入,悬挂于树枝遮蔽处,距离地面高度约为1.5 m,诱捕器间隔20 m 以上。根据地形和桃树分布情况,划分试验小区。1个试验小区共放置6个诱捕器,选择其中1个诱捕器为对照(每次记录后需替换未释放的新诱芯),其余5个为持续释放试验。设置3个小区为重复。每天定时记录诱虫量并更换粘虫板。设置释放时间分别为0、7、14、21、28 d,每天统计各个水平处理的诱蛾量,收集各处理水平的试验诱芯,密封保存,待测。
分别取3个同一处理水平的待测诱芯,按本文1.3的方法制备样品液。
1.6 数据统计与分析
用 SPSS 16.0软件进行数据处理与分析;各处理的平均值采用Duncan氏多重比较法检验差异显著性。
2 结果与分析
2.1 Z8-12:Ac对β-CD-NR体系荧光强度的影响
从图1激发光谱(a)和发射光谱(b)可以看出,在碱性缓冲溶液中,中性红(NR)水溶液的荧光强度较弱,其最大激发波长为556 nm、最大发射波长为605 nm;当加入适量的β-CD后,荧光强度明显增大,其最大激发波长蓝移至460 nm,最大发射波长显著蓝移至580 nm,说明β-CD对体系有荧光增敏作用;在NR与β-CD的包合物溶液中加入Z8-12:Ac后,荧光强度降低,其中发射荧光强度降低幅度较大。并且Z8-12:Ac的加入量越大,体系荧光猝灭程度越明显。故本试验根据Z8-12:Ac的浓度与发射荧光强度的猝灭值ΔF之间的相关性,使用工作曲线法测定Z8-12:Ac的含量。
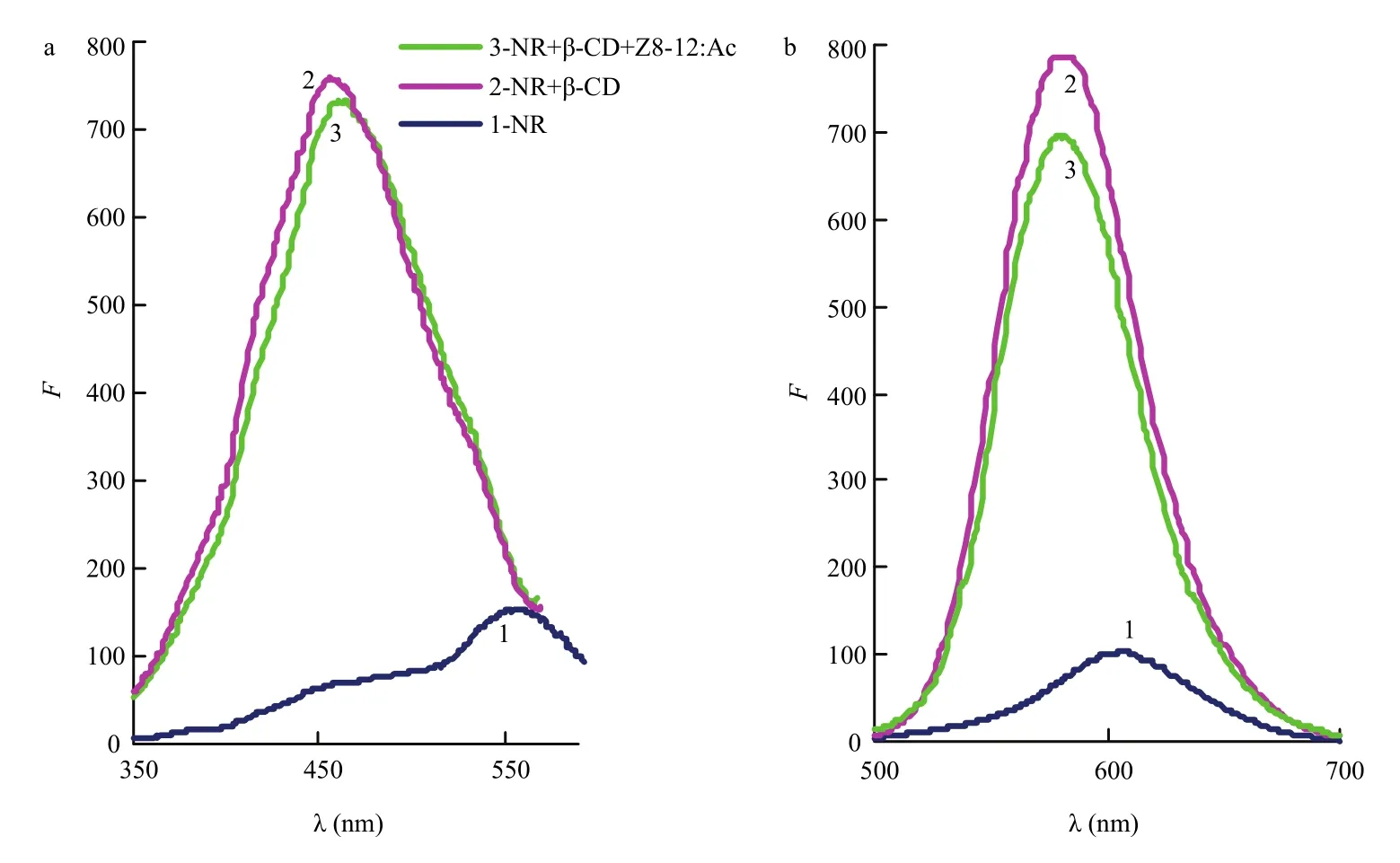
图1 激发光谱(a)与发射光谱(b)(pH 7.4)Fig.1 Excitation spectra (a) and emission spectra (b) (pH 7.4)
2.2 测定条件的优化
2.2.1 缓冲溶液的选择 因为在酸性缓冲溶液中β-CD不与质子态的中性红形成包合物,故按上述试验方法主要考察了弱碱缓冲溶液下的Tris-HCl缓冲溶液、KH2PO4-NaOH缓冲溶液、NaH2PO4-Na2HPO4缓冲溶液和Britton-Robinson广泛缓冲溶液对体系荧光猝灭强度的影响,每个缓冲溶液做3个重复,测定结果见图2。NaH2PO4-Na2HPO4缓冲溶液中体系的ΔF比其他3种缓冲溶液的ΔF大且差异显著,故选择NaH2PO4-Na2HPO4缓冲溶液作为体系介质。
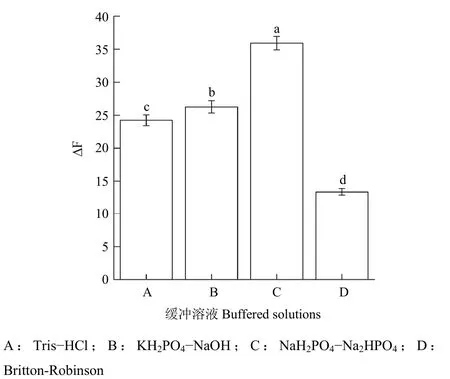
图2 不同的缓冲溶液对应的体系的ΔF值Fig.2 ΔF values of corresponding systems for different buffer media
2.2.2 pH及缓冲溶液体积的影响 分别选用了pH为7.0~8.0的NaH2PO4-Na2HPO4缓冲溶液进行试验。随pH的增大,体系的ΔF增大。在pH为7.4时,ΔF有最大值29.035±0.28;之后随着缓冲液pH的增大,体系的ΔF逐渐减小,因此选定pH为7.4(图3)。
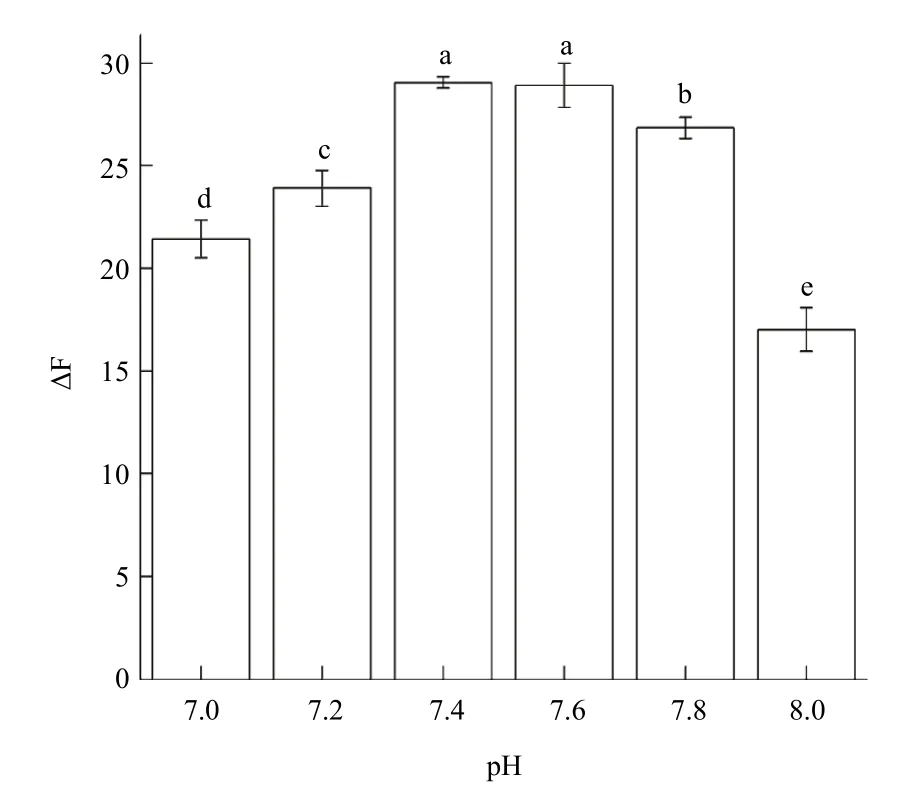
图3 不同的pH对应体系的ΔF值Fig.3 ΔF values of corresponding systems for different pH
试验分别选择了1.0~9.0 mL不同体积的pH 7.4的NaH2PO4-Na2HPO4缓冲溶液,按上述步骤进行试验。随缓冲溶液用量的增加,体系的ΔF逐渐增大,在加入7.0 mL时,ΔF达到最大26.835±0.425,继续增大体积后,ΔF反而有所减小,因此选定缓冲溶液用量为7.0 mL(图4)。
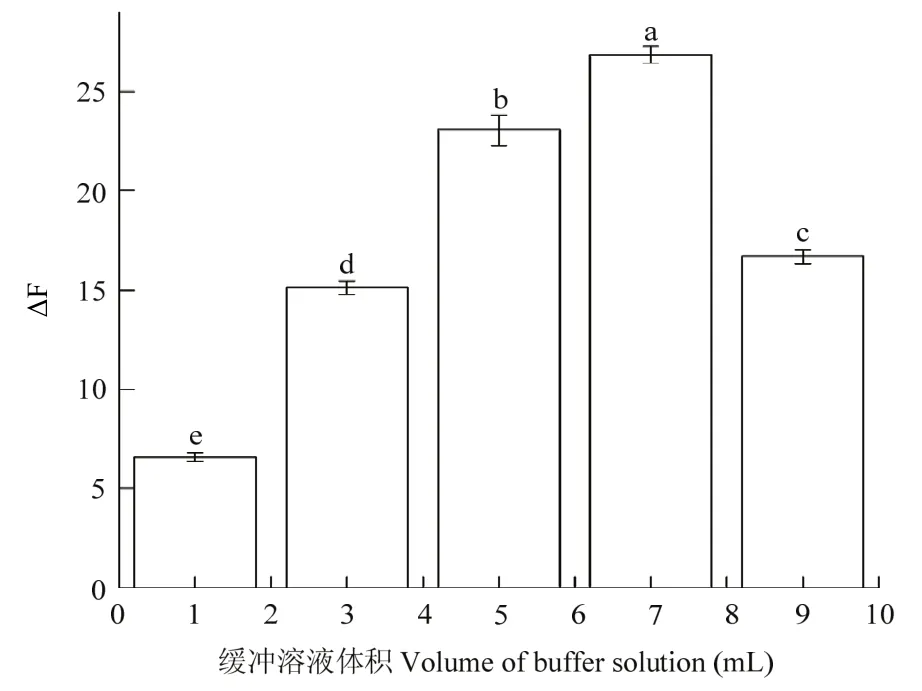
图4 缓冲溶液的不同体积对应体系的ΔF值Fig.4 ΔF values of corresponding systems with different volumes of buffer solution
2.2.3β-CD用量的影响 取7个25.0 mL容量瓶,分别加入1.0~7.0 mL 1.0×10-2mol/L的β-CD溶液,1.0 mL 5.0×10-3mol/L的Z8-12:Ac乙醇溶液,每个体积做3次重复。随着β-CD加入量的增大,其荧光猝灭作用增强。当β-CD的用量为5.0 mL时,体系有最大ΔF值为53.825±0.56,β-CD的用量继续增加时ΔF值反而减小,故选择β-CD溶液的用量为5.0 mL 1.0×10-2mol/L(图5)。
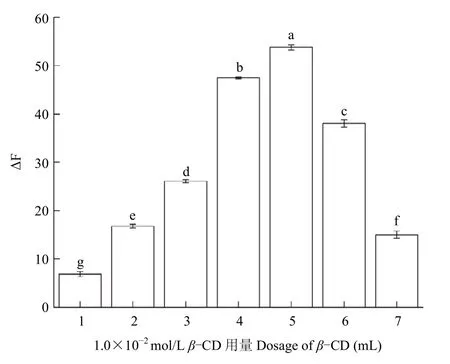
图5 不同用量的β-CD对应体系的ΔF值Fig.5 ΔF values of β-CD with different dosage
2.2.4 中性红用量的影响 取7个25.0 mL容量瓶,分别加入0.20~1.40 mL的1.0×10-3mol/L NR溶液,1.0 mL 5.0×10-3mol/L的Z8-12:Ac乙醇溶液,再加入其他试剂,双蒸馏水加至刻度线定容,按试验方法充分反应后测定荧光强度,每个剂量做3次重复。随着中性红用量的增加,其ΔF逐渐增大,当中性红的用量为1.0 mL时,体系的ΔF值最大,为30.016±0.563。继续加入中性红其ΔF又逐渐减小,故选择中性红用量为1.0 mL 1.0×10-3mol/L(图6)。
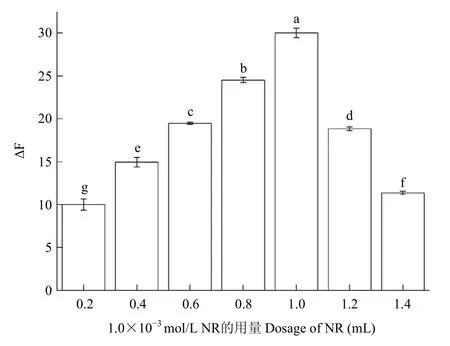
图6 不同用量的NR对应体系的ΔF值Fig.6 ΔF values of NR with different dosage
2.2.5 超声时间的影响 按上述试验步骤进行试验,探究不同超声时间对体系ΔF的影响。超声反应20 min,ΔF值最大为29.53±0.238,而且体系稳定,故选择超声时间为20 min(图7)。
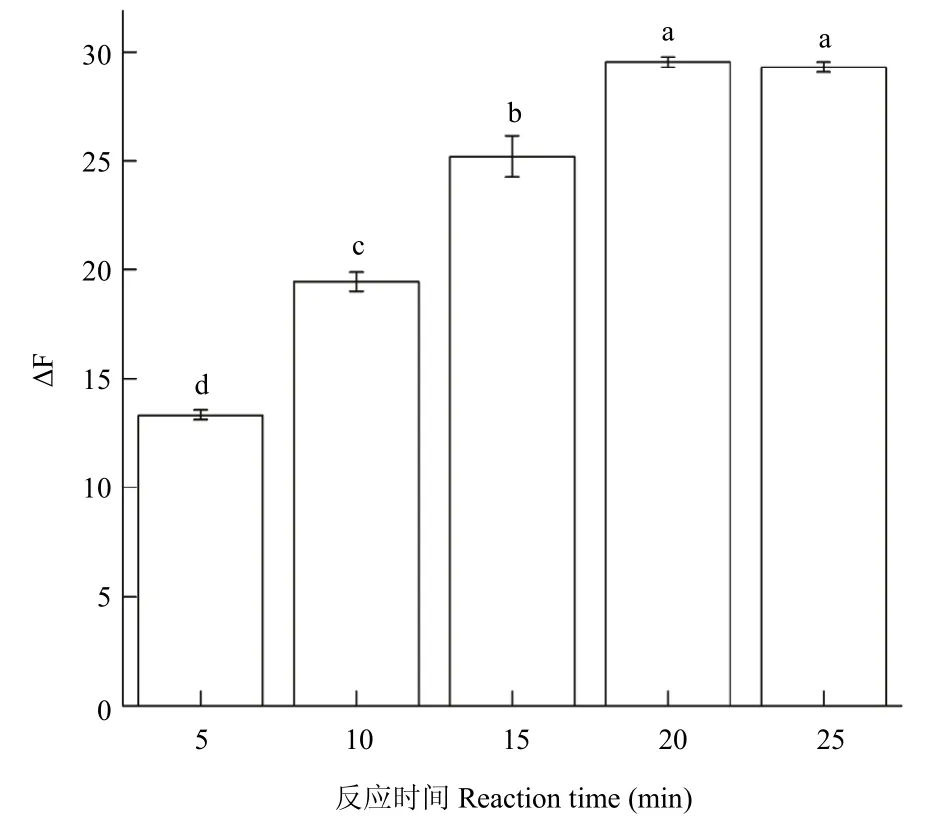
图7 不同反应时间对应体系的ΔF值Fig.7 ΔF values of corresponding systems with different reaction time
2.2.6 体系的稳定时间 超声反应结束后会出现体系变浑浊的现象,不利于光度法测定。因此,将体系置于4 ℃冰箱中,并分别设计了10、20、30、40、50、60 min的冷却时间,每个时间设置3个重复,分别测定其荧光猝灭值,可以看出在4 ℃冷却时,体系荧光猝灭值ΔF在20 min左右变化达到最大,为60.071±0.318,并且体系在60 min内保持稳定(图8)。
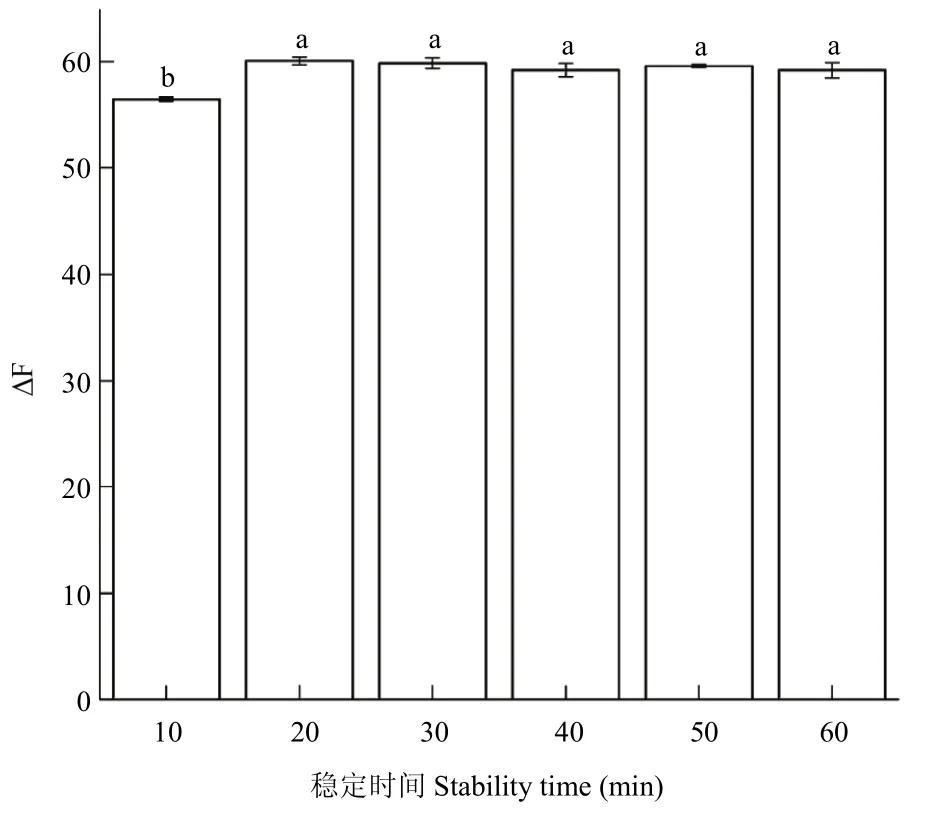
图8 不同稳定时间对应体系的ΔF值(4 ℃)Fig.8 ΔF value of corresponding systems with different stability time(4 ℃)
经过以上条件优化试验,荧光猝灭法测定Z8-12:AC的最佳条件为:7.0 mL 0.2 mol/L的NaH2PO4-Na2HPO4缓冲溶液(pH 7.4)、1.0 mL 1.0×10-3mol/L的中性红溶液、5.0 mL 1.0×10-2mol/L的β-CD溶液于25.0 mL容量瓶中,摇匀静置10 min后,加入一定量的Z8-12:Ac溶液或待测液,定容,摇匀,在超声波清洗器中超声反应20 min,然后放置到4 ℃下冷却20 min,上机测定。
2.3 方法学检验
2.3.1 线性范围及检出限 在7个25.0 mL容量瓶中按上述方法要求分别加入相应反应液后,依次准确加入0.50、0.75、1.00、1.25、1.50、1.75、2.00 mL的5.0×10-3mol/L Z8-12:Ac标准溶液,定容至25.0 mL,使体系中 Z8-12:Ac 的含量依次为 1.0×10-4、1.5×10-4、2.0×10-4、2.5×10-4、3.0×10-4、3.5×10-4、4.0×10-4mol/L。按照上述优化条件处理后,分别测定其荧光强度,并计算出相应的荧光猝灭值ΔF。通过线性回归方程计算,表明体系的荧光猝灭值ΔF与Z8-12:Ac含量在1.0×10-4~4.0×10-4mol/L浓度范围内,呈现良好的线性关系,其线性方程为ΔF=28.3c-16.8,R2=0.9978(图9)。
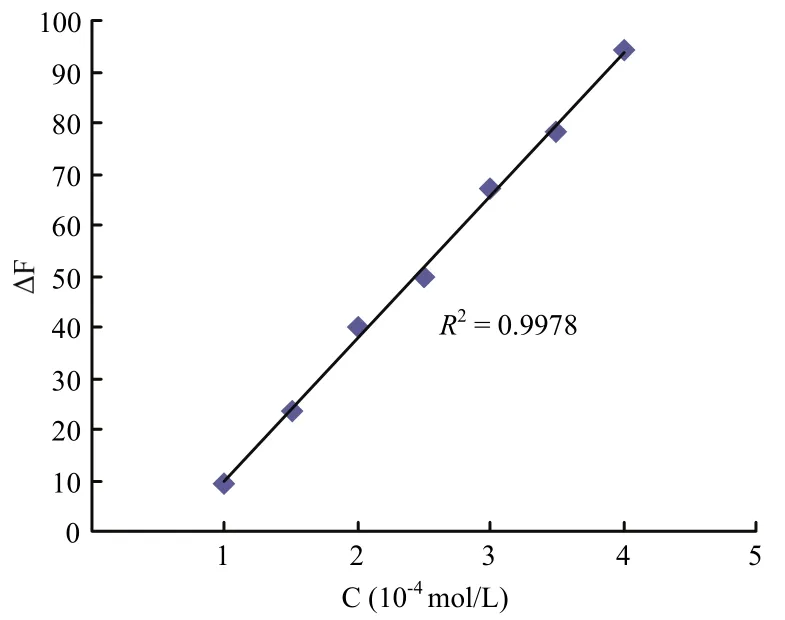
图9 Z8-12:Ac的标准曲线Fig.9 Standard curve of Z8-12:Ac
对2.0×10-4mol/L的Z8-12:Ac标准溶液进行11次平行测定,得出其检出限为1.25×10-5mol/L(S/N=3)。相对标准偏差 RSD为±1.5%,表明方法的灵敏度和精密度良好。
2.3.2 干扰物质的影响 当Z8-12:Ac的浓度为2×10-4mol/L时,相对误差不超过±5%的条件下,按本试验方法考察了以下各干扰物质的允许量(以倍数计),分别是:K+(50)、Na+(50)、Ca2+(50)、Mg2+(50)、NH4+(50)、NO3-(50)、果糖(25)、葡萄糖(50)、甘油(50)。
2.3.3 加标回收率 准确移取两个样品待测液5.0 mL,按试验方法测定Z8-12:Ac的含量,并按照方法1.4进行加标回收试验。可以看出两个样品的加标回收率分别为 98%和 103.0%,均在误差允许范围内,说明测定方法准确度较好(表1)。
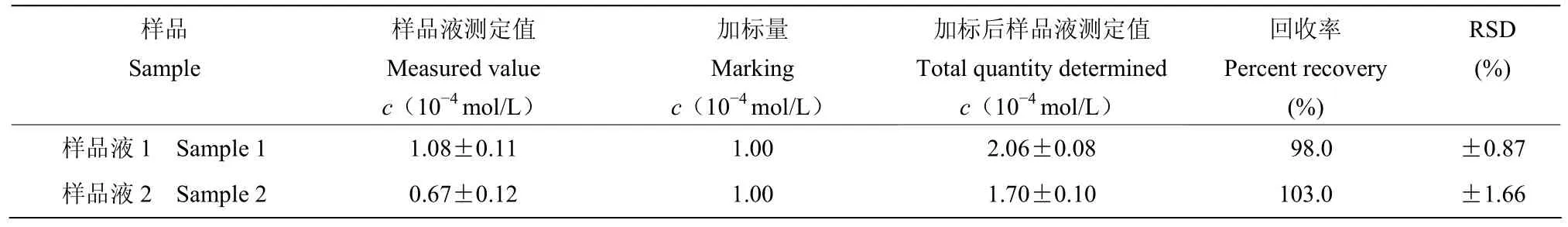
表1 样品中Z8-12:Ac含量的测定结果(n=3)Table 1 Determination results of Z8-12:Ac in samples (n=3)
2.4 田间试验结果
不同处理水平下,梨小食心虫诱芯在田间的诱虫量统计分析和Z8-12:Ac含量的测定结果见表2。可以看出,试验组单个诱芯中Z8-12:Ac平均含量,在不同天数处理下差异显著,说明诱芯在使用中其活性成分含量持续衰减,符合性诱剂的理化特性。对照组单个诱芯7 d诱蛾总量在各个处理间差异显著,在整个田间试验(28 d)出现先增后减的趋势,符合梨小食心虫成虫期的消长规律,而且羽化高峰期出现在第14~21 d。试验组单个诱芯7 d诱蛾总量在处理3和处理4之间差异不显著,与其他处理差异显著,整个田间试验期间(28 d)也出现先增后减的趋势,虽符合梨小食心虫成虫期的消长规律,但没有精确反映出高峰期。由于对照组使用的是Z8-12:Ac足量的新诱芯,而试验组因持续挥发使得诱芯中Z8-12:Ac含量衰减,所以导致高峰期测报模糊。说明荧光猝灭法测定诱芯中性诱剂含量可用于考查田间诱芯含量的变化情况,以便校正测报信息。

表2 田间试验结果(n=3)Table 2 Determination results in the field (n=3)
3 讨论
梨小食心虫性诱剂的主要成分为Z8-12:Ac,本文基于荧光猝灭法对诱芯中Z8-12:Ac的含量进行了测定。β-CD-NR体系中加入 Z8-12:Ac后,荧光强度降低,推测原因可能是因为在β-CD-NR包合物体系中加入Z8-12:Ac后,致使中性红从β-CD的疏水空腔挤出,导致体系的荧光强度降低;而且随着Z8-12:Ac加入量的增大,置换出的中性红越来越多,则生成的β-CD与Z8-12:Ac的包合物越多,体系荧光猝灭程度越大。利用Z8-12:Ac浓度与荧光猝灭值之间的线性关系来测定Z8-12:Ac含量,检出限为1.25×10-5mol/L,建立了一种新型测定 Z8-12:Ac的方法,本方法具有荧光体系稳定、分析成本低、操作简便的特点。梨小性诱芯中Z8-12:Ac的含量可用气相色谱法测定[22],但由于气相色谱法属于痕量分析,进样量较小,使得测定结果精密度不好,而本试验方法学验证相对标准偏差RSD为±1.5%,表明方法灵敏度和精密度好。目前关于Z8-12:Ac的测定检出限尚未见报道,本试验得出其检出限为 1.25×10-5mol/L(S/N=3),可满足诱芯中含量的测定。诱芯中活性成分的含量与田间监测、虫情预报和诱杀效果有关,所以在实际应用中对诱芯含量的测定十分重要。
使用昆虫性信息素来防治害虫,既环保又有好的防治效果,会在以后大量推广。本试验方法可为其他种类的性信息素测定提供思路。但尚有很多问题需要解决:1、提取方法和溶剂还需要改进和完善;2、采用荧光猝灭法定量分析Z8-12:Ac时,虽然稳定性比气相色谱好,但还是达不到气相色谱法或气相色谱-质谱法的灵敏度[21,22],因此下一步工作可以尝试使用其他β-CD的衍生物或者使用其他荧光试剂进行荧光猝灭试验,来提高荧光猝灭法测定的灵敏度,为性诱芯的实际测定提供更准确灵敏的方法依据;3、虽然此方法可以进行含量测定,但所建立的工作曲线的线性范围还较小,在浓度太高(5.0×10-4~1.0×10-3mol/mL)或者太低(1.0×10-5~7.0×10-5mol/mL)时,荧光猝灭值ΔF和Z8-12:Ac的浓度c有线性关系但其线性相关性较差,回归系数仅为0.9233和0.9125,不满足分析方法的要求,因此关于工作曲线的线性范围还需要进一步的深入研究。

